环(L-脯-L-苯丙)二肽——潜在的磷酸二酯酶抑制剂
吴 瑨,陆晓明,段雅乐
(1.华东师范大学 脑功能基因组学教育部重点实验室、上海市脑功能基因组学重点实验室,上海 200062,2.华东师范大学 图书馆,上海 200241)
0 引 言
在现代药物研究中,天然产物的开发和利用占据着重要位置.海洋环境具有高盐、高压、低温等特点,海洋生物为了适应这样独特的生存环境,渐渐进化出了与之相适应的代谢系统和机体防御系统[1].在海洋生物及其代谢产物中,已经发现了许多新颖的生物活性物质,如抗肿瘤药物、生物毒素、酶抑制剂、抗病毒化合物以及抗菌素等[2];因此,海洋资源的开发逐渐成为天然产物开发和利用的热点.在海洋生物资源中,海洋真菌具有种类繁多、分布广泛、次级代谢产物量大、生物活性物质种类丰富等特点,因此从海洋真菌次级代谢产物中筛选生物活性物质,逐渐成为海洋药物资源开发的重要内容[3].
GPR41是GPR40脂肪酸受体家族的一员,其表达分布较为广泛,在人、小鼠及大鼠等物种间的氨基酸序列高度保守.2003年Brown等人发现GPR41的配体是短链脂肪酸,即碳原子数小于6个的有机脂肪酸,如乙酸盐、丙酸盐和丁酸盐[4].GPR41为抑制型G蛋白(Gi)偶联受体,G蛋白活化后对腺苷酸环化酶(AC)起抑制作用,引起环磷酸腺苷(cAMP)水平降低.目前,关于GPR41受体激动剂的筛选以及功能研究目前还所知甚少,已有研究表明GPR41受体参与包括食欲调节、能量代谢以及细胞凋亡等多种生物学现象,该受体在生理和病理情况中可能扮演着重要角色.G蛋白偶联受体是重要的潜在药物靶点,筛选GPR41受体激动剂或拮抗剂既是药物开发的重点,又将有助于推动该受体功能的研究.因此,本实验利用本课题组已构建的GPR41稳定细胞株,从海洋真菌次级代谢产物中筛选GPR41的激动剂.实验结果意外发现,从福建莆田平海湾海藻来源的黄曲霉c-f-3(Aspergillusflavus)中提取到的环二肽类化合物环(L-脯-L-苯丙)二肽(17号)在G41-CHO、G12-CHO、Mock-CHO、SH-sy5y和HEK293等细胞中均能引起cAMP水平升高.腺苷酸环化酶的激活剂forskolin(Fsk)与17号化合物共处理组cAMP水平比Fsk单独处理组进一步升高.因此,17号化合物是通过抑制cAMP降解从而升高细胞内cAMP水平.17号化合物可能是磷酸二酯酶(PDEs)潜在的抑制剂,本实验结果为后续的研究奠定了基础.
1 材料与方法
1.1 材料
DMEM培养基、RPMI-1640培养基、胎牛血清、青霉素、链霉素和G418购自Gibco公司;384孔板购自Corning公司;cAMP检测试剂盒购自法国CIS-Bio公司;用于cAMP测试的单体化合物为中国海洋大学分离提纯并提供[5];其余化学试剂均为国产分析纯试剂.
1.2 实验仪器
CO2培养箱购自Thermo Life sciences公司;Analyst HTTM仪购于Molecular Devices公司.
1.3 方法
1.3.1 细胞培养
人神经母细胞瘤细胞(SH-sy5y)和人胚胎肾细胞(HEK293)购自中科院上海生物研究所细胞库.上述两种细胞用含有10%胎牛血清、100U/mL青霉素和100μg/mL链霉素的DMEM培养基培养.
GPR41-CHO和GPR12-CHO稳转细胞和Mock-CHO细胞由本实验室构建并保存.细胞株建立方法简要说明如下:利用人基因组DNA克隆全长GPR41或GPR12基因并插入真核表达载体pcDNA3.1-N-myc中.构建GPR41或GPR12真核表达质粒,转染CHO细胞后筛选单克隆细胞株.通过定量PCR、Western Blot及cAMP等方法检测GPR41或者GPR12受体的表达和活性.pcDNA3.1-N-myc空载体转染CHO细胞经单克隆筛选、鉴定后命名为Mock-CHO细胞.上述细胞用含有10%胎牛血清、100U/mL青霉素、100μg/mL链霉素和750μg/mL G418的RPMI-1640培养基培养.
1.3.2 用于筛选的化合物作用浓度
本实验利用GPR41受体的内源性配体丁酸钠(butyrate,NaB)作为阳性对照[4],工作浓度为500μmol/L.
单体化合物在筛选过程中分为初筛和复筛,初筛浓度为10μmol/L,1μmol/L和100 nmol/L,每个浓度做1个平行孔.根据初筛结果,选取最适浓度进行复筛,复筛做3个平行孔,每组实验重复3次.
1.3.3 cAMP检测法标准曲线制定
将CIS cAMP检测试剂盒中的cAMP标准品配制成不同浓度,标准品的浓度为2 848(nmol·L-1),将cAMP标准品与Buffer Mix按1∶3的比例倍比稀释,稀释方法如下:

标准品 制备方法 工作液浓度/(nmol·L-1) 终浓度/(nmol·L-1)标准品7 80μL cAMP标准液2 848 712标准品6 20μL标准品7+60μL Buffer mix 712 178标准品5 20μL标准品6+60μL Buffer mix 178 44.5标准品4 20μL标准品5+60μL Buffer mix 44.5 11.1标准品3 20μL标准品4+60μL Buffer mix 11.1 2.78标准品2 20μL标准品3+60μL Buffer mix 2.78 0.69标准品1 20μL标准品2+60μL Buffer mix 0.69 0.17标准品0 60μ L Buffer mix 0 0
cAMP反应每个样品均设复孔.在黑色384孔板中加入5μL标准品和5μL compound buffer,混匀后加入10μL anti-cAMP Cryptate,室温避光反应1h.测665nm和620nm下的荧光值.以cAMP各标准品浓度的对数值为横坐标,以665nm/620nm的荧光值为纵坐标,绘制标准曲线.
1.3.4 cAMP检测法筛选海洋真菌次生代谢产物
将GPR41-CHO,GPR12-CHO,Mock-CHO,SH-sy5y和HEK293细胞分别以每孔103个细胞的密度铺384孔板(孔底和孔壁均为黑色),铺板24h后进行cAMP检测.前人研究已证实GPR41属于Gi偶联受体,因此需先用AC酶激活剂forskolin诱导细胞内cAMP水平升高,当GPR41受体与其配体结合后,导致cAMP浓度降低,以此来测定GPR41的活化情况.而GPR12属于激动型G蛋白(Gs)偶联受体,GPR12受体被配体激活后引起cAMP水平升高.因此,本实验将测试的单体化合物分为两组,一组将被测化合物直接加入细胞,孵育30min后测cAMP浓度;另一组用10μmol/L Fsk预处理细胞30min后,再加入被测化合物作用30min后进行cAMP检测.cAMP检测方法按照法国CIS-Bio公司cAMP检测试剂盒的说明书操作[6],其实验原理为细胞内源cAMP与XL665标记的cAMP竞争结合cAMP抗体,根据样品665 nm/620nm的荧光值,对比标准曲线计算并分析细胞内cAMP水平的变化情况.
1.3.4 数据处理及分析
本实验所有数据及作图均用Sigma-Plot 9.0软件处理,每组实验设3个平行孔并重复3次.实验结果用平均值±标准差表示.
2 实验结果
2.1 GPR41稳定细胞株受体活性验证
本实验利用GPR41受体的内源性配体丁酸钠(butyrate,NaB)作为阳性对照,用于验证GPR41-CHO稳定细胞株具有GPR41受体激动活性.实验结果如图1所示,10μmol/L Fsk在GPR41-CHO和Mock-CHO细胞中均能引起cAMP水平升高(约2~3倍),加入500μmol/L丁酸钠作用30min后,GPR41-CHO细胞内cAMP水平显著下降(P<0.05),而Mock-CHO细胞中cAMP水平未见明显变化(P>0.05).该实验结果验证了GPR41-CHO细胞具有GPR41受体激动活性,也说明本实验运用的cAMP检测方法准确可靠,可用于进行后续受体激动剂筛选.
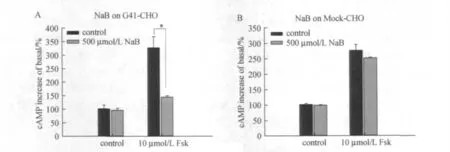
图1 500μmol/L丁酸钠和10μmol/L forskolin作用于G41-CHO和Mock细胞引起的cAMP水平变化Fig.1 Effect of butyrate(500μmol/L)and Fsk(10μmol/L)on cAMP accumulation in GPR41-CHO and mock cells
2.2 GPR41稳定细胞株17号化合物cAMP筛选结果
将17号化合物(1μmol/L和10μmol/L)直接作用于GPR41-CHO细胞,发现17号化合物可以引起G41-CHO细胞内cAMP水平显著升高(P<0.05).用10μmol/L Fsk预处理细胞30min后,再加入17号化合物可引起cAMP水平进一步升高,且fsk与17号化合物共处理组cAMP水平增加比fsk单独处理组具有显著差异(P<0.01),具有剂量效应.有趣的是在Mock-CHO细胞中得到了类似结果.17号化合物在GPR41过表达细胞和mock细胞中均能引起cAMP增加,该实验结果说明,17号化合物引起cAMP水平升高不依赖于GPR41受体.其余化合物未见类似作用.

图2 17号化合物(10μmol/L,1μmol/L)和10μmol/L Fsk作用于G41-CHO和Mock-CHO细胞引起cAMP水平显著增高Fig.2 No.17compound(10μmol/L,1μmol/L)and 10μmol/L Fsk induced a marked increase in intracellular cAMP production in G41-CHO and Mock cells
2.3 GPR12稳定细胞株17号化合物cAMP筛选结果
17号化合物引起GPR41-CHO和Mock-CHO细胞cAMP水平升高,该实验结果说明17号化合物引起cAMP水平变化不依赖于GPR41受体.因此本实验室成功构建的另一种GPCR稳定细胞株(GPR12-CHO)被用于进行cAMP筛选.GPR12为Gs偶联型G蛋白偶联受体,该受体激活后可引起cAMP水平升高[7].实验结果发现,1μmol/L和10μmol/L 17号化合物作用于GPR12-CHO细胞和Fsk预处理过的GPR12-CHO均可引起cAMP水平升高,该实验结果与G41-CHO和mock细胞得到的结果类似,说明17号化合物引起cAMP水平升高不依赖于激活G蛋白偶联受体.

图3 17号化合物(10μmol/L,1μmol/L)和10μmol/L Fsk作用于G12-CHO细胞引起cAMP水平显著增高Fig.3 Intracellular cAMP formation was increased significantly in G12-CHO cells with addition of No.17compound(10μmol/L,1μmol/L)and 10μmol/L Fsk
2.4 SH-sy5y细胞和HEK293细胞进行17号化合物cAMP筛选结果
17号化合物在Gs、Gi偶联受体稳定细胞株和mock细胞内均可引起cAMP升高,该结果说明17号化合物并非通过GPCR活化影响cAMP水平.因此野生型人神经母细胞瘤细胞SH-sy5y和人类胚胎肾细胞HEK293被用于进行后续17号化合物cAMP检测.实验结果发现17号化合物依然能够在SH-sy5y和HEK293细胞中引起cAMP升高.多种细胞的cAMP检测结果说明,17号化合物可能是通过抑制磷酸二酯酶(phosphodiesteras,PDEs)的活性,抑制cAMP的水解,从而增加细胞内cAMP浓度.

图4 17号化合物(10μmol/L,1μmol/L)和10μmol/L Fsk作用于SH-sy5y和HEK293细胞引起cAMP水平显著增高Fig.4 No.17compound(10μmol/L,1μmol/L)can promote the increase of intracellular cAMP in HEK293and SH-sy5y cells in presence or absence of Fsk
2.5 17号化合物结构分析
17号化合物属于环二肽类化合物.该类化合物在人、脊椎动物、无脊椎动物、植物、真菌和细菌中均有发现.由于环二肽形成一个稳定的六元环结构,具有一定的构象约束作用.有两个氢键给体和两个氢键受体,氢键是药物与受体相互作用的主要方式之一,因而环二肽在药物化学中是一个重要的药效团.目前发现许多环二肽具有强的生理活性,如广谱抗菌性能抑制HT-29,HeLa和MCF-7cell lines等癌细胞的生长、引起HT-29cells细胞凋亡等[8],但目前尚未见该化合物与磷酸二酯酶抑制剂有关的报道.将已知的PDE抑制剂如Zaprinast和IBMX的化学结构式与17号化合物进行对比.如图5所示,PDE抑制剂富含N和O,而且位置相对集中,具有疏水钳的结构特征,17号化合物具有相似的特征.因此,我们推测17号化合物通过抑制PDE活性,抑制cAMP降解从而引起cAMP水平升高.
3 讨 论
近年来,从海洋生物资源中已经分离得到了许多结构新颖的海洋生物活性物质[1].其中海洋真菌因具有种类多、分布广泛、次级代谢产物量大等特点,逐渐成为现代药物研究的重点,也逐渐成为发现具有特异活性天然产物的重要途径.
本实验利用GPR41稳定细胞株,从福建莆田平海湾海藻来源的黄曲霉c-f-3中提取到的次级代谢产物进行了受体结合活性的cAMP测定.通过比较GPR41稳转细胞株和Mock细胞株cAMP响应的差异,筛选GPR41受体激动剂.前人研究已证实GPR41是Gi偶联受体,若GPR41被激活应导致cAMP水平降低[4].而本实验结果意外发现环二肽类化合物(17号)在GPR41-CHO细胞和Mock-CHO细胞中均可引起cAMP水平升高.上述实验说明17号化合物并非作用于GPR41引起cAMP升高.此后利用相同的处理方法在Gs偶联型受体GPR12稳定细胞株中检测cAMP水平,实验结果发现17号化合物依然可以引起GPR12-CHO细胞cAMP水平升高.并且在野生型的SH-sy5y和HEK293细胞进行cAMP检测均得出了相似的结果.上述实验结果说明17号化合物并非通过激活GPCR引起cAMP水平升高.而且fsk与17号化合物共处理组比fsk单独处理组cAMP进一步增加,fsk是AC有效的激活剂,上述实验结果提示,17号化合物可能是通过抑制cAMP水解从而引起cAMP水平的持续升高.

图5 PDE抑制剂Zaprinast和IBMX与17号化合物结构对比Fig.5 Comparison of chemical structures between known PDE inhibitors(like Zaprinast and IBMX)and No.17compound
随后,本文分析了17号化合物的化学结构,发现该化合物属于环二肽类化合物.该类化合物在自然界中的植物、动物特别是海洋微生物中广泛存在[9].其结构骨架具有稳定的六元环结构,且有两个氢键给体和两个氢键受体,因此这类化合物有机会成为重要的药效团.将已知的PDE抑制剂化学结构式与17号化合物进行对比发现,17号化合物与已知的PDE抑制剂具有相似的特征,如富含N和O,且位置相对集中,具有疏水钳的结构特征等.因此,推测17号化合物通过抑制PDE活性,抑制cAMP降解从而引起cAMP水平升高.这是首次报道环(L-脯-L-苯丙)二肽(17号化合物)可在多种细胞中(G41-CHO,G12-CHO,Mock-CHO,SH-sy5y和HEK293)引起cAMP升高,但这种化合物是否是特异性磷酸二酯酶抑制剂,仍需要进一步实验证明.
综上所述,海洋真菌次级代谢产物中具有丰富的环二肽类化合物,其中环(L-脯-L-苯丙)二肽可能成为潜在的磷酸二酯酶抑制剂.尽管目前对海洋活性物质的开发起步较晚,仍有许多重要问题需要深入研究探讨,但是以海洋生物活性物质作为先导化合物从中筛选亲和力高、毒性低的先导化合物,根据构效关系进行结构修饰,开发特异性强、活性高、副作用小的天然小分子化合物将对新药的开发产生重要影响.
[1]SPONGA F,CAVALETTI L,LAZZARINI A,et al.Biodiversity and potentials of marine-derived microorganisms[J].Journal of Biotechnology,1999,70(1-3):65-69.
[2]DREYFUSS M,MCHAPELA I H.Potential of fungi in the discovery of novel,low-molecular weight pharmaceuticals[J].Biotechnology,1994,26:49-80.
[3]林爱群.三株海洋真菌次级代谢产物活性成分的研究[D].山东青岛:中国海洋大学,2008.
[4]BROWN A J,GOLDSWORTHY S M,BARNES A A,et al.The Orphan G protein-coupled receptors GPR41and GPR43are activated by propionate and other short chain carboxylic acids[J].J Biol Chem,2003,278(13):11312-11319.
[5]LIN A,LU X,FANG Y,et al.Two new 5-hydroxy-2-pyrone derivatives isolated from a marine-derived fungus Aspergillus flavus[J].J Antibiot(Tokyo),2008,61(4):245-249.
[6]HAVLICKOVA M,PREZEAU L,DUTHEY B,et al.The intracellular loops of the GB2subunit are crucial for G-protein coupling of the heteromeric gamma-aminobutyrate B receptor[J].Mol Pharmacol,2002,62(2):343-350.
[7]UHLENBROCK K,GASSENHUBER H,KOSTENIS E.Sphingosine 1-phosphate is a ligand of the human gpr3,gpr6and gpr12family of constitutively active G protein-coupled receptors[J].Cell Signal,2002,14(11):941-953.
[8]GRAZ C J,GRANT G D,BRAUNS S C,et al.Cyclic dipeptides in the induction of maturation for cancer therapy[J].J Pharm Pharmacol,2000,52(1):75-82.
[9]郭秀春,郑立,周文辉,等.海洋微生物中二酮哌嗪类化合物的研究进展[J].微生物学通报,2009,36(10):1596-1603.

