新型核苷衍生物十八烷氧乙基替诺福韦酯的体内外抗乙型肝炎病毒作用研究
李思阳,李壮,陈淑珍,章天,王淑琴,李毅,陶佩珍,李卓荣
核苷(酸)类似物(NAs)是乙型肝炎病毒(HBV)聚合酶抑制剂,它通过与内源性底物的竞争性结合或是嵌入病毒 DNA 作为链终止来发挥其抗病毒作用,是目前抗 HBV的主要药物品种之一。NAs 可以有效地降低细胞中 HBV的DNA 含量到检测水平以下,并且可以大幅改善临床及病理组织学表现[1]。但是,该类药物普遍存在肾脏毒性较大、易产生耐药和有交叉耐药等问题。替诺福韦(TFV)是无环腺嘌呤单核苷酸衍生物,是病毒逆转录酶或 DNA 聚合酶抑制剂,但由于其结构中磷酸基带负电荷,极性太强,生物膜透过性差,导致生物利用度很低,使其不能成为药物应用于临床[2]。替诺福韦双异丙酰氧基甲酯富马酸盐(TFV-DF,图 1)为其双酯性前药,生物利用度有了一定的提高,但也只有 25%~40%(取决于饮食中脂肪含量)[3]。
替诺福韦的磷酸十八烷氧乙基单酯衍生物(octadecyloxyethyl-tenofovir,ODE-TFV,图 1),是抗 HBV 候选化学药物的一种新型结构。ODE-TFV 与TFV-DF 同为前药化合物,吸收进入体内后游离出活性成分 TFV 发挥抗病毒作用。因此,在应对临床病毒耐药性问题上,该药将具有与TFV-DF 及TFV 相似的特点,即药物本身不易发生耐药、与拉米夫定等环状核苷无交叉耐药。与临床药物 TFV-DF 相比,研究结果显示,ODE-TFV具有更强的化学稳定性和更高的口服生物利用度。本研究即是评价 ODE-TFV 在乙型肝炎病毒基因转染的人肝癌细胞系 2.2.15 细胞和鸭肝炎病毒(DHBV)感染雏鸭模型中抗 HBV的活性,并评价其对肝脏病理的改善效果,为进一步的研究开发提供药效学数据。
1 材料与方法
1.1 主要材料
1.1.1 药物 ODE-TFV 由本研究组分批合成,纯度为93.8%~97.2%。TFV-DF 由本研究组制备合成,纯度 98.7%,以 0.3% 羧甲基纤维素钠制备成悬液备用。阳性药物拉米夫定(3TC)为英国 Glaxo Wellcome公司生产,批号:2005110011,用生理盐水配制实验用溶液。
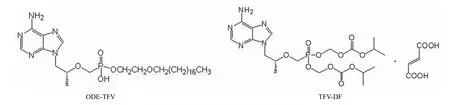
图1 ODE-TFV 及TFV-DF结构式Figure1 Chemical structure of ODE-TFV and TFV-DF
1.1.2 细胞 乙型肝炎病毒 DNA 克隆转染人肝癌细胞(Hep G2)的2.2.15 细胞系由美国 Mount Sinai 医学中心构建,本所病毒室引进后自行传代培养。
1.1.3 试剂及仪器 放射性同位素 α32P dCTP 为美国 PE公司产品,比活度为9.25 MBq;探针标记用的随机引物试剂盒购自美国 Promega公司;Sephadex G-50,Ficoll PVP 购自瑞典 Pharmacia公司;SDS 为德国 Merck公司产品;牛血清白蛋白购自中国科学院生物物理所;0.45 μmol/L的硝酸纤维素膜是瑞典 Amersham公司的产品。
1.1.4 病毒 鸭乙型肝炎病毒 DNA(DHBVDNA)阳性鸭血清采自上海麻鸭,–70 ℃ 保存。
1.1.5 实验动物 1 日龄北京鸭,购自北京前进种鸭饲养场。
1.2 方法
1.2.1 在2.2.15 细胞培养中对 HBV-DNA的抑制试验
1.2.1.1 细胞毒性试验 ODE-TFV 配成10 mmol/L的母液,用 2.2.15 细胞培养液配成所需浓度,然后用培养液从 200 μmol/L 开始 3 倍稀释,共 4个浓度,加入 96 孔细胞培养板,每浓度 3 孔,每 4 天换同浓度药液,设空白对照组,培养 8 d。显微镜下观察细胞病变,完全破坏为4;75% 破坏为3;50% 破坏为2;25% 破坏为1;无病变为0。计算每浓度药液平均细胞病变程度和抑制率。按 Reed & Muench 法计算半数毒性浓度(TC50)。
1.2.1.2 HBV-DNA的抑制试验 各浓度组药液及细胞对照组的2.2.15 细胞上清液按分子克隆实验技术方法提取 HBV-DNA,各样品分别进行斑点杂交、放射自显影,用酶标检测仪测定 IOD 值,计算血清 HBV-DNA 密度,以杂交斑点 IOD 值作为标本 HBV-DNA 水平值,计算 HBV-DNA 抑制率、半数有效浓度(IC50)和选择指数(SI)。本实验重复 3 次,取平均值。
HBV-DNA 抑制率(%)=(IOD细胞对照-IOD给药组)/ IOD细胞对照×100%。
1.2.2 在鸭肝炎病毒感染雏鸭模型中对 DHBVDNA的抑制试验
1.2.2.1 鸭乙型肝炎病毒感染 1 日龄北京鸭,经腿胫静脉注射上海麻鸭 DHBV-DNA 阳性鸭血清,每只 0.2ml。感染后第 7 天取血,分离血清,置于–70 ℃ 保存待检(T0)。
1.2.2.2 药物治疗试验 将 48只感染鸭按随机区组分组法[4]分为8组:病毒对照组;ODE-TFV高、中、低剂量组(200、100和50 mg/kg);阳性药 TFV-DF 高、低剂量对照组(200和100 mg/kg);阳性药 3TC 高、低剂量对照组(80和40 mg/kg)。所有药物均灌胃给药,每日 2 次,共给药 14 d,分别在感染后第 7 天即给药前(T0),给药后第7 天(T7),第 14 天(T14)及停药后的第 3 天(P3),自鸭腿胫静脉取血,分离血清,置–70 ℃ 保存待检。
1.2.2.3 检测方法 取上述待检鸭血清,每批同时点膜,测定鸭血清中 DHBV-DNA 水平的动态变化。按试剂盒说明书方法,用32P 标记 DHBV-DNA探针,并作鸭血清斑点杂交,放射自显影膜片斑点,以杂交斑点 IOD 值作为标本 HBV-DNA 水平值。
1.2.2.4 数据处理 计算每组鸭不同时间血清DNA IOD 值的平均值,以表示,并将每组鸭用药后不同时间(T7、T14)和停药后第 3 天(P3)的血清 DHBV-DNA 水平与同组给药前(T0)IOD值比较,采用配对 t 检验,计算 t1、P1值。分析差异的显著性,判断药物对病毒感染的抑制效果。计算每组鸭用药后不同时间(T7、T14)和停药第 3 天(P3)的血清 DHBV-DNA的抑制率。
血清 DHBV-DNA 抑制率(%)=(IOD给药前-IOD给药后)/IOD给药前×100%。
将给药治疗组不同时间的DHBV-DNA 抑制率分别与病毒对照组相同时间的DHBV-DNA 抑制率作比较,采用成组t 检验,作统计学处理,计算 t2、P2值,分析差异的显著性,判断药效。
1.2.3 对肝组织病理学改善作用的试验 鸭乙型肝炎病毒的感染和给药方法同 1.2.2.2,阳性对照药3TC的剂量改用 35、70 mg/kg,给药 14 d,停药,即刻杀死小鸭,取肝脏。经固定、脱水、包埋后进行切片,染色后在光学显微镜下观察各组肝脏病理变化并进行比较。在细胞浸润观察中,±表示基本未见或有微量炎细胞浸润;+ 表示少量炎细胞浸润;++ 表示中等量炎细胞浸润或少量炎细胞浸润加片状炎细胞浸润;+++ 表示大量炎细胞浸润或中等量炎细胞浸润加片状炎细胞浸润。在肝细胞弥漫性气球样变性的观察中,–表示基本未见肝细胞弥漫性气球样变性;+ 表示肝细胞弥漫性气球样变性。在肝细胞灶性坏死的观察中,–表示基本未见肝细胞呈灶性坏死;+ 表示肝细胞呈灶性坏死。
2 结果
2.1 在2.2.15 细胞培养中对 HBV-DNA的抑制作用
样品对 2.2.15 细胞 TC50及在2.2.15 细胞培养中对 HBV-DNA的抑制作用的结果见表1。由表1 可知,ODE-TFV 对 HBV-DNA 复制显示出强抑制活性,较阳性对照药 TFV-DF和3TC 分别提高约 18 倍和13 倍,ODE-TFV的选择指数也明显高于TFV-DF。
2.2 在鸭肝炎病毒感染雏鸭模型中对 DHBV-DNA的抑制作用
实验药物对鸭血清 DHBV-DNA的抑制作用见表2。本批实验感染鸭共 48只,血清 DHBVDNA 全部呈阳性。病毒对照组6只雏鸭在实验全程 24 d 内血清 DHBV-DNA 水平感染后基本平稳。全程不同时间血清 DHBV-DNA 有自然波动。ODE-TFV 100 mg/kg组鸭血清 DHBV-DNA 抑制率与病毒对照组相比,在T7、P3有显著性差别(P<0.05)。ODE-TFV 200 mg/kg组在T7、P3血清DHBV-DNA 抑制率与病毒对照组比较,有显著性和非常显著性差别(P<0.05、P<0.01)。阳性对照药 TFV-DF 200 mg/kg组在P3血清 DHBV-DNA抑制水平与病毒对照组相比,有显著性意义(P<0.05),其他时间段成组对比,虽有抑制作用,但无显著性差异。对照药 3TC 40 mg/kg组在T7、T14,鸭血清 DHBV-DNA 抑制率与病毒对照组相比,有显著性意义(P<0.05)。3TC 80 mg/kg组在T7、T14,鸭血清 DHBV-DNA 抑制率与对照组相比,均有显著性差别(P<0.05)。
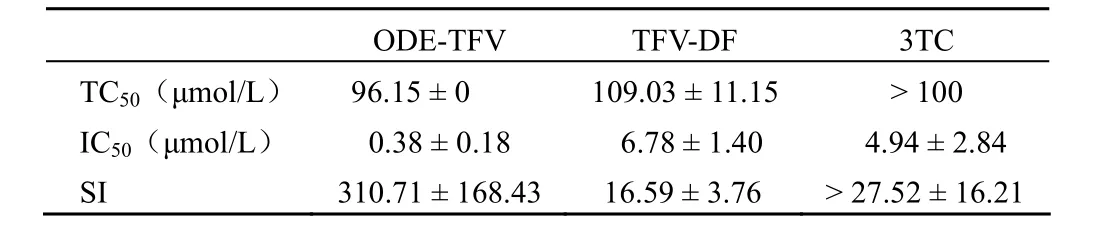
表1 ODE-TFV、TFV-DF和3TC 在2.2.15 细胞中的细胞毒性与对 HBV-DNA的抑制作用Table1 Cytotoxicity and inhibitory effects of ODE-TFV,TFV-DF and 3TC on HBV-DNA in cell line 2.2.15
如若把给药剂量单位由 mg/kg 折算成 mol/kg,3 种试验药物的给药剂量分别为:ODE-TFV 为0.086、0.17和0.34 mol/kg;TFV-DF 为0.17和0.32 mol/kg;3TC 为0.18和0.35 mol/kg。在几乎等摩尔剂量下(0.17和约 0.34 mol/kg),ODE-TFV在T7、3TC 在T7和T14对 DHBV-DNA 复制显示出明显的抑制作用,而在停药后第 3 天,ODE-TFV 治疗组仍然显示出一定的持续抑制病毒作用,3TC 治疗组停药后鸭血清病毒 DNA 水平明显反跳。
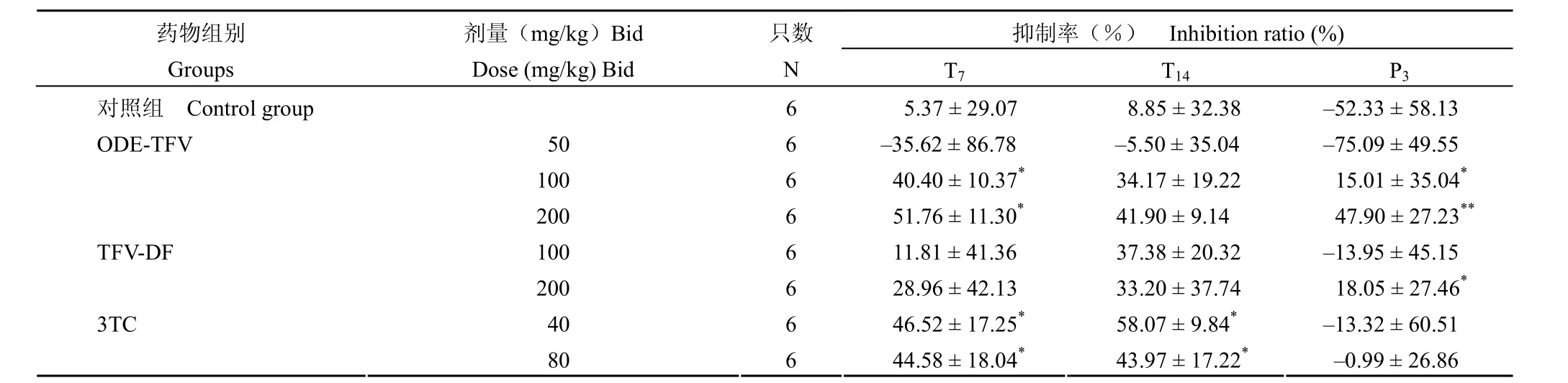
表2 ODE-TFV 对鸭血清 DHBV-DNA的抑制作用Table2 Inhibition effect of ODE-TFV on duck serum DHBV-DNA
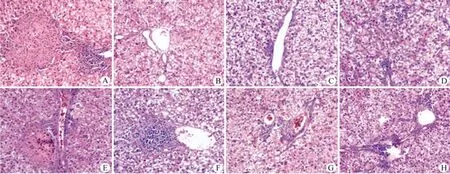
图2 ODE-TFV 对 DHBV 感染的鸭肝脏病理学的影响(20×)Figure2 Hepatic pathologic effects of ODE-TFV on DHBV infected duck liver (20×)
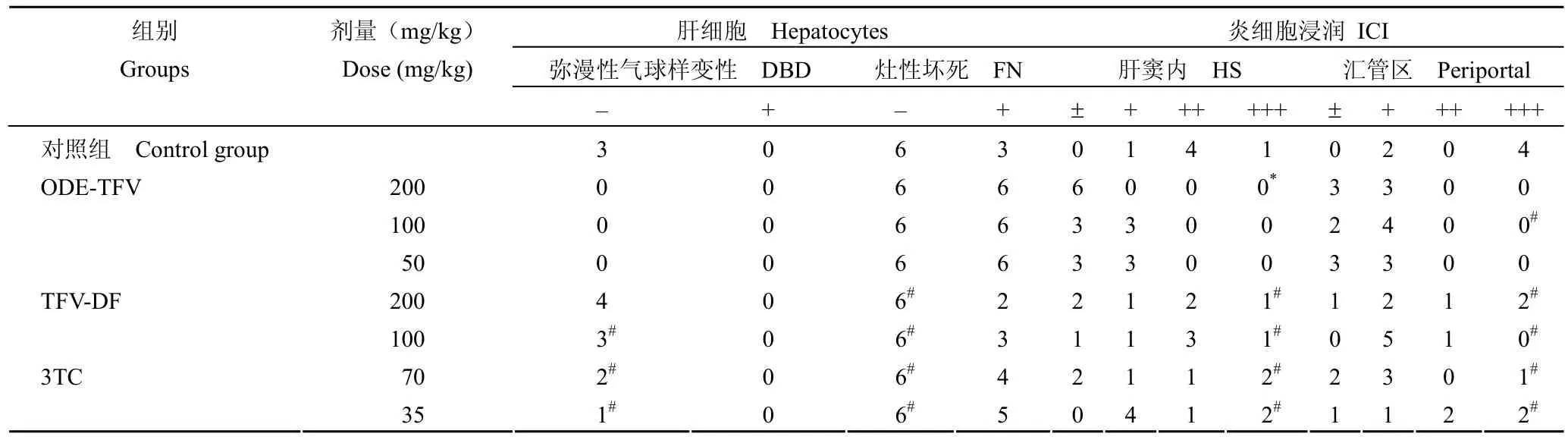
表3 鸭肝脏光学显微镜检查结果Table3 The result of ducks liver inspected by optical microscope
2.3 对 DHBV 感染雏鸭的肝脏病理改善效果
DHBV 感染雏鸭模型体内抑制病毒作用实验结束时,留取实验肝脏组织进行病理学观察(图 2和表 3)。病毒对照组鸭肝病理切片经 HE 染色后,可观察到的主要病变为肝脏细胞气球样变性、肝细胞坏死和炎细胞浸润。ODE-TFV 治疗组的鸭肝脏病理切片显示,炎症细胞的浸润和肝细胞坏死得到显著改善,肝窦内炎细胞浸润的改善存在一定的剂量关系,剂量越大,改善越明显(图 2B、2C、2D);TFV-DF组,炎细胞浸润和对照组相比有所改善,但不如相同剂量的ODE-TFV组改善明显(图 2E、2F);3TC组病理结果表明,3TC 可以一定程度改善肝细胞坏死和炎细胞浸润,不过,其改善效果也不如 ODE-TFV各组明显(图 2G、2H)。但是,所有给药组对鸭肝细胞气球样变性均没有明显改善。
3 讨论
本研究对 ODE-TFV 体外活性的评价是以人肝癌细胞系 2.2.15 细胞作为模型,以阳性药物TFV-DF和3TC 作为对照,检测目标化合物ODE-TFV的抗病毒效果。实验结果显示,在2.2.15细胞培养内 ODE-TFV 对 HBV-DNA的抑制活性较 TFV-DF和3TC 分别强约 18 倍和13 倍,体现出了较强的抑制病毒复制的作用。但是,2.2.15细胞模型也存在一定的缺陷:不同于自然感染,在该细胞株中,HBV 基因组整合在宿主细胞的染色体上;复制方式与自然感染不同,并且很难被清除;病毒的复制水平不能人为改变,并且复制水平低;2.2.15 细胞虽再现了 HBV 在肝细胞的复制和表达,但脱离了机体免疫系统对 HBV 产生影响的环境。因此,应用该模型进行的实验研究只能反映出药物对 HBV的直接抑制作用,但不能反映药物通过免疫功能来发挥间接抗 HBV的作用[5]。
本研究利用 DHBV 感染雏鸭模型评价ODE-TFV 体内抗病毒活性及改善肝脏病理的作用。研究结果显示,ODE-TFV 低剂量组未表现出明显的抗病毒活性,ODE-TFV的中、高剂量组对DHBV-DNA的复制有明显的抑制作用。同时,我们也观察了 ODE-TFV 在鸭体内对 DHBV 感染的肝脏病理学的改善,结果表明,ODE-TFV能够有效改善 DHBV 引起的肝细胞坏死和炎细胞浸润,有一定量效关系。综合以上研究结果,我们不难发现,ODE-TFV 作为新的非环核苷类抗病毒化合物,在体内外对 HBV 均具有明显的抑制活性和改善肝脏病理的作用,与对照药 TFV-DF 及3TC相比较,也有较好的抗病毒效果,值得进一步深入研究。
[1]Dienstag JL.Benefits and risks of nucleoside analog therapy for hepatitis B.Hepatology, 2009, 49(Suppl 5):S112-S121.
[2]Paredes R, Clotet B.Clinical management of HIV-1 resistance.Antivir Res, 2010, 85(1):245-265.
[3]Jenh AM, Pham PA.Tenofovir disoproxil fumarate in the treatment of chronic hepatitis B.Expert Rev Anti Infect Ther, 2010, 8(10):1079-1092.
[4]Zhao W, Sun GZ.Commonly used stochastic grouping methods of experimental animals.Chin J Anim Husbandry Vet Med, 2009(4):61-62.(in Chinese)赵伟, 孙国志.常用实验动物随机分组方法.畜牧兽医科技信息,2009(4):61-62.
[5]Sells MA, Zelent AZ, Shvartsman M, et al.Replicative intermediatesof hepatitis B virus in HepG2 cells that produce infectious virions.J Virol, 1988, 62(8):2836-2844.

