凉血化瘀方对急性肝损伤大鼠线粒体和内质网应激凋亡途径的影响*
周 琼 毕 蕾 颜晓静 姜泽群 陈卫平△
(1.南京中医药大学基础医学院,江苏 南京 210023;2.南京中医药大学附属医院,江苏 南京 210029)
笔者前期的研究已初步探明了凉血化瘀方通过抗细胞凋亡保护肝细胞防治肝损伤[1]。本实验将在此基础上用D-氨基半乳糖(D-GalN)联合内毒素脂多糖(LPS)以仿造人类肝炎法建立大鼠急性肝损伤模型,观察凉血化瘀方对肝细胞凋亡和线粒体、内质网应激(ERS)途径相关蛋白的影响,进一步探讨凉血化瘀方抗肝细胞凋亡的途径和机制。
1 材料与方法
1.1 动物 SD健康雄性大鼠50只,体质量200~250g,由南京中医药大学实验动物中心提供,动物合格证号SCXK(沪)-2012-0002。
1.2 药物 凉血化瘀方组成:赤芍、生地黄、制大黄。药材购于安徽省亳州市药材公司,由南京中医药大学中药鉴定教研室鉴定。称取赤芍300 g,生地黄200 g,制大黄200 g置不锈钢锅中加水3000 mL浸润1 h,然后置电炉上加热煎煮3次,煎煮时间分别为1h、40min、40 min,过滤合并滤液,浓缩成含生药量1 g/mL,备用。使用时用0.9%氯化钠注射液稀释至所需浓度。按体表面积换算大鼠每日用量,等效量为 4506.5 mg/(kg·d),临用前用蒸馏水配成所需浓度(低、中、高剂量分别为1/2、1、2 倍等效量)。
1.3 试剂及仪器 试剂D-GalN购自南京美好生物工程研究所,批号:110225。内毒素LPS购自 Sigma公司,货号为O127:B8。TUNEL细胞凋亡原位检测试剂盒(FITC标记POD法,石蜡切片专用)购自 Roche公司。兔抗大鼠 Caspase-9、Caspase-3、Bcl-2、Chop 多克隆抗体和相应二抗购自英国Abcam公司。β-actin购自CST公司。ECL发光试剂购自Pierce公司,其余试剂为分析纯。仪器为OLYMPUS荧光多功能显微镜,日本OLYMPUS公司生产。JEM-1010透射电镜为JEDL公司生产。台式高速冷冻离心机5810R型,Eppendorf公司。台式低速离心机80-2型,上海医疗器械(集团)有限公司。电泳系统:Mini-Proten Tetra System,Bio-RAD公司。图像分析仪:CMIAS98A,北航。凝胶成像仪:GelDoc 2000 System,Bio-RAD 公司。
1.4 分组与造模 SD健康雄性大鼠50只,动物从1~50编号,采用SPSS12.0编程,随机分成5组,正常对照组,模型组,凉血化瘀方高、中、低剂量组。末次给药后1 h,除正常对照组外,其余4组按0.1 mL/10 g腹腔注射 GalN(50 mg/mL) +LPS(0.48 μg/mL),造成大鼠急性肝损伤模型。造模后6 h取肝组织检测指标(前期实验表明造模6 h细胞凋亡率达高峰,以下各项实验将参考此时间点设计指标检测时间)。
1.5 标本采集与检测 (1)肝组织病理检测。大鼠肝脏离体后经10%甲醛固定、取材、脱水、浸蜡、包埋,再切成4 μm厚切片,HE染色,光镜观察,同时对肝组织病变程度作半定量分析。(2)电镜观察肝细胞形态及结构。取1.0 cm×1.0 cm×1.0 cm大小肝组织置于戊二醛溶液(25 g/L)中固定,1%锇酸后固定,超薄切片,电镜下观察肝细胞、细胞器的形态及结构变化,并注意观察有无凋亡的典型形态学变化。(3)TUNEL细胞凋亡原位检测。①常规石蜡组织切片的预处理后,进入标记反应。②阳性对照样本的准备:组织样本在蛋白酶K处理、PBS浸洗后,再加入100 μL DNaseⅠ反应液室温37℃处理10~30 min。③阴性对照样本的准备:在标记反应制备TdT酶反应液时,不添加TdT酶,其余步骤均相同。④标记和显色反应:预处理好的样本PBS漂洗两次,样本周围用吸水纸吸干,每个样本滴加50 μL TdT酶反应液,加盖玻片37℃避光湿润反应60 min(阴性对照片不加TdT酶),PBS漂洗3次,样本周围用吸水纸吸干,滴加50 μL Streptavidin-HRP工作液,加盖玻片37℃湿润避光反应30 min,PBS漂洗3次,滴加50~100 μL DAB工作液,室温显色反应10 min,PBS漂洗3次,苏木素常规染液复染。(4)Western blot检测ERS 凋亡相关蛋白 Caspase-9、Caspase-3、Bcl-2、Chop。将少量组织块置于匀浆器中球状部位,用干净的剪刀将组织块尽量剪碎,加400 μL单去污剂裂解液裂(含PMSF)于匀浆器中进行匀浆,用移液器将裂解液移至1.5 mL离心管中,4℃裂解30 min后12000 r/min离心10 min,取上清即为总蛋白。以BCA法测定蛋白浓度后,取10 μg蛋白加上样缓冲液,10%聚丙烯酰胺凝胶电泳分离。电泳结束后湿法转膜,然后用封闭液4℃封闭1 h,洗膜后加入适当稀释比例一抗抗体、孵育过夜,常规洗膜3次,继而与二抗抗体室温孵育2 h,常规洗膜,显影,定影,读取结果。
2 结 果
2.1 肝组织病理学观察 见表1。正常对照组肝脏由多边行的肝小叶组成,肝小叶结构清晰,中央静脉无明显充血,肝窦无扩张、充血,枯否氏细胞无增生,肝细胞无变性或坏死,胞浆内有糖原空泡,与处死前禁食不好有关,门管区小叶间动脉、小叶间静脉和小叶间胆管无异常,间质无炎细胞浸润,无纤维组织增生。模型组与正常对照组相比,肝脏有点状坏死,肝组织结构紊乱,汇管区炎性细胞浸润,系D-GalN+LPS造成肝脏损伤的典型表现。凉血化瘀方组变性坏死明显减少,炎症细胞数减少,肝组织的损伤修复程度较好,显示了其对GalN+LPS所致大鼠急性肝损伤的抑制作用。
表1 各组病理半定量分析结果和凋亡细胞数比较()
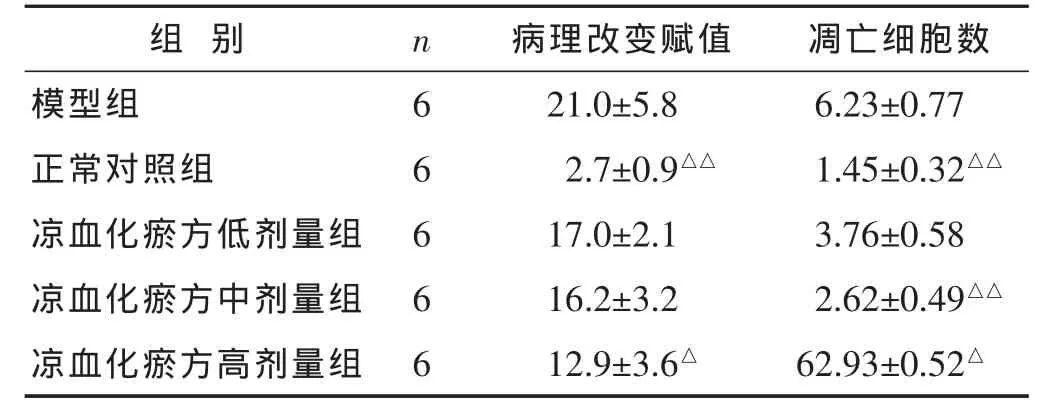
表1 各组病理半定量分析结果和凋亡细胞数比较()
与模型组比较,△P<0.05,△△P<0.01。
2.2 电镜观察肝细胞形态及结构 电镜观察显示,模型组肝细胞体积增大,细胞核型态不规则,核膜皱缩,并可见部分肝细胞呈凋亡样改变,细胞体积明显缩小,染色质凝聚,见图1-1;胞质内线粒体明显肿胀,线粒体嵴稀疏,排列紊乱,基质空泡化,可见有絮状电子致密物出现,细胞质内可见较多次级溶酶体,见图1-2。治疗组肝细胞形态正常,细胞核呈圆形,线粒体无肿胀现象,但可见肝细胞内滑面内质网明显增多,细胞内出现大小不等的脂滴,见图1-3、1-4。
2.3 TUNEL细胞凋亡原位检测 见表1。各组随机挑选6个视野,CMIAS98A图像处理系统体视学图像分析凋亡细胞数密度,计算公式如下:凋亡细胞数密度=棕色细胞数/细胞总面积×1000‰。各组凋亡细胞数密度分别为:模型组 6.23‰,正常对照组 1.45‰,凉血化瘀方高剂量组2.93‰,凉血化瘀方中剂量组2.62‰,凉血化瘀方低剂量组3.76‰。
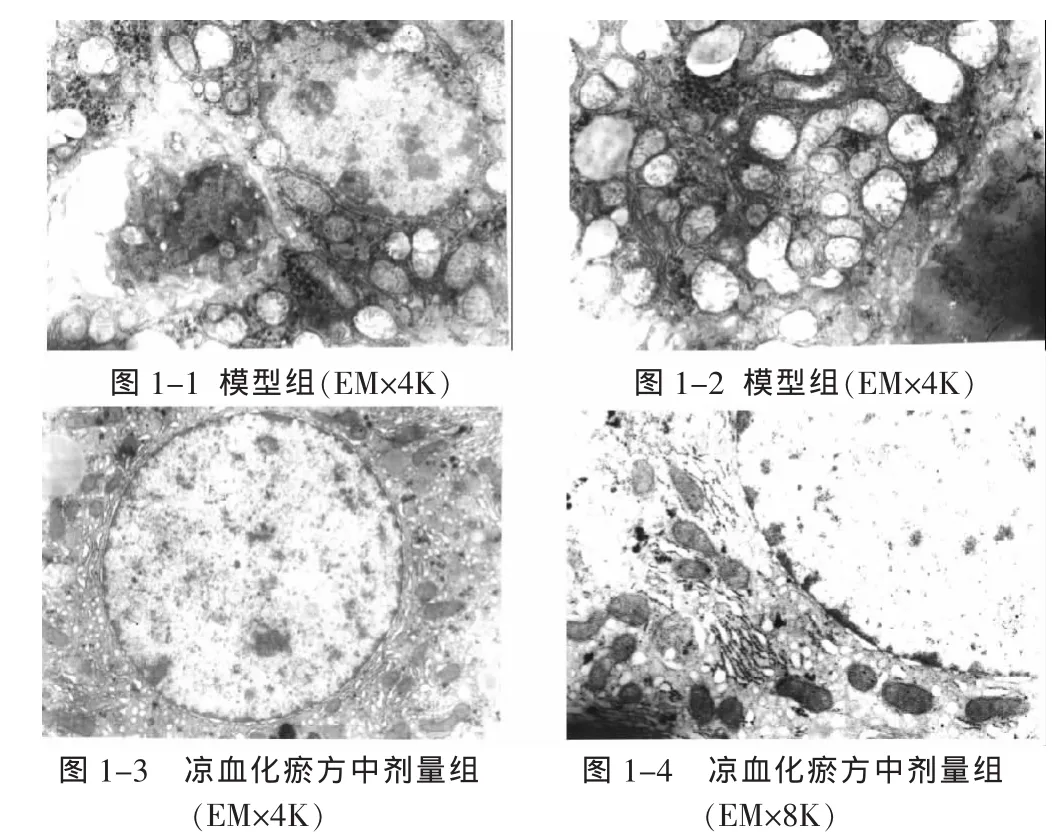
图1 各组肝细胞形态、结构
2.4 Western blot检测ERS凋亡相关蛋白Caspase-9、Caspase-3、Bcl-2、Chop 见图2。凉血化瘀方各剂量组凋亡标志蛋白 Caspase-9、Caspase-3、Chop的表达下调,抗凋亡蛋白Bcl-2的表达上调。
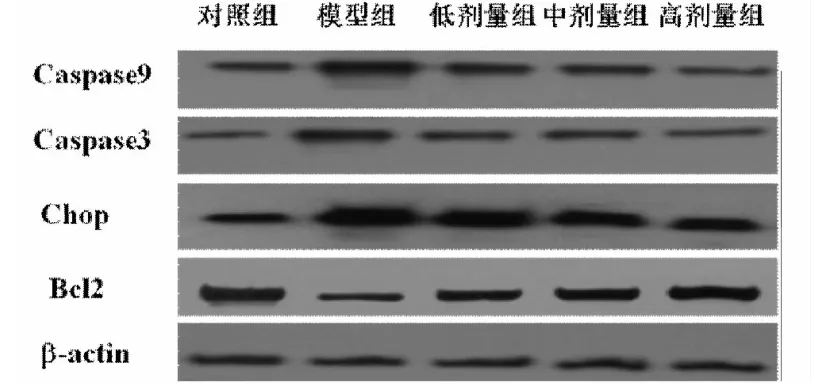
图2 Western blot检测ERS凋亡相关蛋白
3 讨 论
内毒素是触发肝功能衰竭综合症的重要物质基础[2],可诱发肝细胞凋亡,继而导致肝功能衰竭[3]。本实验显示,凉血化瘀方有保护大鼠肝损伤和抗肝细胞凋亡作用。
肝细胞凋亡是造成肝损伤和肝脏疾病基本的中心环节[4-5]。细胞凋亡发生机制主要涉及死亡受体介导的外源性凋亡通路、以线粒体诱导的内源性通路及近年研究发现ERS启动的凋亡途径[6]。近期研究表明,ERS是线粒体应激发生发展的始动环节[7]。笔者前期研究已显示凉血化瘀方抗肝细胞凋亡作用,与死亡受体介导的凋亡相关基因表达调控相关[8],本实验则从线粒体和ERS途径进一步探讨凉血化瘀方抗肝细胞凋亡的作用机制。
线粒体在肝细胞凋亡机制中已成为重要的研究对象,肝细胞损伤后线粒体功能障碍,膜通透性改变,凋亡蛋白包括Cyt-c、Caspase蛋白酶等从线粒体到胞浆,随之引起 Caspase“瀑布式”活化和细胞死亡[9]。而 Bcl-2属抑制细胞凋亡的家族成员之一,其可以与Cyt-c直接结合抑制Cyt-c的释放,还能与Caspase-9和A-paf-1结合并固定于线粒体上从而阻止caspase级联激活。本实验研究显示凉血化瘀方在下调Caspase-9、Caspase-3蛋白表达的同时,还能上调Bcl-2蛋白的上调,从而有效抑制肝细胞凋亡的发生,保护肝细胞。
Chop基因的激活转录则是ERS诱导凋亡的途径之一[10],持续的 ERS 诱发转录活化因子 4(ATF4)的翻译进程,亦可引起Chop表达上调,促进细胞凋亡[11]。实验中凉血化瘀方治疗组肝细胞中Chop表达得以下调,说明其对内质网应激诱导的凋亡通路也有一定的作用。
综上所述,Caspase-9是线粒体途径细胞凋亡标志蛋白之一,由Cyt-c激活,活化的Caspase-9再激活下游的效应酶如Caspase-3等,进而诱发凋亡反应。Chop是ERS诱导凋亡的主要调节蛋白,与内质网相关性细胞凋亡的发生具有特异相关性。Bcl-2是抑制细胞凋亡的调节蛋白,在线粒体和ERS途径细胞凋亡的调节中发挥关键的作用。本研究结果显示凉血化瘀方对上述蛋白表达均有影响,提示其抗肝细胞凋亡作用与对线粒体和ERS途径关键蛋白表达调控相关,而凉血化瘀方对ERS与线粒体途径交互作用的调节机制尚需进一步深入研究。
[1]毕蕾,陈卫平,李卫娜,等.凉血化瘀方对肝衰竭大鼠细胞凋亡相关基因表达的调控作用[J].中国实验方剂学杂志,2009,15(3):32-34.
[2]于海波,宋为芸,王东林,等.慢性重型肝炎患者内毒素检测及临床意义[J].中西医结合肝病杂志,1998,8(4):232.
[3]王宇明,陈耀凯,顾长海,等.重型肝炎命名和诊断分型的再认识—附477例临床分析[J].中华肝脏病杂志,2000,8(5):261-263.
[4]Jaeschke H,Gujral JS,Bajt ML.Apop tosis and necrosis in liver disease[J].Liver Int,2004,24(2):85-89.
[5]吴涛,季光,郑培永,等.内质网应激与肝细胞凋亡[J].世界华人消化杂志,2007,15(23):2507-2515.
[6]关丽英,许彩民,潘华珍.内质网应激介导的细胞凋亡[J].生物化学与生物物理进展,2007,34(11):1136-1141.
[7]李载权,周爱儒,唐朝枢.内质网应激反应分子机理研究进展[J].中国生物化学与分子生物学报,2004,20(3):283-288.
[8]陈卫平,曾莉,丁斐,等.内毒素肝损伤中FADDmRNA表达及凉血化瘀方的影响[J].中国中医急症杂志,2004,13(1):39-40.
[9]赵小祺,王小荣,张静.线粒体相关物质与细胞凋亡[J].河北北方学院学报:医学版,2009,26(6):80-82.
[10]吴涛,季光,郑培,等.内质网应激与肝细胞凋亡[J].世界华人消化杂志,2007,15(23):2507-2515.
[11]Szegezdi E,Logue SE,Gorman AM,et al.Mediators of endoplasmicreticulumstress-inducedapoptosis[J].EMBOreports,2006,7(9):880-885.

