两种交联剂制备软骨细胞移植支架的比较
綦惠,杰永生,陈磊,陶建峰,江建,孙磊
活动关节表面覆盖的透明软骨是一种低摩擦、富弹性、高渗透性的软骨组织,对维持关节的运动功能具有重要意义。由于软骨缺乏再生能力难以修复,外伤、肿瘤或骨性关节炎等原因造成的软骨损伤,最终将导致关节面不完整,临床上主要表现为顽固性疼痛,关节运动功能受限,需行关节融合术或关节置换术,较重的经济负担与较长的术后恢复期严重影响患者生活质量[1-4]。多年来,研究者和临床医生都在探索一种有效的修复方式。随着生物技术、材料科学、免疫组织化学和分子生物学的发展,应用自体软骨细胞移植技术(autologous chondrocyte implantation/transplantation,ACI 或 ACT)治疗软骨损伤已经成为有效的方法[5-7]。支架的研究是自体软骨细胞移植技术的重要课题。为了使支架保持良好的弹性、强度和稳定性,交联是必不可少的步骤之一[8-9]。我们试用两种交联剂对小牛真皮基质来源的支架进行交联,比较细胞毒性、生物相容性和间充质干细胞(mesenchymal stem cells,MSCs)在其表面的贴附效果,为制备可用于 ACI 技术的新型支架提供实验依据。
1 材料与方法
1.1 材料
1.1.1 实验动物和细胞 新西兰大白兔 1 只,雌雄不限,体重 2.5 kg,合格证号 SCSK(京)2010-0010;SPF 级 SD 大鼠 5 只,雌雄不限,体重 210~310 g,合格证号 SCXK(京)2012-0001,均购自北京维通利华实验动物技术有限公司。L929细胞由本单位细胞室提供。
1.1.2 主要试剂 脱毛剂、乙酸、SDS、PBS、戊二醛、水溶性交联剂、苯酚等均为国产分析纯,购自北京化工厂;DMEM 培养基、胎牛血清、胰蛋白酶均购自美国 Gibco 公司;二甲基亚砜(DMSO)、四甲基偶氮唑盐(MTT)、Ficoll 细胞分离液等均购自美国 Sigma 公司。
1.1.3 仪器 C150 型细胞培养箱购自德国Binder 公司;CKX31 型倒置相差显微镜购自日本Olympus 公司;3-18KS 型低温高速离心机购自美国 Sigma 公司;AdVantage 实验型真空冷冻干燥机购自美国 Virtis 公司;680 型酶标仪购自美国Bio-Rad 公司;W4-1 型往复式真空泵购自上海益化真空设备有限公司。
1.2 方法
1.2.1 脱细胞真皮的制备 将新生小牛背部皮肤于脱毛剂中 4 ℃ 浸泡 72 h,脱毛。清洗后,乙酸溶液中浸泡溶胀,切取厚度为 1~2 mm 的真皮层,流水冲洗,获得真皮组织。室温下,在水平振荡器上应用 0.01% SDS 振荡脱细胞,PBS 冲洗过夜,冷冻干燥机中冻干。脱细胞后的真皮基质置于自配的消化液中,室温下超声 1.5 h,进行结构改建。随后用 PBS 冲洗,冷冻干燥机中冻干,初步获得脱细胞真皮基质(acellular dermal matrix,ADM)。
1.2.2 两种交联剂对真皮基质进行交联 将初步制备的脱细胞真皮基质分为两组,用不同的交联剂进行交联。分别将真皮基质浸入 0.05% 戊二醛溶液和 0.2% 水溶性交联剂中,室温下浸泡 30 min。流水冲洗 48 h,蒸馏水清洗 20 次,于冷冻干燥机中冻干。将上述两组分组装袋封口,用60Co 250 万rad 计量照射后备用。
1.2.3 细胞毒性检测 根据 GB/T 16175-2008 和GB/T 16886.5-2003/ISO 10993-5:1999 规定的方法进行材料的细胞毒性检测。复苏 L929 细胞,胰蛋白酶传代至第三代,每孔 100 μl,浓度 4×104/ml铺板。将材料浸提液 2 倍稀释,阳性对照为 64 g/L苯酚溶液,阴性对照为细胞培养液。细胞贴壁 1、3、6 d 后(即第 2、4、7 天),加 DMSO 150 μl,振荡 10 min。酶标仪上,490 nm 波长下测吸光度,取平均值。每孔加 MTT(5 g/L)20 μl,37 ℃,孵育 4 h,弃上层溶液,控干,每孔加 150 μl DMSO,混匀振荡 10 min,阳性对照、阴性对照和稀释后的材料浸提液各加 200 μl,于 490 nm 波长下测吸光度。按照公式:[(OD浸提液- OD阳性对照)/(OD阴性对照-OD阳性对照)]× 100% 计算,数值 ≥ 100%,为 0 级,证明无任何细胞毒性,材料合格;数值在 75% ~99%,为 1 级,极低细胞毒性,材料合格;数值在50%~74%,为 2 级,低细胞毒性,根据材料的性质做综合分析;小于 50% 出现一次,即证实有细胞毒性,材料不合格。
1.2.4 溶血试验 取 4 ml 新鲜兔抗凝全血中加入 5 ml 生理盐水,制得稀释的抗凝兔血 9 ml。实验分为 4 组:①水溶性交联剂组,以水溶性交联剂制备的材料的浸提液稀释 1 倍;②戊二醛组,以戊二醛作为交联剂制备的材料的浸提液稀释 1 倍;③阴性对照组(生理盐水);④阳性对照组(蒸馏水)。每组 3 个样品,每试管放入稀释后的抗凝兔血 0.2 ml,轻轻混匀后,37 ℃ 水浴 1 h。酶标仪 545 nm 测吸光度(OD545),3 个平行样品吸光度取平均值计算实验组溶血率,溶血率(%)=(OD实验组–OD阴性对照)/(OD阳性对照–OD阴性对照)× 100%。
1.2.5 生物相容性检测 SD 健康成年大鼠 5 只,麻醉后在无菌条件下,于大鼠脊柱两侧设计 2 个0.5 cm×1 cm 的长方形皮瓣,相互间隔为 1 cm,蒂部位于背部中间,掀起皮瓣,将消毒好的真皮基质(0.5 cm×1 cm)分别植入大鼠皮下,将皮瓣覆盖真皮,缝合。术后 4、8、12 周沿原切开口切开皮瓣,观察真皮埋植物与周围组织的关系;活检取标本,HE 染色后在光镜下进行组织学观察。
1.2.6 孔隙率测定 材料置于一定体积(V1)的乙醇中,循环抽真空至无气泡逸出,材料和乙醇的总体积记为 V2,将含乙醇的支架材料移出后所剩乙醇体积记为 V3,孔隙率可表示为:P =(V1–V3)/(V2–V3)× 100%。
1.2.7 细胞贴附效果检测 新西兰大白兔用戊巴比妥麻醉,髂嵴背侧用骨髓穿刺针穿刺,取出套管针后,用注射器抽取骨髓(注射器内装肝素溶液),两侧各抽取 3 ml。吹打成细胞悬液,离心,用 Ficoll法分离细胞、洗涤及计数,以 2×105个/ml 的浓度将 MSCs 接种于消毒好的两种材料上,入 37 ℃、5% CO2培养箱培养。电镜观察细胞贴附效果。
1.3 统计学处理
2 结果
2.1 脱细胞真皮交联后的肉眼观察
支架呈瓷白色,蓬松,表面有肉眼可见孔隙。两种交联剂交联前后胶原支架的体积基本不变,均可较好地保持原有支架的形态。
2.2 细胞毒性检测
两种方法制备的支架材料,材料浸提液与 L929细胞作用后,细胞活性均明显高于阳性对照,差异有显著性,与阴性对照相比没有显著差异(表 1)。按照公式:[(OD浸提液–OD阳性对照)/(OD阴性对照–OD阳性对照)]× 100% 计算,数值均大于 75%,因此用本方法制备的载体合格。
2.3 溶血试验
戊二醛作为交联剂制备的支架材料的吸光度值明显高于水溶性交联剂制备的支架材料浸提液的吸光度值(P < 0.05)(表 2)。经计算,戊二醛组的溶血率为 4.61%,水溶性交联剂组的溶血率为2.97% 均符合国标 GB/T-16886 小于 5% 的要求。
表1 MTT 法检测细胞毒性()Table1 Determination of cytotoxicity by MTT assay ()

表1 MTT 法检测细胞毒性()Table1 Determination of cytotoxicity by MTT assay ()
注:*与阳性对照组相比,P < 0.05。Note: *Compared with positive control group, P < 0.05.
组别Groups第 2 天The second day第 4 天The fourth day第 7 天The seventh day戊二醛交联组 Cross-linked with glutaraldehyde 0.520 ± 0.051* 1.421 ± 0.036* 0.314 ± 0.025*水溶性交联剂交联组 Cross-linked with self-made cross-linking agent 0.499 ± 0.056* 1.515 ± 0.039* 0.307 ± 0.016*阴性对照组 Negative control 0.539 ± 0.047 1.378 ± 0.053 0.326 ± 0.008阳性对照组 Positive control 0.077 ± 0.008 0.069 ± 0.007 0.091 ± 0.002
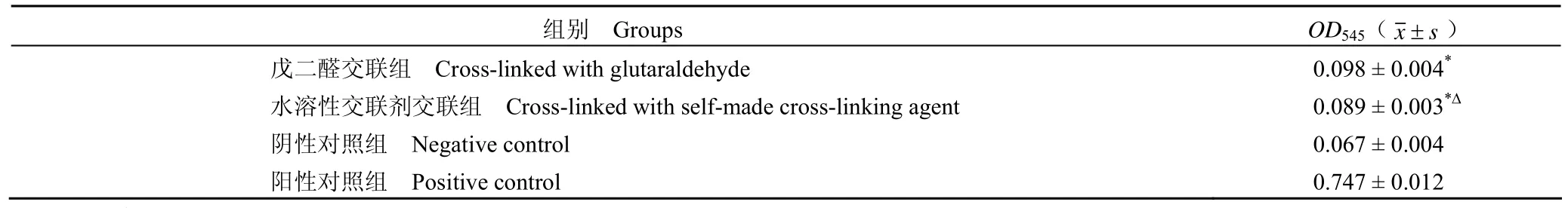
表2 溶血试验结果Table2 The results of hemolysis test
2.4 生物相容性比较
戊二醛交联 4 周,植入物外周有轻度纤维包裹。可观察到中性粒细胞、淋巴细胞、单核吞噬细胞等大量炎细胞浸润,植入物内未见出血或坏死(图 1A);8 周时,植入物外周有明显纤维包裹,可观察到淋巴细胞、单核吞噬细胞浸润,有多处小面积出血坏死区(图 1B);12 周时,植入物外周有轻度纤维包裹,内部有炎症细胞浸润,有大面积坏死和少量小血管长入(图 1C)。而水溶性交联剂交联后的支架,生物相容性较好,仅见植入物外周有轻度纤维包裹,少量炎症细胞浸润,内部未见出血或坏死,纤维包裹层的内、外以及植入物内均有小血管长入(图 2)。
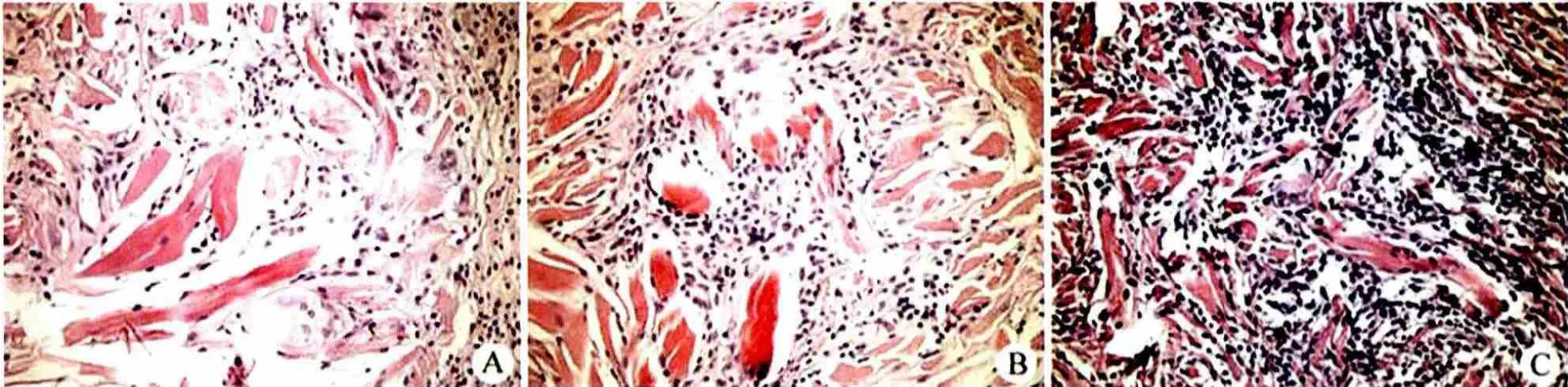
图1 以戊二醛为交联剂的支架大鼠皮下植入后的炎症反应观察(HE 染色,× 200)(A:4 周;B:8 周;C:12 周)Figure1 Biocompatibility test of the scaffold cross-linking with glutaraldehyde (HE staining,×200) (A: 4 weeks; B: 8 weeks; C:12 weeks)

图2 水溶性交联剂交联支架大鼠皮下植入后的炎症反应观察(HE 染色,× 200)(A:4 周;B:8 周;C:12 周)Figure2 Biocompatibility test of the scaffold cross-linking with cross-linking agent (HE staining,×200) (A: 4 weeks; B: 8 weeks;C: 12 weeks)
2.5 孔隙率测定
水溶性交联剂制备的支架材料,三次测定孔隙率分别为 85%、79%、89%,以来表示为84.3% ± 5.0%;戊二醛制备的支架材料,三次测定孔隙率分别为 92%、72%、75%,以来表示为 79.7% ± 10.8%,两者比较,P > 0.05,差异不具有统计学意义。
2.6 细胞贴附效果观察
电镜观察,戊二醛和水溶性交联剂交联制备的支架材料相比,前者的孔隙略小于后者,整体上的孔隙相差不大(图 3)。MSCs 在支架上的贴附比较,前者 MSCs 贴附较少,仅在部分区域发现细胞贴附(图 4A);后者可见 MSCs 成大片状贴附在材料表面,观察到微绒毛和分泌情况(图 4B)。
3 讨论
如何有效地修复关节软骨缺损并最大限度恢复其功能一直是关节外科研究的热点[1-4]。ACI 技术的出现为修复软骨损伤开辟了一条新的道路[5-7]。合适的支架和种子细胞是其中的两个重要条件。
支架的制备是 ACI 技术的关键环节。胶原作为一种天然生物支架,因其生物相容性好、与细胞亲和力高、抗原性低、生物可降解性好、拉伸强度高等优良性质,成为组织工程中应用最广泛的生物支架之一。脱细胞真皮基质的主要成分是 I 型或I/III 型胶原,目前临床上主要用于腭部修复、乳腺重建、鼻部重建以及烧伤后皮肤的重建等[10-11]。

图3 未贴附细胞时,支架的电镜观察(× 500)(A:戊二醛交联;B:水溶性交联剂交联)Figure3 Scaffold without cells (× 500) (A: Cross-linking with glutaraldehyde; B: Cross-linking with cross-linking agent)
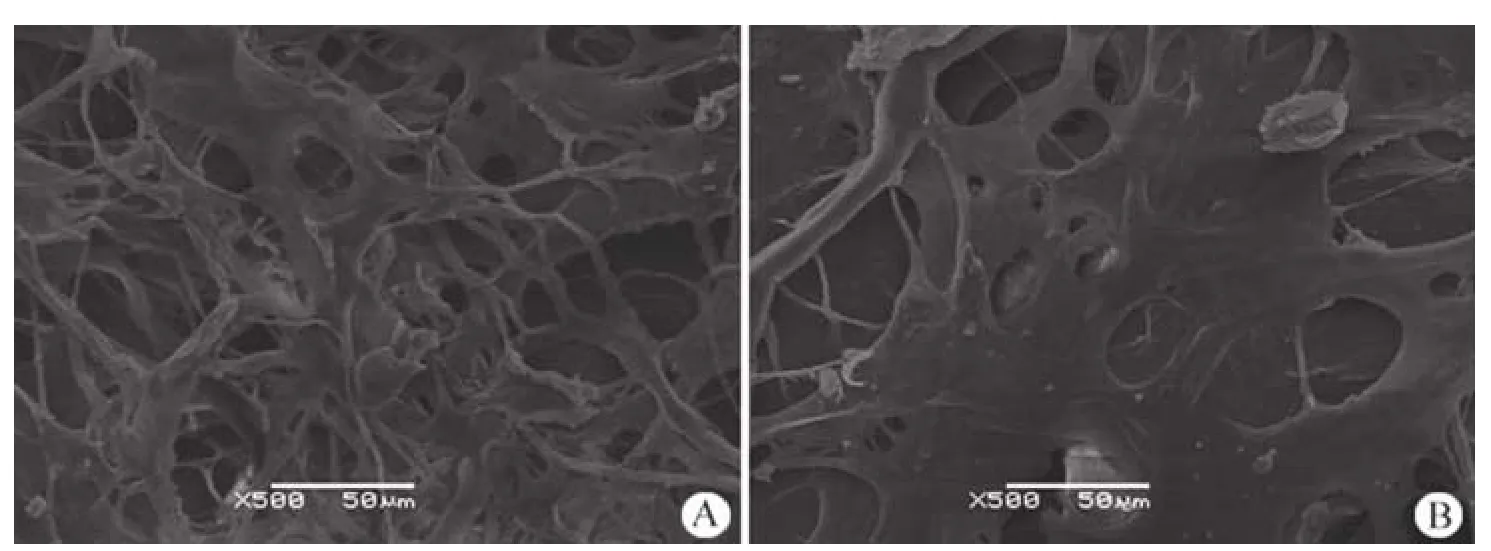
图4 贴附细胞后,支架的电镜观察(× 500)(A:戊二醛交联;B:水溶性交联剂交联)Figure4 Scaffold with mesenchymal stem cells (× 500) (A: Cross-linking with glutaraldehyde; B: Cross-linking with cross-linking agent)
本研究小组自 2003年开始进行 ADM 作为软骨修复支架的研究。经过脱毛-脱细胞-结构改建的真皮组织已经初步具备了作为软骨细胞移植支架的特点,但弹性、强度以及体内的稳定性仍然较差,需进行交联。戊二醛作为一种常用的交联剂成为首选。根据 GB/T 16175-2008GB/T 和 16886.5-2003/ISO 10993-5:1999 规定的方法,戊二醛交联的支架经细胞毒性检测均合格可以用于后续实验。溶血试验也提示,符合 GB/T-16886 要求的小于 5%。但是植入大鼠背部皮肤后,炎细胞浸润、纤维包裹、强烈炎症反应持续存在 12 周,体内生物相容性明显不佳,可能与戊二醛在支架上的残留较难清除干净有关。强烈的炎症反应不利于支架本身促进软骨修复功能的发挥。因此我们试用一种新的水溶性交联剂,该交联剂本身分子上的基团可以与真皮组织中(主要成分为胶原)的氨基发生缩合,使原有结构发生变化,能够形成网络状结构,使结构更为稳定。同时,应用新型交联剂制备的支架与使用戊二醛作为交联剂制备的支架相比,细胞毒性检测合格,溶血率为 2.97%,符合国标要求。而且,植入大鼠背部皮肤直至 12 周仅发生轻微的炎症反应,炎细胞轻度浸润,纤维包裹不严重,并有小血管长入,提示该交联剂制备的支架生物相容性明显优于戊二醛制备的支架。经排液法粗测孔隙率,两种方法制备的支架,孔隙率相差不大。电镜下观察,两种交联剂处理均较好地保持了支架的特性,支架立体感强,纤维排布均匀,水溶性交联剂处理的支架表面的孔隙比戊二醛处理之后的支架孔隙大,具体数据还有待进一步测定。
具有多向分化潜能的间充质干细胞是具有前途的软骨组织工程种子细胞[12-13]。采用家兔的MSCs 进行细胞贴附实验,为后续的软骨损伤动物模型的在体实验做准备。MSCs 在水溶性交联剂处理的支架上贴附良好,细胞平铺在支架表面,有微绒毛和分泌现象,表明细胞状态较好,具有正常功能。戊二醛处理之后的支架材料,尽管结构亦较为满意,但细胞贴附情况不佳,仅有少量细胞贴附在材料表面,可能与戊二醛残留对细胞的不利影响有关。
理想的软骨组织工程支架应具有以下条件:首先,应具有良好的生物相容性,无毒、无致畸;第二,表面活性有利于细胞的贴附,并为细胞在其表面生长、增殖和分泌基质提供良好的微环境;第三,具有一定的可塑性,便于加工成所需的形状,并有一定的机械强度,植入体内一定时间内仍可保持其形状;第四,基质材料应具有多孔性和高孔隙率,内表面积大,既有利于细胞的贴附和长入,又有利于营养成分的渗入和代谢产物的排出。后续实验中,拟将支架或者支架-细胞复合体植入关节软骨损伤动物的膝关节,将整个膝关节取下,与正常关节的抗压缩、抗拉伸以及弹性模量等生物力学特性进行比较,分析材料植入之后对关节软骨损伤的修复情况。在体动物试验中,将检测不同时间段软骨损伤修复情况,分析支架的植入是否有利于软骨损伤的修复以及修复后膝关节功能(包括生物力学特性),以判断采用水溶性交联剂制备的软骨修复支架能否良好地修复软骨缺损,能否成为 ACI 技术中一种理想的支架。
[1] Bedi A, Feeley BT, Williams RJ 3rd.Management of articular cartilage defects of the knee.J Bone Joint Surg Am, 2010,92(4):994-1009.
[2] Falah M, Nierenberg G, Soudry M, et al.Treatment of articular cartilage lesions of the knee.Int Orthop, 2010, 34(5):621-630.
[3] Onyekwelu I, Goldring MB, Hidaka C.Chondrogenesis, joint formation, and articular cartilage regeneration.J Cell Biochem, 2009,107(3):383-392.
[4] van Osch GJ, Brittberg M, Dennis JE, et al.Cartilage repair: past and future--lessons for regenerative medicine.J Cell Mol Med, 2009,13(5):792-810.
[5] Kon E, Filardo G, Di Martino A, et al.ACI and MACI.J Knee Surg,2012, 25(1):17-22.
[6] Peterson L, Vasiliadis HS, Brittberg M, et al.Autologous chondrocyte implantation: a long-term follow-up.Am J Sports Med, 2010,38(6):1117-1124.
[7] Brittberg M, Peterson L, Sjogren-Jansson E, et al.Articular cartilage engineering with autologous chondrocyte transplantation.A review of recent developments.J Bone Joint Surg Am, 2003, 85-A Suppl 3:109-115.
[8] Bi L, Cao Z, Hu Y, et al.Effects of different cross-linking conditions on the properties of genipin-cross-linked chitosan/collagen scaffolds for cartilage tissue engineering.J Mater Sci Mater Med, 2011,22(1):51-62.
[9] Vickers SM, Gotterbarm T, Spector M.Cross-linking affects cellular condensation and chondrogenesis in type II collagen-GAG scaffolds seeded with bone marrow-derived mesenchymal stem cells.J Orthop Res, 2010, 28(9):1184-1192.
[10] Glowacki J, Mizuno S.Collagen scaffolds for tissue engineering.Biopolymers, 2008, 89(5):338-344.
[11] Fosnot J, Kovach SJ 3rd, Serletti JM.Acellular dermal matrix: general principles for the plastic surgeon.Aesthet Surg J, 2011, 31(7 Suppl):5S-12S.
[12] Seo S, Na K.Mesenchymal stem cell-based tissue engineering for chondrogenesis.J Biomed Biotechnol, 2011, 2011:806891.
[13] Vinatier C, Bouffi C, Merceron C, et al.Cartilage tissue engineering:towards a biomaterial-assistedmesenchymal stem cell therapy.Curr Stem Cell Res Ther, 2009, 4(4):318-329.

