提高可利霉素药代动力学研究中微生物法检测灵敏度的研究
戴剑漉,赵小峰,赫卫清,贾晓宇,李慧宁,王以光
可利霉素又称必特螺旋霉素(BT),是利用基因工程技术将 4''-异戊酰基转移酶基因(4''-isovaleryltransferase gene,ist)在螺旋霉素宿主菌中异源表达后的发酵产物[1-2],其主组分为 4''-异戊酰螺旋霉素,此外,还含有少量 4''-酰基化的螺旋霉素,因此,BT 是一个多组分抗生素。BT 中的多种组分均具有抗菌活性,同时其在体内的代谢产物也具有抗菌活性。因此,采用微生物法进行其药代动力学研究,可以比较全面地评价其在体内的生物活性。然而由于微生物法受检定菌敏感度的限制,往往其检测灵敏度不理想[3],且 BT 在体内组织渗透性强,导致其血浆浓度偏低,组织浓度高[4]。因此,建立较灵敏的微生物检测方法对于以体内活性为目标的 BT 药代动力学研究至关重要。BT 药品的含量测定方法系采用管碟法,参考《中国药典》[5]乙酰螺旋霉素微生物检定法,已经建立了 BT微生物检定法。但抗生素微生物检定法影响因素较多[6],且血浆直接测定微生物方法的灵敏度受限。本文拟通过研究检定菌液浓度、培养基、缓冲液、血浆以及血浆处理等对 BT 检测的影响,提高微生物法测定 BT 的灵敏度,以满足该药药代动力学研究的需要。
1 材料与方法
1.1 材料
1.1.1 试验材料 鱼胨、牛肉浸膏、牛肉蛋白胨、胰蛋白胨、酵母提取物为生化试剂;葡萄糖、氯化钠、磷酸二氢钾、磷酸氢二钾、无水碳酸钠、乙酸乙酯和异丙醇为分析纯;乙腈为色谱纯;特级胎牛血清由北京元亨圣马生物技术研究所提供;藤黄八叠球菌[CMCC(B) 28001]由中国食品药品检定研究院提供;可利霉素标准品(批号 167201207001)效价 926 μg/mg,由沈阳同联集团有限公司提供;健康人空白血浆由北京大学第一医院血库提供;健康人血浆取自经过伦理委员会审核批准的进行药代动力学试验的 2 名健康受试者。
1.1.2 培养基
1.1.2.1 LB 培养基(g/L) 胰蛋白胨 10.0,酵母提取物 5.0,NaCl 10.0,pH 7.0。
1.1.2.2 抗生素检定培养基(g/L) ①鱼胨 6.0,葡萄糖 1.0,牛肉浸膏 1.5,酵母提取物 6.0;②牛肉蛋白胨 10.0,牛肉浸膏 5.0;③牛肉蛋白胨 5.0,牛肉浸膏 2.5;④牛肉蛋白胨 2.5,牛肉浸膏 1.25。上述培养基均含琼脂 1.2%,并用 1 mol/L NaOH溶液调节 pH 至 7.8~8.0 或 8.8~9.0,121 ℃ 灭菌 30 min。
1.1.3 仪器 PB303-N 型电子天平购自梅特勒-托利多仪器(上海)有限公司;LD5-10B 型离心机购自北京京立离心机有限公司;ZSD-A1270A 型电热恒温培养箱购自上海智城分析仪器有限公司;Vortex-genie 2 型旋涡混合器购自美国 Scientific Industries 公司;UV-1800 型双光束紫外可见分光光度仪购自日本岛津公司;电子数显卡尺,精度为0.01 mm。
1.2 方法
1.2.1 试剂配制
⑴磷酸盐缓冲液的制备:称取磷酸二氢钾0.41 g,磷酸氢二钾 5.59 g,溶于 1000 ml 蒸馏水中,过滤,115 ℃ 灭菌 30 min 即得 pH 7.8 的磷酸盐缓冲液 I。在上述缓冲液配制过程中分别加入氯化钠 10、20、30、35 g,得含氯化钠浓度为 1.0%、2.0%、3.0%、3.5% 的 pH 7.8 磷酸盐缓冲液 II、III、IV、V。
⑵0.05 mol/L 碳酸钠溶液的制备:称取 0.53 g无水碳酸钠于 100 ml 容量瓶中,加灭菌蒸馏水定容至刻度备用。
⑶标准贮备液的制备:精密称取 BT 标准品 10 mg,加 5 ml 乙醇溶解,并用灭菌水定容至100 ml,制成浓度为 1000 μg/ml 的标准贮备液,置4 ℃ 冷藏备用。
1.2.2 检定平板的制备
⑴双层:取融化的检定培养基 15 ml 加入直径为 90 mm 的双碟中,凝固后作底层,再加 5 ml 菌层,摇匀,冷却备用。
⑵单层:将融化的检定培养基冷却至 48 ~50 ℃,加入适量检定菌,混匀后取 12 ml 加入直径为 90 mm 的双碟中,凝固后备用。
1.2.3 血浆样品处理 按文献[7] LC-MS/MS 法测定血浆样本中 BT 的萃取方法,精密吸取 1.0 ml血浆样品置 50 ml 干净离心管中,加入 2 ml 水和500 μl 乙腈,混匀,加入碱化试剂(0.05 mol/L 碳酸钠溶液)2 ml,乙酸乙酯-异丙醇(95∶5,V/V)提取溶剂 20 ml,涡流 1 min,振荡 10 min 混匀,以3000 r/min,离心 10 min,分离上层有机相,于 25 ℃空气流下吹干,干燥物溶于 100 μl 乙酸乙酯。
1.2.4 加样法
⑴管碟法:牛津杯在培养基上静置 5 min,使其在培养基内沉降稳定。用微量移液器分别于牛津杯内定量滴加标准溶液 270 μl。用陶瓦圆盖覆盖双碟,置托盘内,以水平位置移入培养箱,37 ℃ 培养 16~18 h,电子数显卡尺量取抑菌圈直径。
⑵纸片法:用打孔器将厚型滤纸制成直径为10 mm 的纸片,经紫外线照射 20~30 min,存干燥处备用。用微量移液器分别吸取提取后的标准品及待测样品 100 μl 加入上述纸片中,于 37 ℃ 干燥 30 min 后将干燥纸片移至单层检定平板,使纸片与培养基贴平,置 37 ℃ 培养 16~18 h,量取抑菌圈直径。
1.2.5 纸片法标准曲线的制作 取 1.0 ml 空白人血浆分别配制 BT 浓度为 20、50、100、125、150、175 ng/ml 的系列标准溶液,按 1.2.3 血浆样品处理项下方法处理样品,滴加至 1.2.4 项所述纸片,置于单层检定平板中[检定培养基③,藤黄八叠球菌液 OD600= 1.0,加入量 0.5%],置 37 ℃培养 16~18 h,量取抑菌圈直径,并以血浆中 BT标准品药物浓度的对数为横坐标,抑菌圈直径为纵坐标,绘制标准曲线。
2 结果
2.1 BT 初始检测灵敏度的确定
按药典方法采用培养基①制备双层检定平板,用 pH 7.8 的磷酸盐缓冲液 I 将 BT 标准品稀释为系列浓度,藤黄八叠球菌为检定菌,37 ℃过夜培养,菌液以 0.5%(V/V)加入培养基,结果表明本实验条件下可检测 BT 浓度为 0.6 μg/ml(表 1)。
2.2 培养基 pH 对 BT 检测灵敏度的影响
采用培养基①、②制备双层检定平板,pH 均调节至 7.8~8.0 或 8.8~9.0,管碟法加样。结果表明两种培养基在 pH 8.8~9.0 时,灵敏度均较pH 7.8~8.0 敏感,其中培养基②更为敏感(表 2)。

表1 BT 初始检测灵敏度的确定(n = 6)Table1 Preliminary sensitivity of BT (n = 6)

表2 培养基 pH 对 BT 检测灵敏度的影响(n = 6)Table2 Effect of medium pH on sensitivity of BT (n = 6)
2.3 检定菌液浓度对 BT 检测灵敏度的影响
将上述培养的藤黄八叠球菌原始菌液适当稀释(OD600= 0.3~1.0),与原始菌液进行比较,培养基②双层管碟法,检测 BT 系列稀释液的抑菌情况。结果表明检定菌浓度的降低可以提高 BT 检测的灵敏度,其检测限值达到 0.4 μg/ml(表 3)。
2.4 检定平板单双层对 BT 检测灵敏度的影响
采用培养基②制备单层和双层检定平板,管碟法加样,菌液浓度为 OD600= 0.3~1.0。检测 BT 系列稀释液的抑菌情况。结果表明单层平板可以有效提高 BT 检测的灵敏度,其检测限值为 0.2 μg/ml(表 4)。
2.5 检定培养基对 BT 检测灵敏度的影响
采用培养基②、③、④制备单层检定平板,管碟法加样,菌液浓度为 OD600= 0.3~1.0。研究不同培养基配方检测 BT 系列稀释液的抑菌情况。结果见表 5,表明培养基③、④检测限值均为0.14 μg/ml,但检定菌在培养基④生长极弱,抑菌圈边缘模糊,而在培养基③生长适中,抑菌圈边缘清晰,因此确定培养基③为下一步实验用检定培养基。
2.6 NaC1 浓度对 BT 检测灵敏度的影响
根据缓冲液中盐浓度提高可加快抗生素分子扩散的原理[8],在稀释 BT 使用的 pH 7.8 磷酸盐缓冲液中加入浓度为 1.0%、2.0%、3.0% 和 3.5%的 NaCl,菌液浓度为 OD600= 0.3~1.0,检测不同浓度 NaCl 对检测 BT 灵敏度的影响,结果表明使用含 3.0% NaCl 的 pH 7.8 磷酸盐缓冲液可以提高BT 检测灵敏度,其检测限值为 0.1 μg/ml(表 6)。
2.7 胎牛血清和人血浆中检测 BT 的灵敏度
分别将磷酸盐缓冲液和 NaCl 溶液与胎牛血清混合,或直接用胎牛血清和人血浆稀释 BT,比较不同条件对检测 BT 灵敏度的影响,结果表明以胎牛血清作为稀释液,BT 检测限达到 0.1 μg/ml;以人血浆作为稀释液,BT 检测限达到 0.2 μg/ml(表 7)。

表3 检定菌液浓度对 BT 检测灵敏度的影响(n = 6)Table3 Effect of concentration of test bacterium suspension on sensitivity of BT (n = 6)

表4 检定平板单双层对 BT 检测灵敏度的影响(n = 6)Table4 Effect of single or double layer assay plates on sensitivity of BT (n = 6)
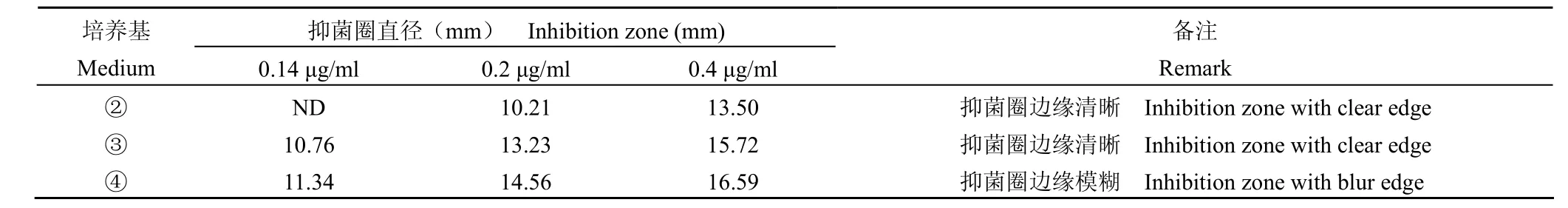
表5 检定培养基对 BT 检测灵敏度的影响(n = 6)Table 5 Effect of test medium on sensitivity of BT (n = 6)
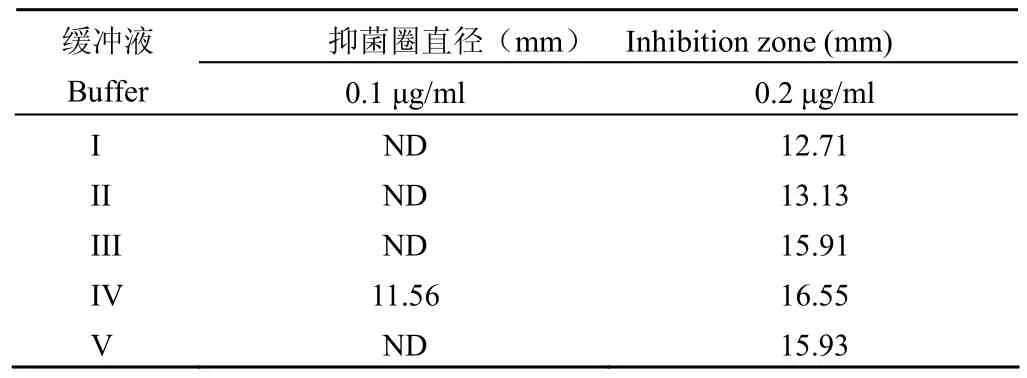
表6 NaCl 对 BT 检测灵敏度的影响*(n = 6)Table6 Effect of NaCl on sensitivity of BT (n = 6)

表7 胎牛血清和人血浆中检测 BT 的灵敏度*(n = 6)Table7 Sensitivity of BT in fetal bovine serum (FBS)and plasma (n = 6)
2.8 纸片法检测人血浆中 BT 的浓度
2.8.1 标准曲线的制作 上述实验表明,人血浆中的成分对 BT 在检定平板的扩散有一定影响,为了进一步提高在人血浆中检测 BT 的灵敏度,必须排除人血浆中内源性物质对 BT 检测的干扰。参照文献[5]从血浆中萃取 BT,制作测定 BT 浓度的标准曲线。标准曲线方程为 Y = 11.468X–2.519,r2= 0.9981(n = 6)(图 1),BT 的最低检测浓度为0.02 μg/ml。
2.8.2 纸片法在健康受试者血样中检测 BT 的应用 2 名健康受试者单次服用 BT 400 mg 后,于2.0、3.0、4.0 h 采集血样,离心分离出的血浆样品萃取后进行稀释,以纸片法进行检测,结果见表 8,由于所用设备及条件所限,实验数据误差较大,但初步结果显示所建立方法可应用于血浆样品中 BT的检测。
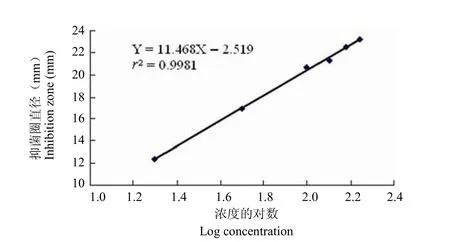
图1 纸片法测定人血浆中 BT 浓度的标准曲线Figure1 Standard curve of BT concentration in plasma using paper disk method

表8 纸片法检测人血浆中 BT 浓度(n = 3)Table8 Concentration of BT in plasma using paper disk method (n = 3)
3 讨论
根据国家食品药品监督管理局《化学药物临床药代动力学研究技术指导原则》(2005年3月版)的要求,血药浓度的微生物法测定在 BT 新药申报中至关重要。然而,由于 BT 药代学的特点以及受检定菌敏感度的限制,按照已建立的 BT 微生物法测定其效价的方法不能满足药动学研究的要求。
本实验通过考察检定培养基配方、检定菌浓度、检定平板、稀释缓冲液中添加 NaCl 和胎牛血清对 BT 检测的影响,发现采用营养较为贫乏的配方、控制检定菌的浓度、采用单层培养平板和在稀释缓冲液中添加 NaCl 等措施,可以有效地提高BT 微生物法检测的灵敏度。使用培养基③配方,菌液浓度控制在 OD600为 0.3~1.0 制作单层检定平板,用管碟法检测 BT 的检测限由 0.6 μg/ml降低至 0.1 μg/ml 左右,灵敏度提高了 6 倍。本研究建立的从血浆中萃取 BT 的纸片检测方法,使BT 在血浆中的检测限下降至 0.02 μg/ml。本实验研究结果为顺利完成 BT 在人体药代动力学中血药浓度微生物法的检测奠定了良好基础,同时也为其他抗菌药物药动学研究中血药浓度的微生物法测定提供了参考。
[1] Guangdong S, Jianlu D, Yiguang W.Construction and physiological studies on a stable bioengineered strain of shengjimycin.J Antibiot(Tokyo), 2001, 54(1):66-73.
[2] Wang YG, Jin LF, Jin WZ, et al.Cloning of midecamycin 4″-acyltransferase and its expression in spiramycin producing strains.Chin J Biotechnol, 1992, 8(1):1-14.(in Chinese)王以光, 金莲舫, 金文藻, 等.麦迪霉素 4″酰化酶基因的克隆及在螺旋霉产生菌中的表达.生物工程学报, 1992, 8(1):1-14.
[3] Bao HD, Zheng Q, Wang R, et al.Factors influencing the sensitivity of microbiological determination of antinicrobial residues.Jiangsu J Agric Sci, 2008, 24(5):720-724.(in Chinese)包红朵, 郑勤, 王冉, 等.微生物法测定抗菌素残留灵敏度的影响因素概述.江苏农业学报, 2008, 24(5):720-724.
[4] Shi XG, Sun YM, Zhang YF, et al.Tissue distribution of bitespiramycin and spiramycin in rats.Acta Pharmacol Sin, 2004,25(11):1396-1401.
[5] Chinese Pharmacopoeia Commission.Pharmacopoeia of the People's Republic of China.Volume 2, 2005.Beijing: Chemical Industry Press,2005: appendix XI A.(in Chinese)国家药典委员会.中华人民共和国药典, 2005年版二部.北京: 化学工业出版社, 2005:附录XI A.
[6] Yang YL, Hu CQ.The additional and revised description of the Chinese Pharmacopoeia 2005 on the microbiological assay of antibiotics and the explanatory notes of procedures.Chin J Antibiotics,2005, 30(12):721-726.(in Chinese)杨亚莉, 胡昌勤.中国药典 2005年版微生物检定法的增修订情况及要点.中国抗生素杂志, 2005, 30(12):721-726.
[7] Shi XG.Study on metabolism and pharmacokinetics of bitespiramycin in vivo.Shenyang: Shenyang Pharmaceutical University, 2003.(in Chinese)史向国.必特螺旋霉素体内代谢与药物动力学研究.沈阳: 沈阳药科大学, 2003.
[8] Zhang ZY.Drug test of antibiotics.Beijing: People’s Publishing House, 1991:15.(in Chinese)张治锬.抗生素药品检验.北京: 人民卫生出版社, 1991:15.

