E2F1基因敲除小鼠骨髓造血干、祖细胞减少
石桂英,葛文平,张连峰,白 琳
(中国医学科学院北京协和医学院实验动物研究所,卫生部人类疾病比较医学重点实验室,国家中医药管理局人类疾病动物模型三级实验室,北京 100021)
细胞内重要的转录因子E2F1是E2F家族中第一个被克隆出来的蛋白,对细胞的增殖、分化和凋亡都发挥着关键性的作用。E2F1参与了细胞周期从G1期到S期的转换:在细胞周期G1期前,Rb与E2F1结合限制了其活性,当细胞周期蛋白激酶CDK结合蛋白Rb后,磷酸化的Rb释放E2F1/DP-1复合物,这样E2F1/DP-1就结合到基因组上,发挥转录调控功能激活下游基因,进而使细胞周期从G1期转换到 S 期[1,2]。同时,E2F1 还发挥促凋亡功能,通过p53依赖型以及p53非依赖型两种细胞信号通路,进而激活下游促凋亡蛋白如:Bcl-2、homology3(BH3)-only proteins PUMA、Noxa、Bim、Hrk/DP5、Bik 以及 caspase-3、-9 等[3-6];此外,E2F1还抑制细胞存活信号通路分子如:NF-κB、Mcl-1等[7,8]。通过E2F1这两方面的作用,最终带来细胞的凋亡。
已有研究发现,E2F1基因敲除小鼠胸腺增大,进一步研究发现,其机制是E2F1基因敲除后抑制成熟胸腺细胞的凋亡,从而使胸腺细胞数增多,体积增大[9]。那么,E2F1基因敲除对骨髓造血干、祖细胞是否也有影响,目前未见相关研究。本研究应用流式细胞仪分析E2F1基因敲除小鼠的外周血、脾脏、骨髓等组织细胞,了解E2F1基因敲除对上述组织细胞及造血干、祖细胞的作用。
1 材料和方法
1.1 动物与设备
E2F1基因敲除小鼠来自北京协和医学院比较医学中心,遗传背景为129,对照小鼠为同窝野生型小鼠,动物生产及使用许可证号:【SCXK(京)2009-0007;SYXK(京)2011-0022】。主要实验设备为美国BD公司Aria流式细胞仪。
1.2 PCR方法鉴定E2F1基因敲除小鼠基因型
用10日龄小鼠尾尖提取基因组 DNA,普通PCR鉴定基因型。反应条件:94℃预变性3 min;94℃ 30 s,55℃ 30 s,72℃ 30 s,35 个循环;72℃延伸10 min。基因敲除小鼠的 PCR鉴定引物:oIMR0580:5'-GGATATGATTCTTGGACTTCTTGG-3',oIMR0581:5'-CTAAATCTGACCACCAAACGC-3',oIMR1997:5'-CAAGTG CCAGCGGGGCTGCTA AAG-3',PCR产物长度,野生型为172 bp,E2F1敲除为227 bp,杂合子同时有上述两条片段。引物由上海英骏生物工程技术有限公司合成,PCR试剂购自宝生物工程有限公司。
1.3 流式分析
小鼠脱颈椎处死后,取脾脏、后肢骨,置于冰上预冷的染色缓冲液(含1%BSA的PBS)中。脾脏用磨砂玻片研磨成细胞悬液;后肢骨用5 mL注射器将骨髓细胞冲出,并吹打成细胞悬液。将细胞悬液用50 μm尼龙滤膜过滤后收集到15 mL离心管中,用PBS定容至10 mL,混匀后,取10 μL细胞悬液,稀释10倍后计数细胞数。细胞悬液离心,1 000 r/min,10 min,将细胞浓度调整为1×108个细胞/mL。分别取106细胞标记荧光抗体(BD公司)。
骨髓造血干细胞的分析中用如下抗体进行标记:CD34-FITC、Flt3-PE、CD16/32-Percp-cy5.5、Sca1-PE-Cy7、cKit-APC、Ter-119-biotin、Gr-1-biotin、Mac-1-biotin、B220-biotin、IL-7R-biotin、CD4-biotin、CD8-biotin、biotin-APC-Cy7。骨髓造血干细胞(HSC)表面标记为:lin-c-kit+sca1+,长期造血干细胞(LT-HSC)表面标记为:Lin-c-Kit+Sca1+CD34-Flt3-,短期造血干细胞(ST-HSC)表面标记为:Linc-Kit+Sca1+CD34+Flt3-,髓系祖细胞(MP)表面标记为:Lin-c-Kit+Sca1-,共同髓系祖细胞(CMP)表面标记为:Lin-c-Kit+Sca1-CD34-CD16/32low,粒单系祖细胞(GMP)表面标记为:Lin-c-Kit+Sca1-CD34+CD16/32high,巨核单系祖细胞(MEP)表面标记为:Lin-c-Kit+Sca1-CD34+CD16/32low。IgDFITC、CD43-PE、B220-PE-Cy7、IgM-APC,标记不同发育阶段的B淋巴细胞。脾脏及外周血细胞标记抗体:CD4-FITC、 CD8-Percp-cy5.5、 B220-PE-Cy7、CD11B-APC-Cy7。上述抗体加入细胞悬液,冰上避光,30 min;加1 mL 染色缓冲液,离心,2600 r/min,5 min,弃上清液,加200 μL染色缓冲液重悬细胞,用50 μm尼龙滤膜过滤,冰上避光备用。
1.4 统计学方法
数据分析采用SPSS 13.0软件包进行统计分析,各组数据均采用ˉ±s表示。组间资料分析采用t检验。以P<0.05表示差异有统计学意义。
2 结果
2.1 PCR鉴定结果
剪取10日龄小鼠脚趾,采用饱和氯化钠法提取小鼠基因组DNA,进行PCR,产物经2%琼脂糖凝胶电泳,野生型产物长度为172 bp,E2F1缺失产物长度227 bp。基因型鉴定结果见图1。
2.2 E2F1基因敲除小鼠骨髓B细胞减少
已有研究发现,与野生型小鼠相比,E2F1基因敲除小鼠的胸腺明显增大,胸腺细胞总数显著增多[9],而对外周血、脾及骨髓等未见相关研究。本研究中亦发现E2F1基因敲除小鼠胸腺明显增大(图2A)。我们对E2F1基因敲除小鼠及同窝野生对照小鼠的外周血、脾、骨髓中 B220+、CD4+、CD8+、CD11b+细胞进行流式分析。结果发现,与野生型小鼠相比,E2F1基因敲除小鼠外周血中CD4+细胞显著增多,而CD11b+细胞显著减少,骨髓中B220+细胞显著减少,CD8+细胞显著增多,脾脏中各种细胞的比例无明显差异(图2B、C,脾脏细胞分析图未显示)。可见,E2F1基因敲除对造血系统各种细胞均有重要影响。

图1 E2F1基因敲除小鼠鉴定结果Fig.1 Genotyping of the E2F1 knockout mice
2.3 E2F1基因敲除小鼠髓系祖细胞及前体B细胞减少
CD11b+细胞由髓系祖细胞发育而来,我们分析了髓系祖细胞及各单系祖细胞的变化。结果显示,E2F1基因敲除后,髓系祖细胞及各单系祖细胞数量均显著减少(图3A)。对B细胞发育的流式分析结果发现,前体B细胞及未成熟B细胞均显著减少,而成熟B细胞的比例显著增加(图3B)。这说明E2F1基因对髓系及B细胞发育有重要作用。
2.4 E2F1基因敲除小鼠骨髓造血干细胞减少

图2 E2F1基因敲除影响外周血及骨髓细胞Fig.2 E2F1 gene knockout influences the cells in the peripheral blood and bone marrow

图3 E2F1基因敲除影响髓系祖细胞及前体B细胞发育Fig.3 E2F1 knockout influences the development of myeloid progenitor and pre B cells
为了了解E2F1基因对骨髓造血干细胞的影响,我们分析了骨髓造血干细胞及长期、短期造血干细胞数及细胞周期的变化。研究发现,E2F1基因敲除后,骨髓造血干细胞、长期造血干细胞及短期造血干细胞的数量显著减少,而且处于静止期的造血干细胞比例明显降低(图4)。由此可见,E2F1基因对骨髓造血干细胞发育、分化有重要作用。
3 讨论
已有研究表明,E2F1基因缺失可以抑制小鼠胸腺细胞凋亡,从而使成熟T细胞增多、胸腺增生[9],而关于E2F1基因缺失对造血干细胞的影响,未见相关研究。
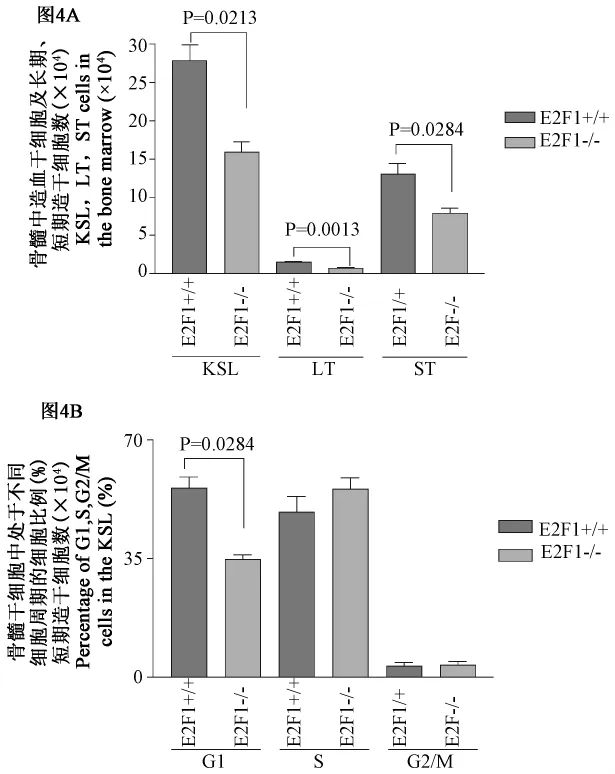
图4 E2F1敲除影响骨髓造血干细胞数量及细胞周期Fig.4 E2F1 knockout influences the number of HSC and cell cycle
本研究应用E2F1基因敲除小鼠及同窝野生对照小鼠,应用流式细胞仪分析E2F1基因缺失对造血系统的影响。研究发现,E2F1基因缺失小鼠,外周血CD4+细胞比例增多,CD11b+细胞比例降低,骨髓中CD8+细胞比例增多,B220+细胞比例降低,可见E2F1基因缺失对造血系统中T、B淋巴细胞及髓系细胞均有重要影响(图2)。因此,本研究进一步分析了骨髓中前体B淋巴细胞的发育,结果发现,前体B淋巴细胞及未成熟B淋巴细胞比例明显降低,而成熟B淋巴细胞比例显著增高,这说明E2F1基因在B淋巴细胞发育中有重要作用(图3B)。同时,对髓系祖细胞的分析发现,E2F1基因缺失小鼠,髓系祖细胞及各单系祖细胞数明显减少,可见E2F1基因对髓系细胞的发育有重要作用(图3A)。另外,本研究发现E2F1基因敲除小鼠中造血干细胞(LSK)及长期造血干细胞(LT-HSC)、短期造血干细胞(STLSK)的数量都明显减少,而且处于G1期的造血干细胞显著降低,由此可见,E2F1基因对造血干细胞的细胞周期调节起重要作用(图4)。
E2F1基因对造血干细胞影响的作用机制,还需进行增殖、凋亡及相关信号通路等实验;E2F1基因敲除对造血干细胞功能的影响,尚需通过克隆形成、竞争性骨髓移植等实验进一步研究。
[1] Trimarchi JM,Lees JA.Sibling rivalry in the E2F family[J].Nature Rev Mol Cell Biol,2002,3:11 -20.
[2] Li FX,Zhu JW,Hogan CJ,et al.Defective gene expression,S phase progression,and maturation during hematopoiesis in E2F1/E2F2 mutant mice[J].Mol Cell Biol,2003,23:3607 -3622.
[3] Gogada R,Yadav N,Liu J,et al.Bim,a proapoptotic protein,up-regulated via transcription factor E2F1dependent mechanism,functions as a prosurvival molecule in cancer[J].J Biol Chem,2013,288:368-381.
[4] Ray RM,Bhattacharya S,Johnson LR.Mdm2 inhibition induces apoptosis in p53 deficient human colon cancer cells by activating p73 and E2F1mediated expression of PUMA and Siva-1 [J].Apoptosis,2011,16:35 -44.
[5] Ambrosini G,Sambol EB,Carvajal D,et al.Mouse double minute antagonistNutlin-3a enhanceschemotherapy-induced apoptosis in cancer cells with mutant p53 by activating E2F1[J].Oncogene,2007,26:3473 -3481.
[6] Espada L,Meo-Evoli N,Sancho P,et al.ROS production is essential for the apoptotic function of E2F1 in pheochromocytoma and neuroblastoma cell lines[J].PloS One,2012,7:e51544.
[7] Tanaka H,Matsumura I,Ezoe S,et al.E2F1 and c-Myc potentiate apoptosis through inhibition of NF-kappaB activity that facilitates MnSOD-mediated ROS elimination [J].Molec Cell,2002,9:1017-1029.
[8] Palomer X,Alvarez-Guardia D,Davidson MM,et al.The interplay between NF-kappaB and E2F1 coordinately regulates inflammation and metabolism in human cardiac cells[J].PloS One,2011,6:e19724.
[9] Field SJ,Tsai FY,Kuo F,et al.E2F-1 functions in mice to promote apoptosis and suppress proliferation [J].Cell,1996,85:549-561.

