不同剂量阿霉素致大鼠局灶节段硬化肾病模型的建立比较
马晓红,何立群
(1.上海中医药大学附属曙光医院,上海 200021;2.上海市中医临床重点实验室,上海 200021)
阿霉素(adriamycin,ADR)注射加单侧肾切除为大鼠慢性肾脏病的经典模型,文献报道显示ADR的注射剂量、注射途径各有不同[1-9],部分剂量不能诱导出肾脏局灶节段硬化(focal segmental glomerular sclerosis,FSGS)的病理改变,有些剂量模型虽然有
FSGS表现,但死亡率达15% ~56%[10],我们为摸索一个既有FSGS表现,死亡率又低的ADR尾静脉注射剂量,对不同剂量ADR致大鼠FSGS肾病模型的建立进行了研究。
1 材料和方法
1.1 材料
1.1.1 动物 SPF级8周龄雄性SD大鼠,144只,体重(200±20)g,由上海西普尔 -必凯实验有限公司提供,SCXK(沪)2008-0016。实验大鼠分笼饲养于上海中医药大学实验动物中心,SYXK(沪)2009-0069,温度 25°、12 h 光照、45% 湿度的环境中,自由饮水,进食标准普通饲料。
1.1.2 药物 注射用盐酸多柔比星,10 mg/支,深圳万乐药业有限公司生产,生产批号1012E2。
1.1.3 主要试剂 尿蛋白定量试剂盒、尿素氮试剂盒、肌酐试剂盒(南京建成生物工程研究所提供)。
1.1.4 主要仪器 M5型酶标仪(美国MD公司),GL-20G-II型高速冷冻离心机(上海安亭科学仪器厂)。MICROM HM 325轮转切片机(美国MD公司),Leica DMIL倒置相差显微镜(美国莱卡公司)。
1.2 方法
1.2.1 造模与分组:取144只SD大鼠随机分为3组,正常组(n=18),假手术组(n=18),模型组(n=18)。模型组行单侧肾切除,以2%戊巴比妥钠(40 mg/kg)腹腔注射麻醉,备皮,用碘酒、75%酒精消毒手术区后铺巾,距左脊肋骨1.5 cm处斜向外方切口,暴露肾脏,分离肾周脂肪后,切除左肾,结扎血管,逐层缝合,分别于术后第1周分成六个剂量组3 mg/kg、4 mg/kg、4.5 mg/kg、5 mg/kg、5.5 mg/kg、6 mg/kg,每个剂量组18只,行尾静脉注射 ADR,每次0.6 mL。假手术组仅作背部切口,剥离左肾包膜,保留肾上腺,逐层缝合,于术后第1周尾静脉注射等体积生理盐水,每次0.6 mL。模型组、假手术组于术后第5周再次尾静脉注射,重复前次剂量。
1.2.2 样本收集及标本制备
1.2.2.1 收集血清、肾脏标本 ADR第二次注射后1周、4周、8周用代谢笼收集大鼠24 h尿,记尿量及饮水量;ADR第二次注射后2周、4周、8周目内皉取血;ADR第二次注射后8周,2%戊巴比妥钠(40 mg/kg)腹腔注射麻醉,取出右侧肾脏,称重,去包膜,于10%甲醛固定备用组织病理切片。
1.2.2.2 标本制备 10%甲醛固定肾组织24 h后,脱水,包埋,切片备HE染色。
1.2.3 检测指标 检测模型大鼠生化指标:24 h尿蛋白定量、血清肌酐、血清尿素氮。HE染色观察肾组织病理。
1.2.4 统计学方法 数据均采用SPSS 16.0软件包进行统计学分析。计量资料以表示。多组间两两比较用单因素方差分析(以P<0.05为差异进行统计检验)。采用 pearson法分析大鼠24 h尿蛋白定量、肾功能、成活率与 ADR注射剂量的相关性。
2 结果
2.1 各ADR注射剂量组大鼠成活率及与ADR注射剂量的相关性
不同ADR注射剂量组大鼠4周、8周成活率随着注射剂量的升高呈逐渐下降趋势,4周、8周时4.5 mg/kg组、5 mg/kg组、5.5 mg/kg组、6 mg/kg组成活率低于50%(表1)。
8周时各注射剂量组大鼠成活率与注射剂量呈高度显著性负相关(图1,r=0.904 5,P <0.01)。
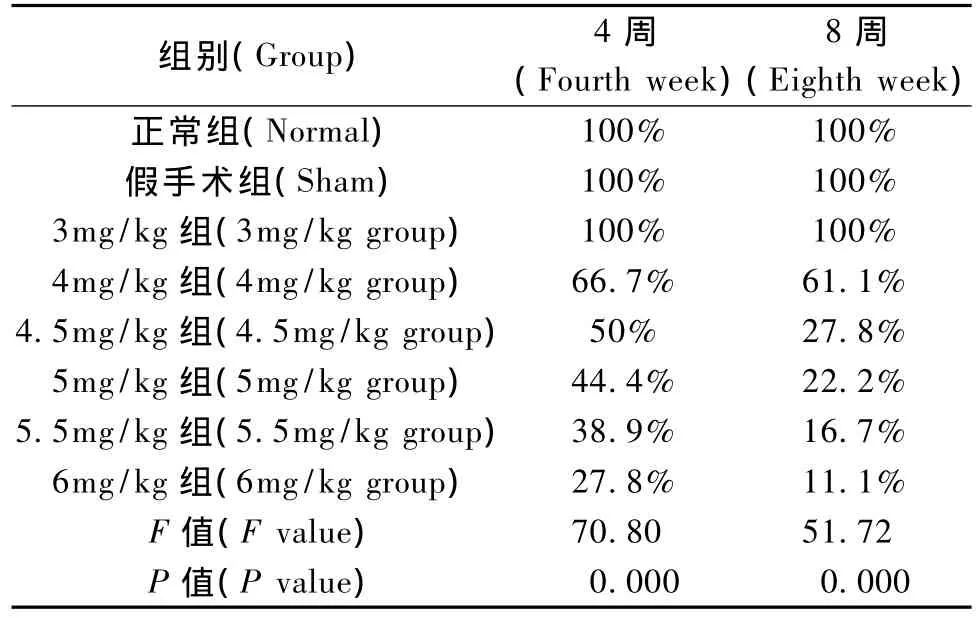
表1 各组各组大鼠成活率比较(单位:%)Tab.1 Comparison of the survival rate among eight groups(unit:%)

图1 8周大鼠成活率与ADR注射剂量的相关性曲线。Fig.1 The Relativity curve of the survival rate with ADR in eighth week.
2.2 各ADR注射剂量组大鼠24 h尿蛋白定量及与ADR注射剂量的相关性
ADR第二次注射后1周、4周、8周,各 ADR注射剂量组大鼠24 h尿蛋白定量与正常组相比均明显升高(P<0.01)(表2)。
8周时各注射剂量组大鼠24 h尿蛋白定量与ADR注射剂量呈高度显著性正相关(图 2,r=0.942 9,P <0.01)。
2.3 各ADR注射剂量组大鼠肾功能及与ADR注射剂量的相关性
ADR第二次注射后2周、4周、8周,各 ADR注射剂量组大鼠血清肌酐水平与正常组相比显著升高(P<0.01)(表3)。
血清尿素氮水平与正常组相比,各ADR注射剂量组大鼠在4周、8周时有明显升高(P<0.01);2周时4 mg/kg组较正常组升高(P<0.05),3 mg/kg组无统计学意义(P>0.05),其余各组明显升高(P<0.01)(表 4)。
8周时各注射剂量组大鼠血清Scr与ADR注射剂量呈高度显著性正相关(图3,r=0.938 4,P<0.01);血清BUN与ADR注射剂量呈高度显著性正相关(图 4,r=0.956 8,P <0.01)。
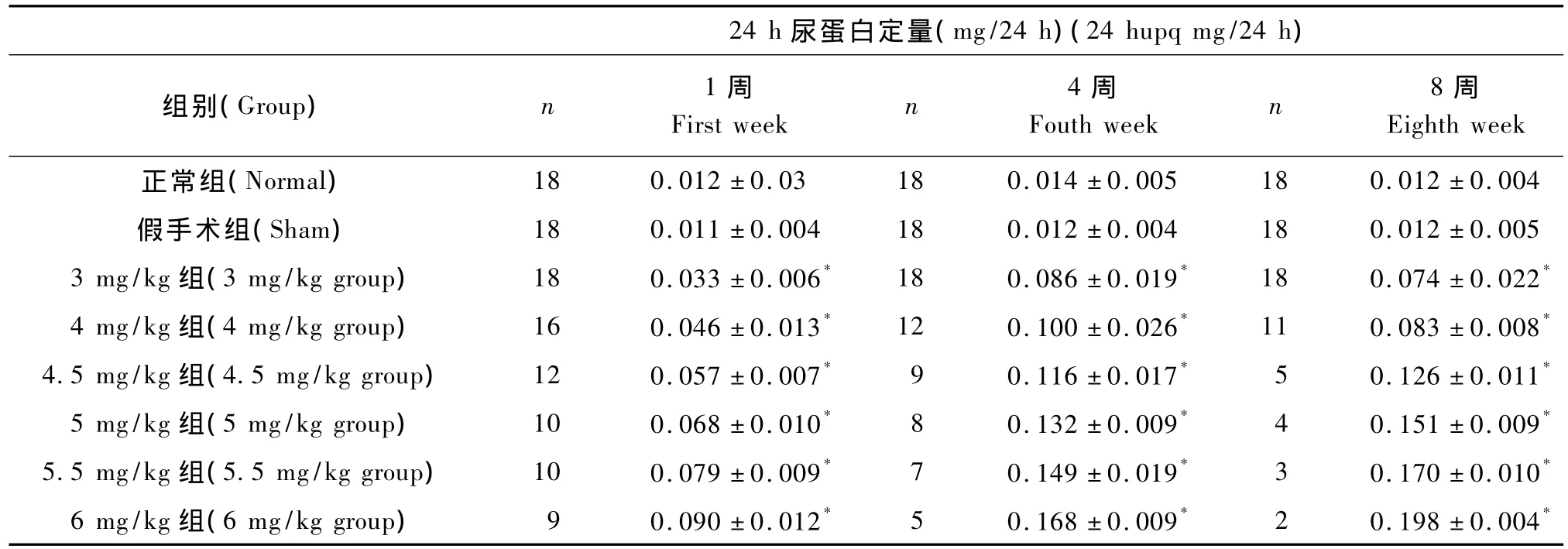
表2 各组24 h尿蛋白定量水平比较(单位:mg/24 h)Tab.2 Comparison of 24 h upq among eight groups(unit:mg/24 h)
2.4 各组大鼠肾脏外观变化(彩插2图5)
肉眼观察:正常组、假手术组肾脏大小正常,色泽红润,表面光滑,肾包膜完整。各 ADR注射剂量组大鼠残余肾呈肾代偿性肥大,色泽苍白,表面粗糙、布满颗粒状隆起,肾包膜不完整,和周围组织无明显粘连,残肾易分离,肾脏外观的改变随着 ADR注射剂量的加大呈加重趋势。
2.5 各组大鼠肾脏病理HE染色(200倍,400倍)(彩插3图6)
光镜(HE染色):正常组、假手术组肾小球未见明显异常,系膜细胞无增生,毛细血管襻开放,血管壁正常,间质无明显炎性细胞浸润;各模型组大鼠肾脏可见肾小球增生、肥大、萎缩,上皮细胞空泡变性,肾小球系膜区增宽、系膜细胞明显增生,肾小球出现局灶节段硬化,硬化区偶有泡沫细胞形成;肾小管轻中度浊肿、扩张,部分小管内可见蛋白管型和红细胞;肾间质纤维化,可见大量炎性细胞浸润。随着ADR注射剂量的增加,肾小球硬化程度有逐渐加重的趋势。
3 讨论
阿霉素(ADR)肾病大鼠模型报道于上世纪80年代[11],是目前公认的最接近人类肾小球疾病的模型。根据造模方法可分为急性肾病模型和慢性肾病模型,急性肾病模型类似于人类的微小病变型肾病(MCN),慢性肾病模型则类似于人类慢性肾小球肾炎和局灶节段性肾小球硬化(FSGS)。该模型为目前肾脏病研究领域应用较多的造模方法之一,其肾毒性的发病机制主要有两个方面:ADR是一种细胞周期非特异性的广谱化疗抗癌药物,具有强烈的细胞毒作用,可直接损伤肾脏细胞,干扰足细胞的蛋白合成,造成足细胞的改变;其次ADR中的醒式结构在肾脏内还原为半醒型自由基,与氧反应产生活性氧,诱发肾小球上皮细胞脂质过氧化反应,破坏滤过膜,产生蛋白尿。ADR的肾脏病理改变与ADR的产地、给药途径、动物品系有密切关系[12]。
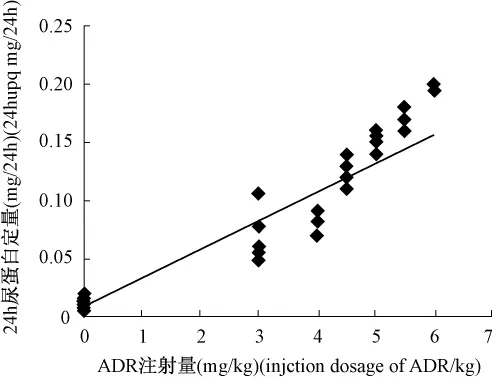
图2 8周大鼠24 h尿蛋白定量与ADR注射剂量的相关性曲线。Fig.2 The Relativity curve of 24 hupq with ADR in eighth week.
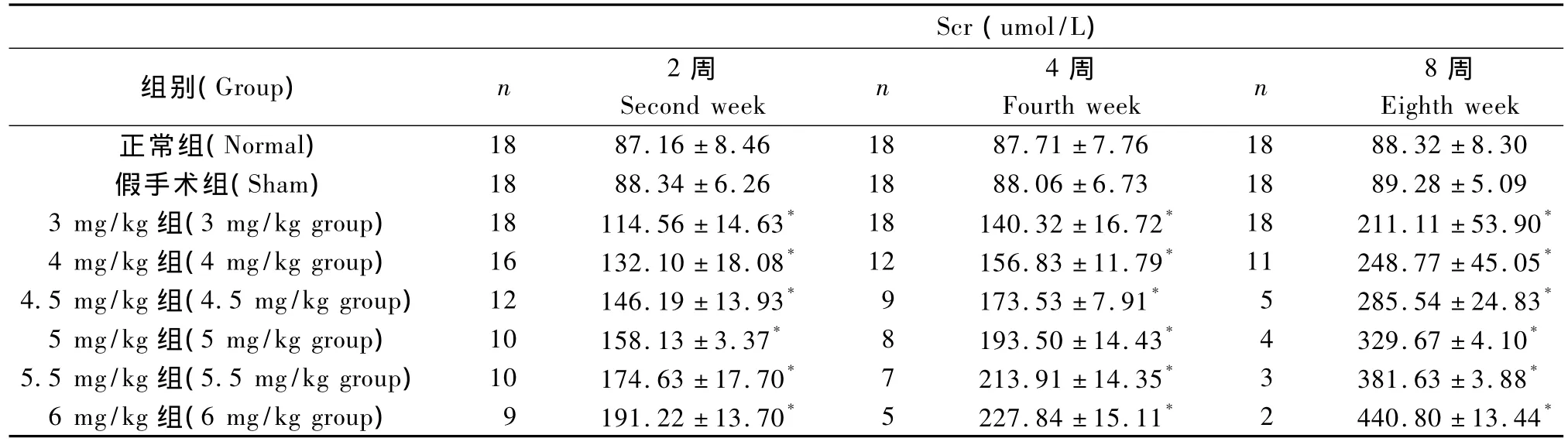
表3 各组血清肌酐水平比较(单位:umol/L)Tab.3 Comparison of serum creatinine among eight groups(unit:umol/L)
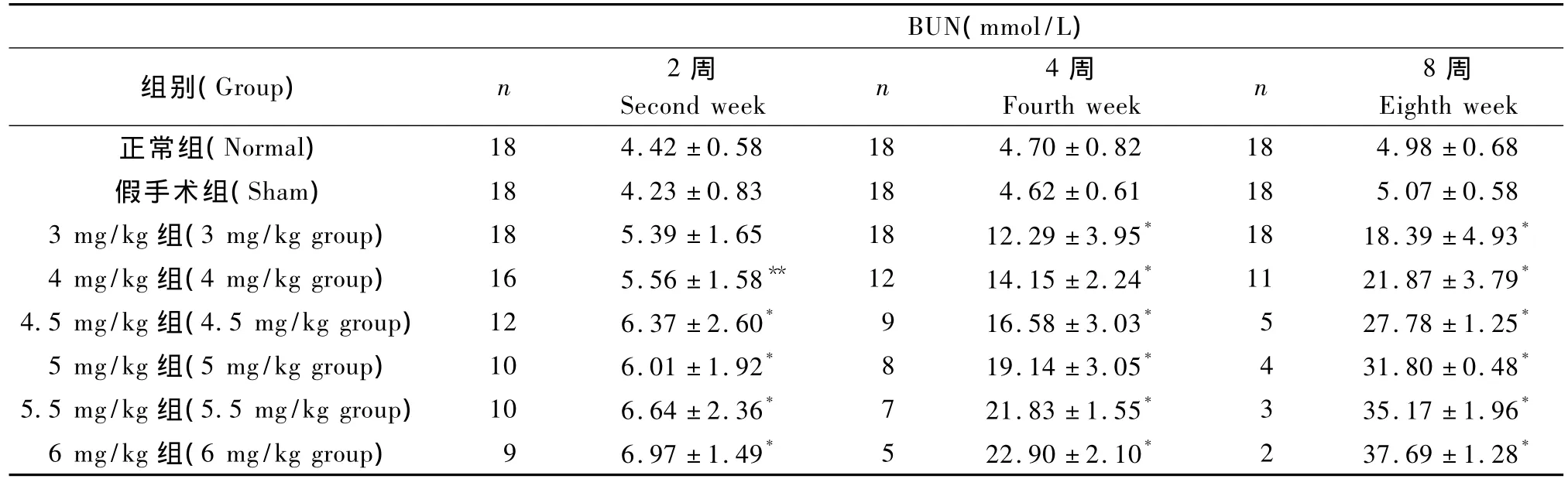
表4 各组血清尿素氮水平比较(单位:mmol/L)Tab.4 Comparison of serum urea nitrogen among eight groups(unit:mmol/L)
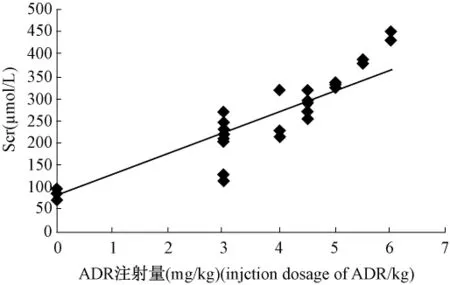
图3 8周大鼠血清肌酐与ADR注射剂量的相关性曲线。Fig.3 The Relativity curve of rat serum creatinine with ADR in eighth week.
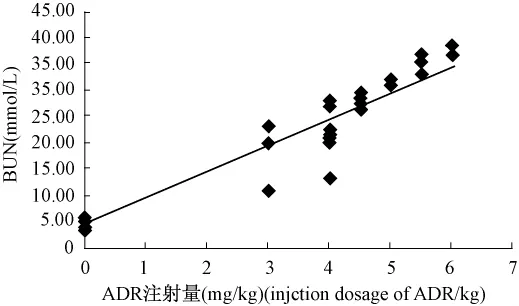
图4 8周大鼠血清尿素氮与ADR注射剂量的相关性曲线。Fig.4 The Relativity curve of rat serum urea nitrogen with ADR in eighth week.
由于ADR的心肌毒性和腹泻等副作用极易引起模型动物的死亡,尤其是 ADR的心脏毒性[13]是模型大鼠死亡的主要原因,从而影响了实验的效果。ADRN模型可模拟人类各种肾小球和肾小管疾病[14-16],所以我们采用不同注射剂量进行造模,评价不同剂量ADR的肾毒性、毒副作用,分析不同剂量ADR的造模效果,从而摸索出一个相对较优的注射剂量。
我们在实验中采取单侧肾切除加重复尾静脉注射的方法,分6个ADR注射剂量进行观察,提示尿蛋白、血肌酐分别于造模后1周、2周出现明显升高,且呈进行性加重,这个结果与ADR诱发肾小球上皮细胞脂质过氧化反应,破坏滤过膜有关;肌酐升高的同时血清尿素氮也有所升高,24 h尿蛋白、血肌酐、血尿素氮的升高及成活率呈ADR注射剂量依赖。各注射剂量组大鼠肾脏均出现FSGS病理改变,肾小球硬化程度随着ADR注射剂量的增加呈现出逐渐加重的趋势,考虑可能为ADR的肾毒性所导致。不同ADR注射剂量组大鼠4周、8周时4.5~6 mg/kg组成活率低于50%,4 mg/kg组的8周成活率为61.1%,成活率的下降可能与ADR的注射剂量及其副作用有关。实验结果提示:ADR注射剂量越大,FSGS的表现越重,Scr水平越高,肾功能越差;无论从外观还是肾脏病理,3~6 mg/kg剂量组虽然都能出现FSGS的表现,但4~6 mg/kg剂量组死亡率高。故较之其余剂量组,国产ADR使用3 mg/kg注射剂量成模率高,死亡率最低,同时也符合人类FSGS表现,为ADRN较为理想的注射剂量。
因此,阿霉素肾病大鼠模型是应用较多的肾病经典模型之一,其稳定性及模型的成活率会直接影响实验结果,而ADRN造模中注射药物的产地、注射剂量及注射途径的选择决定着成模周期及成模率,部分剂量虽能诱导出大鼠肾脏局灶节段硬化,但死亡率较高,部分剂量不能诱导出肾脏FSGS。所以,理想的注射剂量有助于在成模的同时减少动物死亡,避免因死亡率高或成模率低对实验结果造成的影响,由于国产ADR尾静脉注射剂量3 mg/kg模型大鼠死亡率低,同时大鼠肾脏病理又能表现出符合人类肾小球 FSGS的改变,是较为理想的造模剂量。
[1] 鲁斌,李新民,马融.对改造的阿霉素肾病模型的评价[J].实验动物科学与管理,1999,16(3):5-8.
[2] 鲁艳芳,陈陶后,黄琼霞,等.温阳、活血等方药对大鼠阿霉素肾病模型作用的比较研究[J].中国中医药科技,1999,6(6):363-365.
[3] 彭征屛,李荣辉,冯伟.调激宁配合强的松对大鼠阿霉素肾病模型的作用[J].中国中西医结合杂志,2001,21:94 -95.
[4] 郑镇,贾汝汉,王学玉.血管紧张素Ⅱ受体拮抗剂对阿霉素肾病模型骨调素表达的影响[J].华中科技大学学报(医学版),2003,32(1):51 -54.
[5] 张秋林,陈思源.复方雷公藤片对大鼠肾病模型肾小球基底膜阴离子位点的影响[J].湖北中医杂志,2006,28(2):9-10.
[6] 陈广涛,王惠君,李戈,等.真武汤对肾小球硬化影响的实验研究[J].光明中医,2008,23(8):1074-1076.
[7] 张岚,王惠萍,毛云英.基质金属蛋白酶-2在阿霉素肾病大鼠肾小球中的表达及其意义[J].西安交通大学学报(医学版),2011,32(4):470 -472.
[8] 万毅刚,孙伟,窦晨辉,等.雷公藤多苷对阿霉素肾病模型鼠肾组织TGF-β1/Smad信号通路的干预作用[J].中国中西医结合杂志,2011,31(4):517 -524.
[9] 魏明刚,孙伟,陈继红,等.雷至胶囊对阿霉素肾病模型基质金属蛋白酶及其抑制物的作用[J].时珍国医国,2011,22(2):399-401.
[10] 徐海山,庄永泽,曾俊婷.单侧肾切除+股静脉注射阿霉素制作进展性肾病模型[J].当代医学,2009,15(34):41 -42.
[11] Bertani T,Poggi A,Pozzoni R,et al.adriamycin-induced nephritic syn-drome in rats:sequence of pathologic events[J].lab invest,1982,46(1):16 -22.
[12] 刘韵璐,廖志航,陈东辉,等.两种造模方法致大鼠实验性肾病模型的肾功能及病理变化比较[J].中药药理与临床,2011,27(3):117 -119.
[13] Ogura R,Sugiyama M,Haramaki N,et al.Electron spin resonance studied on the mechanism of adriamycin-induced heart mitochondrial damages[J].Cancer Res,1991,51(13):3555-3558.
[14] Thakkar NS,Potten CS.Abrogation of adriamycin toxicity in vivo by ycloheximide[J].Biochem Pharmacol,1992,43(8):1863-1891.
[15] Bertani T,PoggiA,PozzoniR,etal.Adriamycin-induced nephritic syndrome in rats:sequence of pathologic events[J].Lab Invest,1982,46(1):16 - 23.
[16] O’Donnell MP,Michels L,Kasiske B,et al.Adriamycin-induced chronic proteinuria:a structural and functional study[J].J Lab Clin Med,1985,106(1):62 -67.

