一例转移性直肠癌患者多学科协作多线治疗体会
苑仁冰 庄永志
一、病例介绍
男性患者,57岁,2008年6月出现排便次数增加,大便不成形,癌胚抗原(CEA)检测值为17.55 ng/ml,未诊治。2008年8月复查CEA为27.5 ng/ml,行纤维结肠镜检查示:直肠菜花样肿物,环肠腔一周,致肠腔狭窄,镜身不能通过。病理回报为:腺癌。该患於2008年8月18日行“直肠癌根治术”,术中见:直肠上动脉旁见数枚肿大淋巴结,最大达8×10×8 mm3。术中冰冻病理示:淋巴结内见癌组织,上下切端未见癌侵及。术后病理示:直肠溃疡型中分化腺癌,侵及浆膜层,上、下切端未见癌侵及,肠系膜淋巴结可见癌转移(5/14),直肠上动脉根部淋巴结(0/3)、左闭孔淋巴结(0/2)、右闭孔淋巴结(0/3)、右髂血管旁淋巴结(0/2)、左髂血管旁淋巴结(0/1)未见癌转移;腹主动脉右髂旁软组织未见癌侵及。术后于外院应用FOLFOX方案化疗6周期。2010年3月5日行腹部核磁检查示:考虑肝内转移瘤(图1)。行PET-CT检查提示:肝脏占位性病变葡萄糖代谢浓聚(FDG)代谢异常增高,结合病史,考虑为直肠癌术后肝脏转移。
二、诊疗过程
2010年3月20日患者就诊于我科,诊断为直肠癌术后Ⅳ期、肝转移。血常规、生化全项检查均正常,CEA为13.1 ng/ml,KPS评分90分。经多学科协作组会诊后建议:(1)肝内转移病灶为可切除的异时性转移,治疗上可采取行转移病灶切除后进行有效方案化疗或观察。(2)行新辅助化疗2~3个月,然后行肝转移切除术,再行化疗。
实际治疗情况:2010年3月23患者因经济等多方面原因拒绝行基因检测及转移病灶切除术,遂于我科应用FOLFOX方案化疗6周期,CEA逐步降至正常,每三个周期复查腹部增强CT评价疗效,均提示病灶稳定(图2)。2010年6月21日起应用左亚叶酸钙联合5-氟尿嘧啶方案4周期,化疗后曾出现I°骨髓抑制,对症治疗后好转。在化疗期间 CEA 逐步升高,由 3.2 ng/ml增至 8.06 ng/ml,但腹部增强CT仍提示肝脏转移病灶无变化(图3)。2010年8月应用原FOLFOX方案化疗2周期,因患者应用L-OHP后出现严重的周身瘙痒不适而停用FOLFOX方案。2010年9月23日更换为FOLFIRI方案治疗2周期。2010年11月15日于我科行盆腔适形放射治疗,给予Dt44Gy/22F。期间复查肝脏转移病灶无变化(图4),CEA为7.4 ng/ml。
2011年1月13日于外院行右肝肿瘤切除术,术后病理示:(肝右叶)转移性腺癌,中度分化,结合临床考虑来自直肠。免疫组化:CA199(+++),CK7(-),p53(-),Her-2(-)。肝切除术后CEA降至正常,术后给予希罗达每次2.0 g,每日2次,第1~14天口服,后因出现Ⅲ°口腔黏膜反应,不能耐受,改用口服替吉奥维持治疗,并定期复查。2011年10月28日复查盆腔增强CT示:术区肠壁组织增厚,不除外复发。2011年10月31日起应用伊立替康联合雷替曲塞方案化疗2个周期,2011年12月16日我院行肠镜取病理提示:回盲部及直肠术后吻合口慢性炎症。排除吻合口复发,遂停止化疗。
2012年5月肿瘤标志物CEA再次升高为13.49 ng/ml,复查PET-CT示:直肠癌术后,膈下肝顶占位病变伴FDG代谢异常增高,余组织器官未见异常。2012年5月24日于外院再次行右肝肿瘤切除术,术中见:肿瘤位于肝右叶实质内,约2×2 cm,表面凹陷,质地硬,边界尚清,余肝未见转移性病灶。2012年7月至9月应用雷替曲塞化疗4周期,2012年10月起希罗达维持化疗。2012年12月患者再次因CEA升高为22.65 ng/ml,行PET-CT检查提示:直肠癌术后,右侧肾上腺FDG代谢异常增高,考虑肾上腺转移,与2012年5月PET-CT比较,肝脏未见明确转移灶,肾上腺转移灶为新发。
2013年3月1日患者于外院行右肾上腺切除术,术中见:肿物位于右肾上腺,大小3.0×3.0 cm,质硬,与腰大肌、膈肌及腔静脉粘连较重。术后病理:右肾上腺转移性中分化腺癌。免疫组化:villin(+)、CK20(+)、CK7(-)。术后CEA降至正常。2013年4月起于我科应用替吉奥每次60 mg,每日2次,第1~14天口服,化疗3个周期,期间CEA逐步升高,2013年6月改用单药雷替曲塞6 mg,第1d加入静脉滴注,监测CEA波动在6.46~8.82 ng/ml之间,影像学检查未见异常。目前患者病情稳定仍在治疗中。
三、讨论
高复发率和远处转移是直肠癌治疗失败的主要原因,对于晚期直肠癌患者延长生存期、改善生活质量、延缓疾病进展是临床治疗的首要目的,外科、内科、放疗科等多学科协作,并结合患者实际情况的个体化治疗是解决问题的主要手段。
肝脏是结直肠癌最常见的转移器官。有多项研究结果表明结直肠癌肝转移后如果不接受手术治疗,5年生存率较低[1]。Pawlik等[2]报道结直肠癌肝转移切除后的 5年无瘤生存率接近20%。本例患者首次肝脏转移灶切除后一年,非手术部位再次出现肝脏转移,行二次肝脏转移灶切除。近期一项回顾性研究[3]入组了43例接受反复肝转移瘤切除术的患者,结果显示5年总生存期与无疾病进展生存期分别为73%与22%。
我科应用“STOP AND GO”策略对该患进行治疗,力图在控制病情的同时,降低毒副反应,提高患者治疗耐受力,减轻经济负担。维持治疗是近年晚期结直肠癌治疗的新理念,OPTIMOX、MACRO[4-5]等研究结果表明,维持治疗与持续化疗相比,疗效基本相当,但维持治疗的耐受性更好。本例患者至今已存活六年,患者在获得长期生存的同时,且拥有较高的生活质量,这得益于多学科综合治疗方法的应用,以及“打打停停”治疗原则的实施。另外,本病例在常规影像检查未见异常的情况下,多次因CEA升高而行PET-CT检查并发现新增转移病灶,由此可见,CEA持续升高,但影像学检查阴性的结直肠癌患者,行PET-CT检查可提早发现隐匿转移病灶,使患者获益。
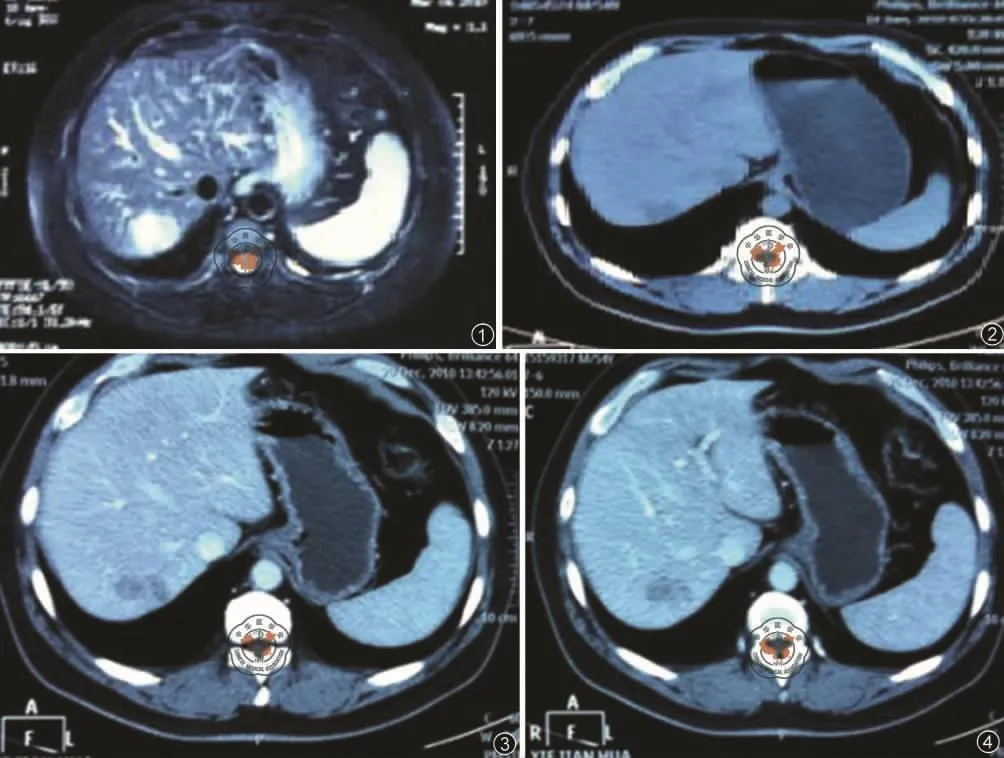
图1 结肠癌肝转移患者于2010年3月行肝脏核磁检查图像;图2 结肠癌肝转移患者在FOLFOX方案化疗6周期后于2010年6月行肝脏增强CT检查图像;图3 结肠癌肝转移患者于2010年8月行肝脏增强CT检查图像;图4 结肠癌肝转移患者于2010年12月行肝脏增强CT检查图像
[1] Van Cutsem E,Nordlinger B,Adam R,et al.Towards a pan-European consensus on the treatment of patients with colorectal liver metastases.Eur JCancer,2006,42:2212-2221.
[2] Pawlik TM,Scoggins CR,Zorzi D,et al.Effect of surgical margin status on survival and site of recurrence after hepatic resection for colorectal metastases.Ann Surg,2005,241:715-722.
[3] Andreou A,Brouquet A,Abdalla EK,et al.Repeat hepatectomy for recurrent colorectal liver metastases is associated with a high survival rate.HPB(Oxford),2011,13:774-782.
[4] Chibaudel B,Maindrault-Goebel F,Lldeo G,et al.Can chemotherapy be discontinued in unresectable metastatic colorectal cancer?The GERCOROPTIMOX2 study.JClin Oncol,2009,27(34):5727-5733.
[5] Tabernero J,Aranda E,Gomez A,et al.Phase Ⅲ study of first-line XELOX plus bevacizumab(BEV)for 6 cycles followed by XELOX plus BEV or single agent(s/a)BEV as maintenance therapy in patients with metastatic colorectal cancer(mCRC).The MACRO trial. Chicago, Illinois:McCormick Palace, ASCO 2010 abstract 3501.
苑仁冰,庄永志.一例转移性直肠癌患者多学科协作多线治疗体会[J/CD].中华结直肠疾病电子杂志,2013,2(6):321-322.

