流加不同物质对大肠杆菌DB15(pAET-8)表达人表皮生长因子的影响*
张艳军,李志敏,叶 勤
(1.浙江师范大学 化学与生命科学学院,浙江 金华 321004;2.华东理工大学 生物反应器工程国家重点实验室,上海 200237)
人表皮生长因子(hEGF)是含有53 个氨基酸的小分子多肽,具有刺激蛋白转运、激活胞外大分子合成和促细胞增殖等作用,在临床上具有良好的应用前景和巨大的经济价值[1].因此,甘人宝课题组[2]构建了pAET-8 质粒,人表皮生长因子基因在phoA 启动子控制下表达.文献[3]通过优化表达期pH 和葡萄糖流加策略,使得大肠杆菌DA19(pAET-8)在基本培养基中表达hEGF 水平由8 mg·L-1提高到了78.7 mg·L-1.文献[4]在此基础上通过优化氯化钙的添加量和添加时间进一步提高了hEGF 在基本培养基中的表达水平,最高达到了228 mg·L-1.
phoA 表达系统不仅具有分泌表达系统的优点,而且是一种经济的表达系统,只需限制培养基中磷的浓度即可.作为细胞生长的必需元素,限制表达阶段磷元素的浓度必然会影响细胞的生理和代谢.例如,在大肠杆菌DB15(pAET-8)表达hEGF 过程中,hEGF 生产速率在表达阶段初期最大,表达阶段后期活菌数明显降低[4],以活菌数为基准的hEGF 比生产速率也有所降低,以菌体干质量为基准的hEGF 比生产速率降低更加明显,同时还伴随着乙酸生成速率的提高.因此,本研究考察了表达阶段流加不同物质——磷酸盐、蛋白胨(tryptone)及酵母抽提物等对大肠杆菌DB15(pAET-8)表达人表皮生长因子的影响.
1 材料与方法
1.1 菌种
大肠杆菌DB15 为华东理工大学叶勤实验室筛选得到的耐乙酸突变株[5].质粒pAET-8 由中国科学院上海细胞与生物化学研究所甘人宝课题组[2]构建.基因工程菌DB15(pAET-8)由叶勤实验室构建,并保存于-20 ℃的25%甘油溶液中.
1.2 培养基
所有培养基均使用去离子水配置.
1)LB 培养基 1 L 含蛋白胨(英国Oxoid 公司)10 g,酵母抽提物(Oxoid 公司)5 g,NaCl 10 g,pH 7.2.
2)M 培 养 基 1 L 含Na2HPO4·12H2O 15.12 g,KH2PO43 g,NaCl 0.5 g,MgSO4·7H2O 0.5 g,CaCl20.011 g,葡萄糖6 g,氯化铵1 g,10 g·L-1维生素B1溶液0.2 mL,微量元素混合液[6]0.2 mL,pH 7.0.
3)MP 培养基 为磷限制的M 培养基,1 L 中含Na2HPO4·12H2O 1.89 g,KH2PO40.375 g,其他成分与M 培养基相同.
4)补料培养基 1 L 中含葡萄糖400 g,MgSO4·7H2O 10 g.
1.3 培养方法及条件
1.3.1 种子培养
将1 mL 冷冻保存的菌种DB15(pAET-8)接入装有30 mL LB 培养基的250 mL 锥形瓶里,37 ℃,250 r·min-1摇床培养11 h.转接1 mL 一级种子液于装有70 mL M 培养基的500 mL 锥形瓶中,相同条件下培养9 h,作为表达hEGF 培养的二级种子.
1.3.2 发酵罐培养
发酵罐装入2.36 L MP 培养基,接入140 mL二级种子液.培养条件:搅拌转速为 400 r·min-1,通气量为4 L·min-1,温度为37 ℃.通气量和搅拌速率根据溶解氧(DO)进行手动调整,以保证整个培养的过程中溶解氧在20%以上.用14%氨水控制培养基的pH 值,生长期控制为7.0,表达期控制为7.8.在实验过程中及时测定发酵液中铵离子浓度,当其缺乏时手动补加100 g·L-1的氯化铵培养基.
1.4 分析方法
菌体浓度测定采用浊度法,将培养液适当稀释后测A600,按标准曲线计算菌体干质量.葡萄糖含量采用葡萄糖测定试剂盒(上海科欣生物技术研究所)测定.铵离子浓度采用Berthelot 法[7]比色测定.磷酸盐采用磷钼蓝法[8]测定.乙酸测定采用气相色谱法,仪器型号为GC112A(上海分析仪器厂),以Chromosorb101 作为固定相.人表皮生长因子(hEGF)测定采用Schagger 等改进的分离小分子肽的tricine-tris 系统[9]分离,考马斯亮蓝染色,用图像分析系统(复日生物电泳图像分析系统,上海)和分析软件(Smart View 分析软件)进行扫描定量.
2 结果
2.1 大肠杆菌DB15(pAET-8)表达hEGF 培养过程
大肠杆菌DB15(pAET-8)表达hEGF 的培养过程[4]分为3 个时期(见图1):Ⅰ期为分批培养阶段,即从发酵开始到初糖耗完,以溶解氧跳升为结束标志;Ⅱ期为指数生长期,即初始葡萄糖耗尽后按照指数流加方式流加葡萄糖,控制菌体比生长速率在0.26 h-1,直到菌体质量浓度达到10.2 g·L-1,此时培养基中的磷含量已降低至足以诱导hEGF 的表达;Ⅲ期为表达期,添加0.22 g·L-1氯化钙,并以恒速方式(补糖速率为6.61 g·h-1)流加补料培养基,直到发酵结束.该补料分批培养过程记为FB-1,菌体质量浓度、乙酸含量、磷质量浓度、菌体含磷量和葡萄糖比消耗速率(Qs)和hEGF 产量的变化趋势如图1 所示.

图1 大肠杆菌DB15(pAET-8) 表达hEGF 的培养过程(FB-1)
在分批培养阶段(Ⅰ期),大肠杆菌DB15(pAET-8)以0.47 h-1的最大比生长速率生长,6.88 h时初始葡萄糖耗尽,溶解氧跳升,此时乙酸含量为0.17 g·L-1.在Ⅱ期前期,残余葡萄糖含量一直为零,且无乙酸产生;但在Ⅱ期接近尾声时,磷元素已成为菌体生长的限制元素,造成乙酸积累,使得Ⅱ期结束时乙酸的质量浓度达到0.26 g·L-1.在表达阶段(Ⅲ期),无机磷(Pi)的质量浓度维持在2 mg·L-1左右,但13.14~21.63 h时菌体质量浓度仍有明显的增加,由10.6 g·L-1增加至13.1 g·L-1.由于补料培养基中并不含有无机磷,因而,此阶段菌体质量浓度的增加是以降低菌体含磷量为代价的,其由32.3 mg·g-1降低至26.0 mg·g-1(见图1).此阶段hEGF 合成速率为12.1 mg·L-1·h-1,且没有乙酸积累.24.2 h后菌体质量浓度无明显增加,hEGF 的生产速率降低至8.9 mg·L-1·h-1,且乙酸生成速率增加.至培养结束时,hEGF 和乙酸的质量浓度分别为207 mg·L-1和0.77 g·L-1.
2.2 表达阶段流加不同物质对hEGF 表达的影响
磷元素是微生物细胞中许多含磷细胞成分,如核酸、核蛋白、磷脂、三磷酸腺苷(ATP)、辅酶的重要组成元素,在遗传代谢、生长发育、能量供应等方面都是不可缺少的.在大肠杆菌DB15(pAET-8)表达hEGF 阶段,磷元素含量一直处于限制状态,这必然会对菌体生理代谢及hEGF 表达造成影响.因此,笔者考察了表达阶段流加不同物质——磷酸盐、蛋白胨和酵母抽提物等对大肠杆菌DB15 (pAET-8)表达人表皮生长因子的影响.
2.2.1 磷酸盐
表达阶段后期菌体质量浓度不再增加时,hEGF 生产速率明显降低.因此,在表达阶段限制性流加磷酸盐,以维持菌体的生长,但保持培养液的磷限制,考察了其对hEGF 表达的影响.
培养条件与FB-1 相同.表达阶段以8.49 g·h-1恒速流加补料培养基,同时以12 mg·h-1的流速流加无机磷,记为FB-2.整个过程各指标的变化趋势见图2,并与FB-1 过程进行比较.
在野生型大肠杆菌中,phoA 编码的碱性磷酸酯酶的合成在磷过量培养基中被阻遏,而在磷限制培养基中被去阻遏.phoA 启动子的诱导与胞内磷含量无关,而由胞外无机磷的含量控制[10].虽然在表达阶段流加了磷酸盐,但培养基中无机磷含量及表达阶段初期菌体含磷量等均与对照FB-1接近(见图2(b)).因此,流加磷酸盐并未影响phoA 表达系统启动表达hEGF.此外,在表达阶段恒速流加磷酸盐,不但增加了表达初期菌体的比生长速率,而且延长了菌体生长期,使得菌体质量浓度在27 h 后仍有明显的增加(见图2(a)).与FB-1 相比,表达期流加磷酸盐使得最终菌体质量浓度提高了31%.尽管葡萄糖比供应速率较对照提高了0.027 g·g-1·h-1,但hEGF 的表达量比对照FB-1 减少了57%,仅为90 mg·L-1.因此,在表达阶段仅仅补加磷酸盐对hEGF 的表达不但无益,反而有害.此外,在表达阶段后期流加磷酸盐也未能改善hEGF 的表达.
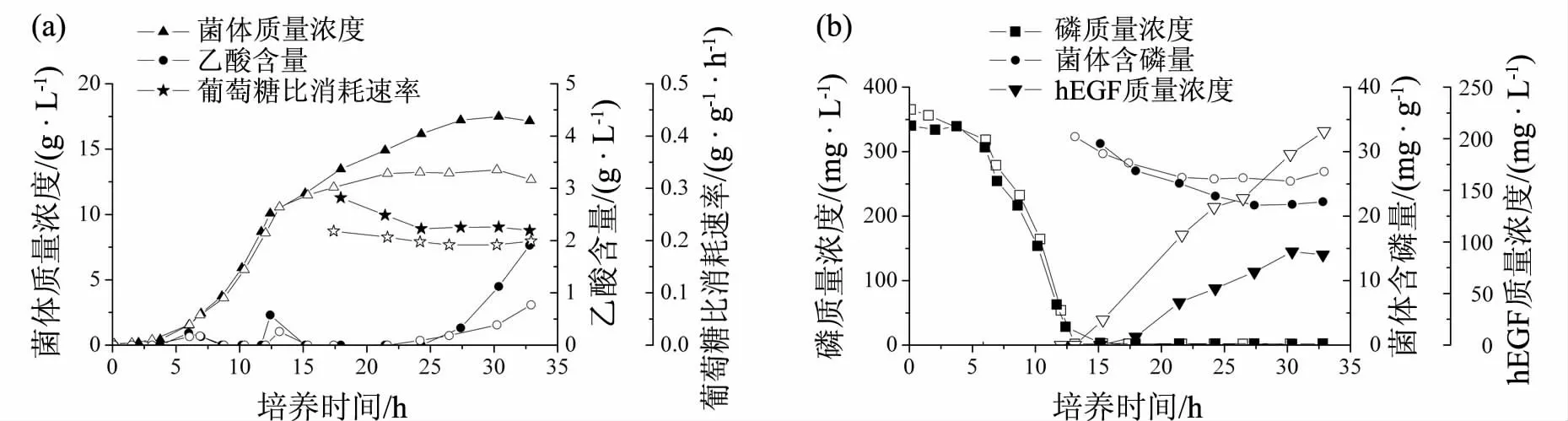
图2 表达阶段流加磷酸盐对hEGF 生产的影响(FB-2)
2.2.2 蛋白胨
蛋白胨中含有少量无机磷,而且在灭菌过程中部分有机磷会转化为无机磷;同时,蛋白胨还含有各种氨基酸,可以为蛋白翻译提供前体.因此,在表达期间流加蛋白胨,考察了其对hEGF 表达的影响.
培养条件与FB-1 相同.表达阶段以6.95 g·h-1恒速流加补料培养基(在26 h 时提高至10.16 g·h-1),同时以1.23 g·h-1的速度流加蛋白胨,记为FB-3.整个过程各指标的变化趋势见图3.
灭菌后蛋白胨含有少量的磷酸盐,但整个表达阶段磷的质量浓度维持在较低水平,菌体含磷量也与对照FB-1 接近,因此并未影响phoA 表达系统的诱导表达.与对照FB-1 相比,流加蛋白胨延长了菌体生长时间,同时培养结束时菌体质量浓度提高了约23%.尽管在表达阶段流加蛋白胨可以为hEGF 合成和菌体生长提供各种氨基酸,但hEGF 表达水平和表达速率却有所降低,hEGF比生产速率则降低得更多.表达阶段后期乙酸含量略高于同期对照,与较高的葡萄糖比供应速率有关.
2.2.3 酵母抽提物
酵母抽提物不但含有无机磷和各种氨基酸,而且还含有核苷酸及微量元素,它在培养过程中起到非常重要的作用,如减少乙酸生成、增强培养基缓冲能力、促进菌体生长和外源蛋白表达等[11].因此,在表达期间流加酵母抽提物,考察了其对hEGF 表达的影响.

图3 表达阶段流加蛋白胨对hEGF 生产的影响(FB-3)

图4 表达阶段流加酵母抽提物对hEGF 生产的影响(FB-4)
培养条件与FB-1 相同.表达阶段以6.57 g·h-1恒速流加补料培养基(在26.56 h 时提高至8.82 g·h-1),同时以1.32 g·h-1的流速流加酵母抽提物,记为FB-4,其过程曲线见图4.
酵母抽提物灭菌后含有少量的磷酸盐,与流加磷酸盐和蛋白胨的培养过程类似,流加酵母抽提物不但增加了表达阶段初期菌体的比生长速率,而且延长了菌体生长时间,同时使得培养结束时菌体质量浓度提高了19%,但整个过程中磷酸盐质量浓度维持在较低水平,表达阶段菌体含磷量也与对照FB-1 接近,因此并未影响phoA 表达系统的诱导表达.培养结束时,hEGF 表达水平达到250 mg·L-1,明显高于在表达阶段流加磷酸盐时hEGF 的表达水平,这是因为酵母抽提物可以为菌体生长和合成hEGF 提供氨基酸和核苷酸,而在基本培养基中这些都需要由葡萄糖从头合成.在表达阶段前期,2 个过程的葡萄糖比供应速率都在0.20 g·g-1·h-1左右,hEGF 的生产速率也基本一致,但FB-4 的菌体质量浓度高于对照FB-1,而hEGF 的比生产速率低于FB-1.
对照FB-1 在24 h 左右即开始有乙酸积累,而FB-4 培养过程中乙酸含量几乎一直为零.活细胞计数表明:流加酵母抽提物使得表达期的活菌数降低较少,表明流加酵母抽提物减轻了表达hEGF 所引起的细胞代谢负荷,从而减少了乙酸的生成[11];同时,表达阶段后期hEGF 表达速率也未有明显的降低.培养过程中补入的氨水量也有所减少,这是因为大肠杆菌在利用复合氮源作为碳源时可以释放出氨[11],从而减少了控制pH所需的氨水.
FB-4 培养过程中几乎没有乙酸产生,表明葡萄糖可能不足,提高表达阶段葡萄糖供给速率后hEGF 表达速率无明显改善,反而造成了表达阶段后期乙酸的积累(数据未列出).
3 讨论与结论
phoA 表达系统不仅具有分泌表达系统的优点,而且是相对经济的表达系统之一,只需培养基中磷含量较低即可.但是作为细胞生长的必需元素,磷限制会影响细胞的生理和代谢.在表达阶段单独流加磷酸盐虽然增加了表达初期菌体的比生长速率,延长了菌体生长期,提高了菌体质量浓度,但是hEGF 产量却比对照组减少了57%.大肠杆菌在基本培养基中表达hEGF 时需要从头合成各种氨基酸,而过多的菌体生长会消耗部分能量和氨基酸前体,由此推测氨基酸合成可能是hEGF表达的限速步骤.在表达阶段流加蛋白胨不但可以补充无机磷,同时也可以为hEGF 合成和菌体生长提供各种氨基酸,但hEGF 表达水平和表达速率却有所降低.酵母抽提物不但含有无机磷和各种氨基酸,而且还含有核苷酸及微量元素,但是在表达阶段流加酵母抽提物也未能提高hEGF 表达水平.由此表明,氨基酸或核苷酸合成并不是hEGF 表达的限速步骤.
蛋白质的合成是一个高能耗的过程,延伸的肽链每增加一个氨基酸需消耗1 个ATP 和3 个三磷酸鸟苷(GTP)[12],是细胞内最耗能的一个过程.此外,质粒的复制也需要一定的能量,质粒越大,拷贝数越多,所需的能量就越多[13].因此,在过量表达外源蛋白的重组大肠杆菌中,能量供给往往受到限制[14].在大肠杆菌DB15(pAET-8)表达hEGF 阶段,磷元素一直处于限制状态,而磷限制是非常强的解偶联剂[15].在磷限制条件下,葡萄糖运输、三羧酸循环(TCA 循环)及呼吸链中的基因转录水平均被下调,而糖酵解途径和还原型辅酶Ⅰ(NADH)脱氢酶基因则被上调[12].大肠杆菌在磷限制条件下蛋白质表达分析表明:sucC,sucB,gltA 和icdE 等编码的TCA 循环中的酶,以及丙酮酸脱氢酶亚基(AceF)的表达水平降低了2~4 倍;而gnd 编码的磷酸戊糖呼吸途径(PP 途径)中6-磷酸葡萄糖酸脱氢酶和pfkB 编码的糖酵解途径(EMP 途径)中磷酸果糖激酶-2 单体的表达水平则分别增加了4.98 和3.89 倍[16].此外,Bacillus subtilis 在不同营养限制下的代谢流分布结果表明:与碳源或氮源限制相比,磷限制条件下的TCA 循环流量大大降低,而流向乙酸等溢流代谢物的流量则大大提高[17].同时,大肠杆菌在磷限制条件下下调了TCA 循环和呼吸链活性[12],从而减少了ATP 的形成.因此,提高大肠杆菌DB15(pAET-8)合成ATP 的能力或许是提高hEGF 表达的关键.
此外,合成精氨酸、组氨酸、天冬氨酸、天门冬酰胺、甲硫氨酸、异亮氨酸、半胱氨酸、谷氨酰胺及缬氨酸途径的基因转录水平在磷限制条件下被下调[15],这在一定程度也会影响hEGF 在基本培养基中的表达.
[1]张海毅,李志敏,钱悦,等.葡萄糖供应速率对大肠杆菌表达及分泌人表皮生长因子的影响[J].华东理工大学学报,2006,32(12):1404-1408.
[2]甘人宝,黄培勇,袁宇,等.人表皮生长因子在大肠杆菌中的高效表达和分泌[J].生物化学与生物物理学报,1992,24(6):587-588.
[3]Han Yun,Li Zhimin,Du Peng,et al.Production of human epidermal growth factor in fed-batch culture of acetate-tolerant Escherichia coli[J].Chin J Chem Eng,2007,15(5):760-764.
[4]Zhang Yanjun,Li Zhimin,Ye Qin.Enhanced production of human epidermal growth factor under control of the phoA promoter by acetate-tolerant Escherichia coli DB15 in a chemically defined medium[J].Biotechnology and Bioprocess Engineering,2010,15(4):626-634.
[5]朱才庆,叶勤.大肠杆菌DH5α 耐乙酸突变株的选育及其代谢特性研究[J].微生物学报,2003,43(4):460-465.
[6]Pan J G,Rhee J S,Lebeault J M.Physiological constraints in increasing biomass concentration of Escherichia coli B in fed-batch culture[J].Biotechnology Letters,1987,9(2):89-94.
[7]Shahinian A H,Reinhold J G.Application of the phenol-hypochlorite reaction to measurement of ammonia concentrations in kjeldahl digests of serum and various tissues[J].Clinical Chemistry,1971,17(11):1077-1080.
[8]Fiske C H,Subbarow Y.The colorimetric determination of phosphorus[J].J Biol Chem,1925,66:375-400.
[9]Schägger H,von Jagow G.Tricine-sodium dodecyl sulfate-polyacrylamide gel electrophoresis for the separation of proteins in the range from 1 to 100 kDa[J].Anal Biochem,1987,166(2):368-379.
[10]Rao N N,Roberts M F,Torriani A,et al.Effect of glpT and glpD mutations on expression of the phoA gene in Escherichia coli[J].J Bacteriol,1993,175(1):74-79.
[11]Panda A K,Khan R H,Mishra S,et al.Influences of yeast extract on specific cellular yield of Ovine growth hormone during fed-batch fermentation of E.coli[J].Bioprocess Engineering,2000,22(5):379-383.
[12]郑志永,关怡新,林东强,等.重组基因表达对大肠杆菌生理的影响[J].生物加工过程,2004,2(2):13-17.
[13]Andersson L,Yang Shaojun,Neubauer P,et al.Impact of plasmid presence and induction on cellular responses in fed batch cultures of Escherichia coli[J].J Biotechnol,1996,46(3):255-263.
[14]Kayser A,Weber J,Hecht V,et al.Metabolic flux analysis of Escherichia coli in glucose-limited continuous culture.I.Growth-rate-dependent metabolic efficiency at steady state[J].Microbiology,2005,151(Pt 3):693-706.
[15]Johansson L,Lidén G.Transcriptome analysis of a shikimic acid producing strain of Escherichia coli W3110 grown under carbon-and phosphate-limited conditions[J].J Biotechnol,2006,126(4):528-545.
[16]Van Bogelen R A,Olson E R,Wanner B L,et al.Global analysis of proteins synthesized during phosphorus restriction in Escherichia coli[J].J Bacteriol,1996,178(15):4344-4366.
[17]Dauner M,Storni T,Sauer U.Bacillus subtilis metabolism and energetics in carbon-limited and excess-carbon chemostat culture[J].J Bacteriol,2001,183(24):7308-7317.

