两种木麻黄变异类型的抗盐性比较
邬 金,温国胜,张汝明,陈嘉琦
(浙江农林大学 亚热带森林培育国家重点实验室培育基地,浙江 临安 311300)
木麻黄(Casuarina equisetifolia)引种栽培于热带、亚热带地区的滨海疏松沙土中,为多用途速生树种[1~2]。对于植物逆境的生理适应性研究前人已经进行了深入探讨,但有关木麻黄在逆境适应性方面的研究还需要更进一步的探索。鉴于当前浙江沿海防护林建设中高大乔木树种贫乏,沿海生态环境日益恶化的现状,筛选抗逆性较强的木麻黄优良无性系,对浙江沿海林业生态建设有重要的理论意义和实用价值。
海岸沙地土壤盐分较高,含水量较低,且持水力较差,木麻黄能够在这种恶劣的环境中作为先锋树种正常生长繁衍,这与它本身良好的抗逆适应性是分不开的[3]。本实验将结合丙二醛(MDA)含量和抗氧化酶活性的测定,研究NaCl胁迫下木麻黄的逆境生理响应机制,旨在为浙江省木麻黄的北移驯化筛选优良类型,提供切实的理论依据。
1 材料与方法
1.1 试验材料
试验地设于浙江省临安市浙江农林大学东湖校区的平山苗圃,30° 14′ N,119° 42′ E,属中纬度北亚热带季风气候区,四季分明,气候温和,雨量充沛,但昼夜温差大。多年平均气温为15.80℃,其中7月为最热月,平均温度为28.10℃,1月为最冷月,平均气温为3.40℃,极端高温为41.90℃,极端低温为-13.30℃。全年降水量1 628.6 mm,历年平均日照明数为1 939 h,无霜期234 d。
供试材料为浙江省台州市玉环县大鹿岛筛选出的两种木麻黄变异类型。将各变异类型按照树皮颜色分为黑皮和红皮,编号分别为B1和R5。于2010年5月将各类型的种子播种在浙江省临安市浙江农林大学东湖校区的平山苗圃进行培育。选取苗龄1 a长势优良的木麻黄实生苗的新鲜叶片作为试验材料。
于2011年9月22日剪取大棚内长势一致的木麻黄2种变异类型(B1和R5)试验苗健壮枝条(长度为20 ~30 cm),培养于盛有NaCl溶液的150 mL锥形瓶中,对其进行盐胁迫处理,NaCl溶液浓度分为6组,分别为0、50、100、150、200和 250 mmol/L(相应的处理号为B11、B12、B13、B14、B15、B16和R51、R52、R53、R54、R55、R56),处理时间共5 d。为防止水分蒸发和植株蒸腾作用导致盐溶液浓度改变,确保NaCl溶液液面不下降,每隔6 h补充些蒸馏水。分别于处理前1 d(记作0 d,作为对照)和处理后每隔24 h(分别记作1、2、3、4、5 d)取相同生长点部位的叶片进行抗氧化物酶(SOD、POD、CAT)活性和丙二醛(MDA)含量测定,每次测定均重复3次,取其平均值。
1.2 试验方法
植物抗氧化酶包括超氧化物歧化酶(superoxide dismutase,SOD)、过氧化物酶(peroxidase,POD)、过氧化氢酶(catalase,CAT),测定参照陈建勋等方法[4]。SOD活性以抑制氮蓝四唑(NBT)光化还原 50%为一个酶活性单位(U)。POD活性以OD470每分钟的增加1为一个酶活性单位(U)。CAT活性以使OD240每分钟的减少0.01为一个活性单位(U)。酶活性单位为U/g Protein。
MDA含量:参照李合生[5]的方法(略有改动)进行测定,其含量用μmol/gFW表示。原始数据用Excel 2003和SPSS13.0进行数据处理。
2 结果与分析
2.1 NaCl胁迫对两种木麻黄变异类型SOD活性的影响
活性氧在植物体内的清除是由保护酶和抗氧化物质来完成的。SOD是一种具有特定生物催化功能的蛋白质,广泛存在于自然界中,包括动物体、植物体以及一些微生物体内,它在保护植物抗氧化的作用上起着主要作用[6]。由图1可以看出,在不同浓度的NaCl溶液处理下,两种木麻黄变异类型的SOD活性均随时间的推移呈现先上升后下降,总体趋势基本一致。
B1的SOD活性在各处理期间均高于对照,从每个处理第1天到第2天迅速升高,并在第2天达到最大值,之后缓慢下降。这说明B1能够通过增加体内SOD活性来适应NaCl胁迫,且各处理第5天的SOD值均高于对照,帮助消除了NaCl 胁迫带来的O2-积累,不足以对B1机体产生很大伤害。
R5的SOD活性在各处理期间较对照不尽相同,除了在100 mmol/L的NaCl胁迫处理下,R5的SOD活性于处理第3天达到最大值,在其他处理下R5的SOD活性均于处理第2天达到最大值。在0 mmol/L的NaCl处理第5天R5的SOD活性仍高于对照,这说明R5在0 mmol/L的NaCl处理下可能受到自身营养胁迫,致使其需要通过调节SOD活性来消除营养胁迫产生的机体伤害,而其他浓度的NaCl处理第5天R5的SOD活性均小于对照,这表明R5体内受到NaCl胁迫的伤害加剧,虽然前3天能够通过增强SOD活性来抵御逆境威胁,但积累的O2-增多,R5体内更容易发生过氧化作用。就SOD活性来说,B1更强,R5变化幅度不大相对稳定。但如果凭靠SOD活性的强弱来判断抗性强弱是不科学的,有科学试验证明,单独提高一种酶的活性,对于植物抗氧化能力的提高影响不太显著[7],因此还需要结合POD和CAT两种抗氧化酶活性强弱来进一步分析。
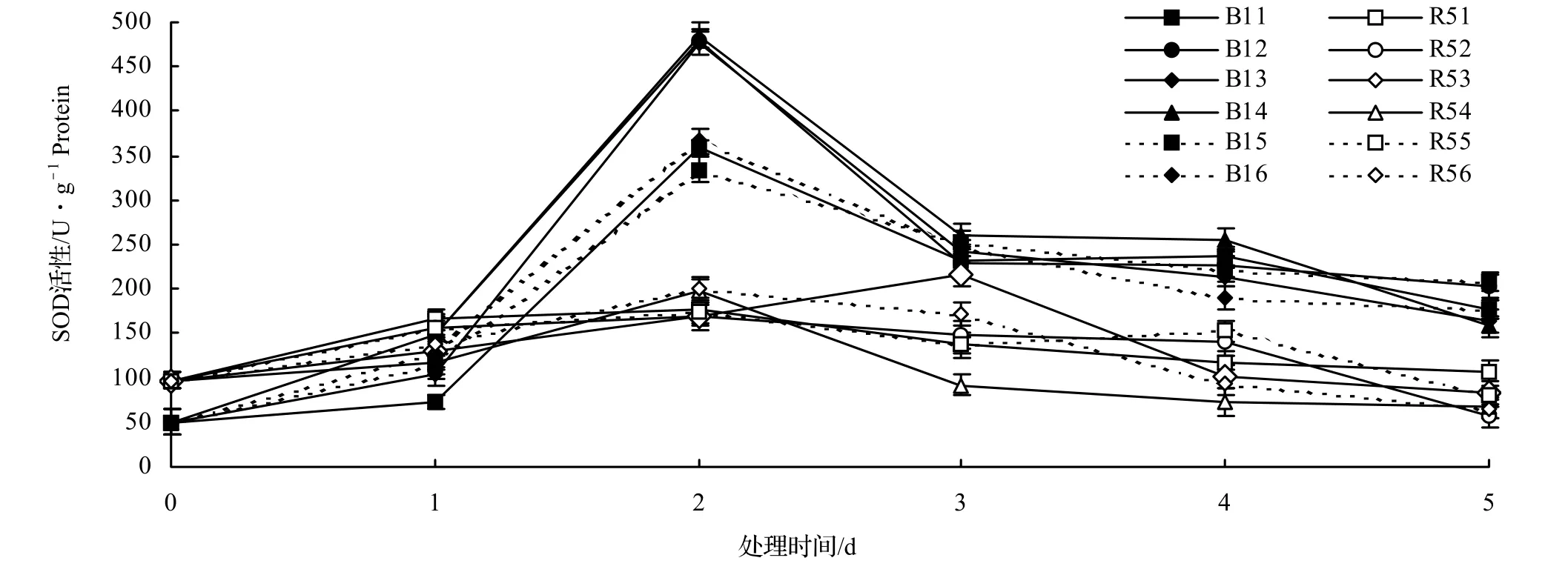
图1 NaCl胁迫下木麻黄叶片SOD活性的变化Figure1 Change of SOD activity in leaves of C.equisetifolia under NaCl stress
2.2 NaCl胁迫对两种木麻黄变异类型POD活性的影响
POD位于非原生质体中,它能减轻环境胁迫产生的过氧化物造成的膜脂过氧化伤害[8]。由图2可以看出,两种木麻黄变异类型在不同浓度NaCl溶液处理下的POD活性变化趋势有明显差异。B1的POD活性相较对照变化规律基本一致,呈现先降后升再降的趋势,在0 ~ 150 mmol/L的NaCl溶液处理,于第4天达到最大值;而在200~ 250 mmol/L的NaCl溶液处理下,POD活性均小于对照,说明此浓度的NaCl溶液对B1的胁迫增强。R5的POD活性在0 ~ 200 mmol/L的NaCl溶液处理下均比对照高,变化规律比较一致,呈先降后升的趋势,其中在0 ~ 150 mmol/L的NaCl溶液处理下于第5天达到最大值;在NaCl溶液处理浓度为200 ~ 250mmol/L的条件下,R5的POD活性呈先升后降的趋势,并于处理第3天达到最大值,在250 mmol/L的NaCl胁迫下,R5的POD活性在处理第5天低于对照,这可能是由于NaCl胁迫浓度增强使得R5受到严重伤害,POD活性受到抑制或被氧化分解。相较于B1,R5的POD活性相对较高。由于超氧化物歧化酶和过氧化物酶都是植物细胞的保护酶,能够清除H2O2和O2-自由基来保护细胞膜,两种木麻黄变异类型在不同浓度NaCl溶液处理中SOD和POD活性各有高低,虽然不能立即判断出哪种类型的抗盐性更强,但能看到的是,两种类型均能通过提高SOD和POD活性来抵抗NaCl胁迫对细胞膜的伤害,都具有一定的抗盐性。
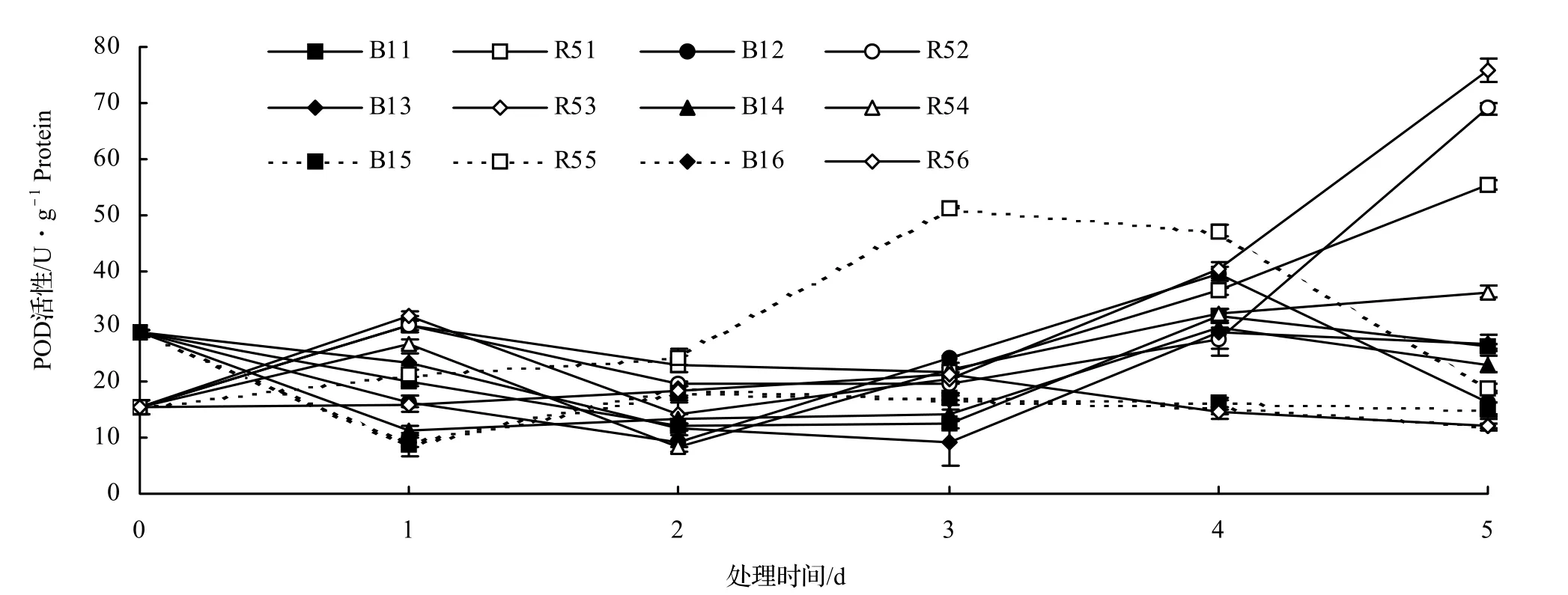
图2 NaCl胁迫下木麻黄叶片POD活性的变化Figure2 The change of POD activity in leaves of C.equisetifolia under NaCl stress
2.3 NaCl胁迫对两种木麻黄变异类型CAT活性的影响
CAT主要存在于线粒体和微体中,是清除过氧化氢的主要酶之一[8]。由图3可以看到,随着胁迫NaCl浓度的增加,两种木麻黄变异类型叶片的CAT活性也相应增加。有所不同的是,它们的变化趋势有明显差异。如图3所示,在0 ~ 150 mmol/L的NaCl处理下,B1的CAT活性均一直趋于上升状态;在200 ~ 250 mmol/L的NaCl处理下,B1的CAT活性均呈现先升后降趋势,在250 mmol/L的NaCl溶液处理第5天低于对照。而R5的CAT活性在不同浓度NaCl处理下均随时间的推移呈现正相关趋势,且都比对照高。综合来看,R5的CAT活性于处理后期明显高于B1。这说明在同等胁迫处理条件下,R5比B1要更具抗盐性,B1在200 mmol/L以上的NaCl溶液中的CAT活性较低,植物体内细胞膜受到的伤害较大。
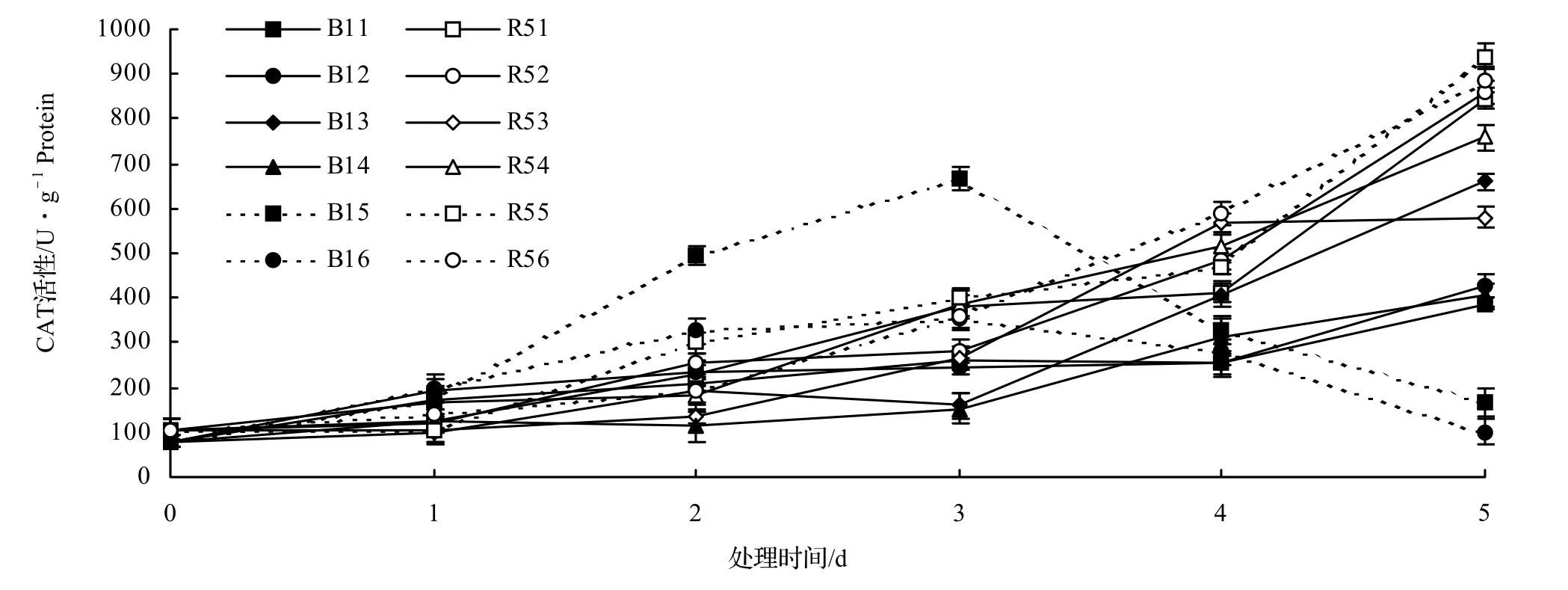
图3 NaCl胁迫下木麻黄叶片CAT活性的变化Figure3 Change of CAT activity in leaves of C.equisetifolia under NaCl stress
2.4 NaCl胁迫对两种木麻黄变异类型MDA含量的影响
由图4可以看出,整个处理期间两种木麻黄变异类型叶片中的MDA含量在NaCl胁迫下均呈现上升趋势,且随着处理时间的增加和处理NaCl浓度的增加,MDA含量也相应增加。其中,两种类型在不同浓度NaCl处理下的第1天较对照的MDA含量相差不大,处理第2天MDA含量开始增加,第3天到第5天急剧增加,并均于各处理第5天达到最大值。MDA含量的增加,表明细胞膜脂过氧化程度加强,质膜结构和功能都受到一定程度的损害。随着NaCl处理浓度的增大,B1的MDA含量逐渐高于R5,表明NaCl胁迫下B1叶片膜脂过氧化较R5严重。
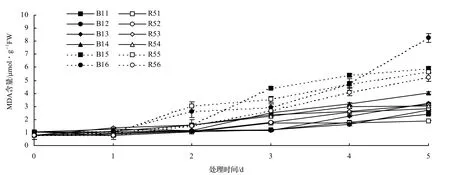
图4 NaCl胁迫木麻黄叶片MDA含量的变化Figure4 Change of MDA content in leaves of C.equisetifolia under NaCl stress
3 结论与讨论
植物的细胞质被质膜包裹,质膜是一种由类脂和蛋白质构成的生物膜[9]。细胞质膜具有维持细胞稳定性和选择透性的独特功能,植物细胞需要通过质膜才能与外界环境进行物质交换。因此各种不良环境因素都能对细胞产生影响,首先作用的就是细胞质膜[10]。若质膜受到不同程度的伤害,就不能正常进行物质能量代谢,这使得植物体自身构建一定的细胞质膜保护系统。根据质膜保护系统相关的酶活性状况可以判断出质膜系统是否受到伤害以及伤害程度。当遭受盐胁迫时,植物体内的活性氧增加,膜脂过氧化加剧,抗盐植物通过增强活性氧的清除能力来减轻对细胞质膜的伤害[11]。作为质膜保护系统的主要抗氧化酶,SOD是抵御活性氧伤害的第一道防线,它负责将O2-歧化成H2O2和O2,然后在通过POD和CAT将H2O2清除分解成H2O和O2,使活性氧对植物的伤害降低。张勇[12]等通过对木麻黄无性系水培苗抗盐性研究得出,在盐胁迫处理下,POD活性可作为评价木麻黄水培苗抗盐的主要形状指标。
本试验结果表明,在不同浓度NaCl胁迫处理下,两种木麻黄变异类型B1和R5叶片中的MDA含量明显增加,表明质膜系统受到了伤害,但抗氧化物酶活性也有相应的增强,说明植物体通过增加酶活性来清除活性氧,为质膜保护系统减免更多的损伤。B1的SOD活性较R5高,而R5的POD活性和CAT活性都比B1高,B1的MDA含量相较R5高,说明B1叶片细胞内O2-更多,比R5受到伤害更大。综合抗氧化物酶活性和MDA含量测定指标的分析得出,R5比B1更具抗盐性,这和张勇等的分析结果相符。
木麻黄在盐胁迫下生理指标表现出的特征,可能与高NaCl浓度产生水分胁迫造成木麻黄生理干旱而导致的伤害[13]。就目前的试验结果来看,变异类型R5的抗盐性更适宜进行优良基因的筛选,然而笔者只是从植物生理上做一些初步的探索,为木麻黄的优良变异类型筛选扩散提供一定的理论依据。对于更好的鉴定和筛选具有较强抗寒能力的变异类型或品种,还需要在细胞分子和基因水平上作进一步的研究和分析。
[1]叶功富,罗美娟,林金木.短枝木麻黄在福建东山试点的种源试验结果分析与选择[J].北京林业大学学报,2004,26(6):6-11.
[2]叶功富,王小云,卢昌义,等.闽南沿海木麻黄基干林带的防风效应[J].海峡科学,2008(10):77-79.
[3]郑金双.木麻黄逆境生理研究进展[J].亚热带植物科学,2006,35(2):70-73.
[4]陈建勋,王晓峰.植物生理学实验指导[M].华南理工大学出版社,2002.
[5]李合生.植物生理生化实验原理和技术[M].高等教育出版社,2000.
[6]曹淑华,查向东.超氧化物歧化酶研究综述[J].安徽农业科学,2003,31(4):599-601.
[7]马旭俊,朱大海.植物超氧化物歧化酶(SOD)的研究进展[J].遗传,2003,25(2):225-231.
[8]Shigeoka S, Ishikawa T, Tamoi M,et al.Regulation and function of ascorbate peroxidase isoenzymes[J].J Exper Bot, 2002, 53(372):1 305-1 319.
[9]余叔文,植物学,汤章城,等.植物生理与分子生物学[M].科学出版社,1998.
[10]林栖凤.耐盐植物研究[M].科学出版社,2004.
[11]杨淑慎,高俊凤.活性氧、自由基与植物的衰老[J].西北植物学报,2001,21(2):215-220.
[12]张勇,仲崇禄,姜清彬,等.木麻黄无性系水培苗抗盐性研究[J].林业科学研究,2008(1):91-95.
[13]叶功富,吴平阳,王珏新,等.木麻黄抗旱耐盐机理及其在防护林更新改造中的应用[J].防护林科技,2000(S1):142-147.

