针刺对脑缺血再灌注损伤大鼠外周血清IL-1β、IL-6表达的影响*
张亚敏,陈素辉,孙 华△,徐 虹,包 飞,王道海,高 扬
(1.中国医学科学院北京协和医学院北京协和医院,北京100730;2.北京协和医学院基础医学研究所,北京100005)
缺血性脑血管病属中医“中风”范畴。多年来,针刺治疗脑血管病取得了良好疗效。研究显示电针能促进脑缺血大鼠缺血区血管再生,增加脑血流量,减轻缺血区细胞凋亡[1-2];且能调节脑缺血再灌注区基质金属蛋白酶-9(MMP-9)及细胞间黏分子-1(ICAM-1)等炎症损伤相关细胞因子的表达,减轻缺血再灌注后的脑水肿和脑组织损伤[]。外周血是机体宏观调节信号的有效载体,通过检测外周血中相关信号的变化可以反映脑组织局部的炎症损伤程度及机体对局部损伤和损伤修复相关调节网络的变化。研究表明针刺百会和足三里穴能够影响脑缺血再灌注损伤大鼠外周血清蛋白的表达,干预其生理病理过程[4]。本研究通过酶联免疫吸附测定法(enzyme linked immunosorbent assay,ELISA)检测大鼠外周血清中白细胞介素1β(IL-1β)、白细胞介素6(IL-6)的表达,探讨针刺百会和足三里穴在脑缺血再灌注损伤炎症调节机制中的可能作用。
1 实验材料与方法
1.1 实验动物
健康雄性SD大鼠,清洁级,体重260~310 g,10~12周龄,中国药品生物制品检定所实验动物中心提供[实验动物证书:SCXK(京)2009-0017]。饲养条件:每笼5 只,光照:黑暗 =12 h∶12 h,室温(25 ±3)℃,湿度75%,自由进食和饮水。实验动物操作参照实验动物研究指南。
1.2 主要试剂和器材设备
2636-4A、2634-4A线栓(北京沙东生物技术公司);长城牌KWD-808Ⅱ全能脉冲电疗仪(常州市武进长城医疗器械有限公司);汉医牌一次性无菌针灸针(天津华鸿医材有限公司);全自动多功能酶标仪(美国Thermo公司);双抗体夹心IL-1β ELISA试剂盒,双抗体夹心IL-6 ELISA试剂盒(美国eBioscience公司);漩涡混合器(北京北德科学器材有限公司)。
1.3 模型制备和神经功能评分
模型制备参考Longa等[5]的线栓法。线栓插入2 h后拔出以实现再灌注,待大鼠苏醒对其行神经功能评分,判断造模是否成功。神经功能评分依据Bederson等[6]的5级分类法:0级:神经功能无缺损;1级:左前肢不能完全伸展;2级:左前肢屈曲,向左侧推动时阻力下降;3级:爬行时向左侧转圈;4级:意识不清,包括24 h内死亡。将0级和4级剔除实验。
1.4 实验分组与处理
将实验大鼠随机分为假手术组、模型组和针刺组3个大组,每大组按照缺血再灌注后时间分成12 h、24 h、48 h、72 h、96 h 和144 h共6 个亚组,每亚组8 只大鼠;另外设正常对照组8只。假手术组模拟手术损伤,分离至颈内、外动脉,不插入线栓,缝合,不治疗;模型组造模成功后不治疗;针刺组造模成功后,定位百会和足三里穴[7],消毒后进针,针柄连接脉冲电疗仪,疏密波,强度 2 mA,频率 2~100 Hz,日 1次,每次20 min;正常对照组作为空白对照,不施手术,不治疗。
1.5 IL -1β、IL -6 测定
各组大鼠按规定时间点用4%水合氯醛腹腔注射麻醉,心脏取血,室温静置 2 h,离心(3 500 rpm,20 min),分离血清,分装血清,存放于-80℃冰箱中备用。取备用血清用ELISA法测IL-1β、IL-6值,具体操作严格遵循试剂盒说明。
1.6 ELISA数据读取与分析
在酶标仪450 nm处测OD 值,对标准品的OD值及其相应的已知浓度,做相关分析。然后以OD值为横坐标,浓度为纵坐标,做一条标准曲线,并得出R2(相关系数)值和求解样品浓度的公式,计算样品浓度。本数据为计量资料,满足正态性和方差齐性,采用单因素方差分析(one-way ANOVA)对数据进行统计学分析,组间比较应用LSD-t检验,所有数据用均数±标准差(x¯±s)表示,P<0.05为差异具有显著性。
2 实验结果
2.1 各组大鼠外周血清IL-1β表达的变化
IL-1β在模型组呈双峰形表达,峰值时间分别为24 h和96 h。IL-1β在针刺组表达强度低于模型组,以24 h组和96 h组最显著(P<0.05);IL-1β在假手术组表达低于模型组,其中96 h组差异具有显著性(P<0.05)。见表1及图1。
表1 实验各组大鼠外周血清不同时间点IL-1β浓度值(±s)

表1 实验各组大鼠外周血清不同时间点IL-1β浓度值(±s)
注:与模型组比较,☆P <0.05;与假手术组比较,△P <0.05;与正常组比较,*P <0.05。
12 h 24 h 48 h 72 h 96 h 144 h针刺组 8 81.88 ±16.9* 60.50 ±18.01☆△* 95.78 ±30.21 72.01 ±24.40* 96.21 ±37.29☆ 90.05 ±36.87组别 n*模型组 8 75.76 ±13.6* 118.02 ±45.24 88.98 ±54.23* 84.85 ±49.61* 157.23 ±19.36△ 67.51 ±4.32*假手术组 8 83.56 ±20.00*105.45 ±43.83 95.83 ±31.15 94.16 ±11.85 63.81 ±22.00* 86.47 ±22.69*正常组 8 123.05 ±58.64 123.05 ±38.64 123.05 ±38.64 123.05 ±38.64 123.05 ±38.64 123.05 ±38.64
表2 实验各组大鼠外周血清不同时间点IL-6浓度值(±s)
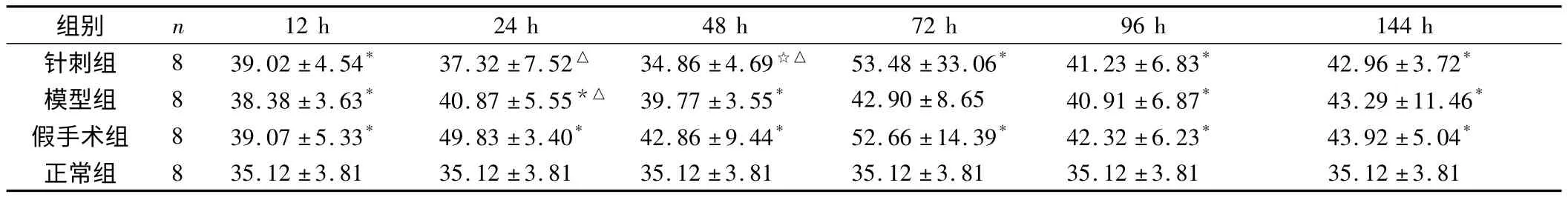
表2 实验各组大鼠外周血清不同时间点IL-6浓度值(±s)
注:与模型组比较,☆P <0.05;与假手术组比较,△P <0.05;与正常组比较,*P <0.05。
12 h 24 h 48 h 72 h 96 h 144 h针刺组 8 39.02 ±4.54* 37.32 ±7.52△ 34.86 ±4.69☆△ 53.48 ±33.06* 41.23 ±6.83* 42.96 ±3.72组别 n*模型组 8 38.38 ±3.63* 40.87 ±5.55*△ 39.77 ±3.55* 42.90 ±8.65 40.91 ±6.87* 43.29 ±11.46*假手术组 8 39.07 ±5.33* 49.83 ±3.40* 42.86 ±9.44* 52.66 ±14.39* 42.32 ±6.23* 43.92 ±5.04*正常组 8 35.12 ±3.81 35.12 ±3.81 35.12 ±3.81 35.12 ±3.81 35.12 ±3.81 35.12 ±3.81

图1 不同时间点各组大鼠外周血清IL-1β表达的变化

图2 不同时间点各组大鼠外周血清IL-6表达的变化
2.2 各组大鼠外周血清IL-6表达的变化
IL-6在模型组的表达高于正常组(P<0.05);IL-6在针刺组各时间点的表达低于模型组和假手术组,其中24 h和48 h组具有显著性差异(P<0.05)。IL-6在假手术组中呈双峰形表达,峰值时间在24 h和72 h,假手术组各个时间点IL-6的表达高于模型组,但除24 h组外,其余时间点无统计学意义(P>0.05)。见表2及图2。
3 讨论
缺血性脑卒中主要病机为脏腑阴阳失调,导致机体气血逆乱,上犯脑窍,脑络瘀阻而发病。根据中医经络理论,脑缺血后机体正气不足,属于积损正衰。百会穴属督脉,位于巅顶,“头者神之居”为“精明之府”,且督脉总督一身之阳,具有开窍醒神之功。足三里穴为足阳明胃经的合穴,阳明经多气多血,临床选穴有“治痿独取阳明”原则。两穴合用可疏经活络、扶正祛邪以调节机体阴阳平衡。根据导师多年的临床经验和实验总结,发现针刺百会和足三里穴在治疗神经系统及免疫系统疾病等方面优势显著。
IL-1β在正常脑组织中低表达,脑缺血再灌注损伤后,由局部浸润的单核-巨噬细胞、活化的星形胶质细胞和少突胶质细胞等分泌,可促进内皮细胞增殖并表达粘附分子,募集白细胞,刺激单核-巨噬细胞产生TNF -a、IL-6等细胞因子,加重局部炎症反应[8]。还可通过上调基质金属蛋白酶表达水平破坏血脑屏障[9],进而使中枢脑组织的炎症反应信号通过血液传递至外周,活化外周免疫系统中的炎性细胞;同时可募集外周炎性细胞至中枢损伤脑区,参与中枢损伤及损伤修复过程。脑缺血再灌注后24 h,外周血炎性细胞因子(如IL-1β、IL-6)大量表达于粘附分子和趋化因子等可募集炎症细胞,移行至缺血损伤区,进一步破坏血脑屏障,加重局部神经元坏死,扩大炎症反应[10]。
IL-6在脑缺血急性期是重要的炎症介质,可导致脑炎性损伤,但在脑缺血亚急性期IL-6通过连同白血病抑制因子(leukemia inhibitory factor,LIF)及睫状神经营养因子(ciliary neurotrophic factor,CNTF)等发挥神经保护作用[11]。且外周血中的IL-6水平是反应脑缺血损伤早期的灵敏性指标,研究[12]显示,MCAO模型中IL-6在外周血2 h即开始上升,早于脑组织开始上升时间(24 h)。
本研究显示,脑缺血再灌注损伤后,模型组大鼠外周血清中的IL-1β在缺血再灌注24 h后出现第1个峰值,该峰值信号一般反映炎症的损伤程度,96 h达到第2个峰值,由于中后期峰值的表达通常由早期的损伤信号和中后期的损伤修复信号叠加形成,故后者强度高于前者。本实验中,假手术组大鼠外周血清的IL-6表达高于模型组,国外研究[]中亦发现有相似结果。脑缺血再灌注模型是一种高强度的病理性应激反应,损伤应激程度高于假手术组,考虑是模型组释放的儿茶酚胺类和糖皮质激素等应激激素较假手术组多,而这些激素可抑制免疫系统的应答活化,减少免疫细胞因子的表达,故模型组的IL-6表达水平低于假手术组。实验中正常组大鼠外周血清IL-1β表达较模型组高,尚未找到有关证据支持,考虑外周血影响因素较多,这种情况可能由于实验误差导致,有待进一步探讨。
本研究观察到,脑缺血再灌注早期,针刺组大鼠外周血清炎性细胞因子IL-1β、IL-6的表达低于未经干预的脑缺血模型组;脑缺血中后期,随着炎症损伤反应的抑制,针刺组大鼠外周血清中的IL-1β表达强度低于模型组,而IL-6表达上升,提示针刺百会、足三里穴在脑缺血损伤早期可能通过下调外周血清IL-1β、IL-6的表达抑制炎症反应,脑缺血损伤中后期可能通过上调IL-6的表达促进脑组织的损伤修复,发挥脑保护作用。
[1]Wang Q,Li X,Chen Y,et al.Activation of epsilon protein kinase C -mediated anti-apoptosis is involved in rapid tolerance induced by electroacupuncture pretreatment through cannabinoid receptor type 1[J].Stroke,2011,42(2):389 -396
[2]Du Y,Shi L,Li J,et al.Angiogenesis and improved cerebral blood flow in the ischemic boundary area were detected after electroacupuncture treatment to rats with ischemic stroke[J].Neurol Res,2011,33(1):101-107
[3]徐虹,洪礼传,黄艳秋,等.针刺对脑缺血再灌注模型大鼠脑组织基质金属蛋白酶、细胞间黏附分子表达的影响[J].基础医学与临床,2010,30(7):731 -736
[4]陈素辉,孙华,徐虹,等.针刺干预对脑缺血再灌注损伤大鼠外周血清蛋白表达的影响[J].针灸临床杂志,2011,27(9):50-53
[5]Longa E Z,Weinstein P R,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91
[6]Bederson J B,Pitts L H,Tsuji M,et al.Rat middle cerebral artery occlusion:evaluation of the model and development of a neurologic examination[J].Stroke,1986,17(3):472 - 476
[7]李忠仁.实验针灸学[M]北京:中国中医药出版社,2007:255
[8]Allan S M,Tyrrell P J,Rothwell N J.Interleukin -1 and neuronal injury[J].Nat Rev Immunol,2005,5(8):629 -640
[9]Pera J,Zawadzka M,Kaminska B,et al.Influence of chemical and ischemic preconditioning on cytokine expression after focal brain ischemia[J].J Neurosci Res,2004,78(1):132 -140
[10]Denes A,Thornton P,Rothwell N J,et al.Inflammation and brain injury:acute cerebral ischaemia,peripheral and central inflammation[J].Brain Behav Immun,2010,24(5):708 - 723
[11]Suzuki S,Tanaka K,Suzuki N.Ambivalent aspects of interleukin -6 in cerebral ischemia:inflammatory versus neurotrophic aspects[J].J Cereb Blood Flow Metab,2009,29(3):464 -479
[12]Chapman K Z,Dale V Q,Denes A,et al.A rapid and transient peripheral inflammatory response precedes brain inflammation after experimental stroke[J].J Cereb Blood Flow Metab,2009,29(11):1764-1768
[13]Jeong S,Kim S J,Jeong C,et al.Neuroprotective effects of remifentanil against transient focal cerebral ischemia in rats[J].J Neurosurg Anesthesiol,2012,24(1):51 -57

