温度调控诱导尼罗罗非鱼仔鱼雄性化的研究*
陈兴汉,刘晓春,蒙子宁,张 勇,叶 卫,林浩然
(1.中山大学生命科学学院,广东广州 510275;2.阳江职业技术学院生命科学与技术系,广东阳江 529566;3.番禺国家级罗非鱼良种场,广东广州 511453)
罗非鱼属鲈形目Perciformes;鲈形亚目Percoidei;丽鱼科Cichidae;罗非鱼属Oreochromis。具有肉味鲜美、生长快、病害少、养殖成本低以及适合淡水和海水养殖等许多优点,养殖地区已遍布世界各地。近年来中国罗非鱼产量稳居世界第一位、也是世界上最大的罗非鱼出口国、居我国水产品出口总量第3位[1]。随着养殖业的发展,罗非鱼显露出了作为产业化养殖和世界大宗贸易对象的潜力[2]。联合国粮农组织将罗非鱼作为“有希望的养殖鱼”加以推广,被称为“21世纪之鱼”[3]。但在罗非鱼的养殖推广中最突出的限制性因素是“繁殖过度”,其性成熟早、一个养殖季节可自行繁殖好几代,致使商品鱼品质偏低、资源浪费严重。同时罗非鱼是雄性优势生长种类,雄鱼比雌鱼生长快40% ~50%[4]。因此,采用单雄性养殖是解决“繁殖过度”的关键。其技术难题是“如何通过性别控制手段以获得雄性化鱼苗”。近年来,在尼罗罗非鱼中应用较广泛的是通过雄激素饲料拌喂的方式,这样虽可以得到雄性率较高的鱼苗,但激素的滥用严重危害了生态环境,且激素在鱼肉中有一定残留、人类直接或间接食用后身体健康会受到影响。通过温度调控的手段所得雄性化鱼苗就不会产生这些危害。目前,关于温度对罗非鱼雄性率的影响只有少数几位国外学者作过研究[5-6],但国内学者还没有报道,生产上更是没有应用。
罗非鱼性别决定系统复杂,除了性染色体,常染色体也参与性别决定;此外环境因素,如外源激素和温度等也可影响其性别决定。温度影响性别决定的现象称之为温度依赖型性别决定 (TSD,Temperature-dependent sex determination),且温度的影响只在某一特定阶段起作用,称之为温度敏感期(TSP,Temperature sensitive period)。在水产动物中,普遍存在着 TSD 的现象,Choo[7]和聂刘旺[8]研究表明中华鳖的性别决定属于TSD类型。
Conover和Heins[9]发现月银汉鱼在低温条件下子代雌性偏多。Carlosa等[10]研究了两种银汉鱼Odontesthes bonariensis和 Patagonina hatchery,发现O.bonariensis仔鱼在13~19℃为100%雌鱼,25℃则29.4%为雌鱼,27℃时则只有10%为雌鱼,29℃则为100%雄鱼;P.hatchery在13℃和15℃时雌鱼分别占88.9%和89.5%,17~23℃之间雌鱼占50%;25℃雌鱼为30.8%。罗非鱼,包括尼罗罗非鱼、莫桑比克罗非鱼和奥利亚罗非鱼都有TSD的现象[5-6]。尼罗罗非鱼和奥利亚罗非鱼在高温(34~37℃)时雄性率较高,而莫桑比克罗非鱼则在低温 (19~20℃)时雄鱼比例偏高。Baroiller等[11]在尼罗罗非鱼温度敏感期 (不晚于受精后13 d)以36℃高温处理鱼持续10 d,雄性比例由53%增加到81%,在27℃下雌雄比例为1∶1,34℃下雄性比例不明显增加。
本实验研究了尼罗罗非鱼仔鱼在温度调控诱导下的雄性率,以及相应的增质量率和存活率。其主要意义在于:经过试验研究,确立了一种新的通过“温度调控”手段诱导尼罗罗非鱼仔鱼雄性化的技术方案,这在国内尚未见报道,较之前常用的激素投喂技术更环保、安全、高效。并且通过“温度调控”诱导雄性化的效果是理想的,在雄性率高的同时、生长率和成活率也不受影响,从而保证了这项技术可以在生产上推广应用。
1 材料与方法
1.1 实验材料
尼罗罗非鱼仔鱼取样于广东省国家级罗非鱼良种场 (番禺)。选取健壮、无病,鱼体色发红,卵粒圆大、发亮、金黄的雌鱼作为母本;同时选择健壮,无病,可挤出白色精液的雄鱼作为父本。1雌1雄配养于约4 m×1.5 m×1.2 m(长×宽×深)的水泥池中。投喂普通罗非鱼成鱼饲料,保持微流水。待卵成熟后,雌鱼自行产卵受精,把卵含在口中进行口腔孵化。在孵出前1~3 d,把卵从亲鱼口腔中取出。在孵化装置中孵化。待仔鱼全部孵出后,饲养于约40 cm×25 cm×25 cm(长×宽×高)的白色塑料箱中。待仔鱼生长到出膜后第7天 (DPH,Days Post Hactching),再分组进行试验。所有的鱼池、用品都做好常规消毒备用。
1.2 实验方法
1.2.1 实验设计 尼罗罗非鱼仔鱼在自然水温(26~30℃)条件下,生殖嵴形成于7 DPH左右,此时性腺尚未开始分化、处于温度敏感期开始阶段,故控温处理从7 DPH开始。实验时温度设置为3个,分别为20、28、36℃ (±0.5℃);控温时段也为3个,分别为7-14 DPH、7-21 DPH、7-28 DPH。进行正交试验[12],略修正;设置两个平行组、另设两个自然水温对照组 (Ctr),每组实验用鱼80尾。
1.2.2 饲养方法 控温处理实验在室内进行,实验用房约50 m2,需两台2 P功率的空调,以保证室温能降至20℃。选取40 cm×25 cm×25 cm(长×宽×高)的塑料箱作为饲养箱;每个温度梯度用3个箱,两个作为平行组,剩下一个装有同样温度的水,以作换水备用;每个箱里装一只250~300 W的恒温调节加热器 (RTR 250/300,SICCE)和一支温度计,水温浮动范围为±0.5℃;另每个箱装一个充气石,以保证溶氧和水温均匀。待7 DPH时分组进行实验。每天虹吸箱底两次、早晚各一次;期间,每天换水一次,每次换水量为1/3。控温实验结束后把鱼饲养于50 cm×50 cm×50 cm的网箱中,网箱悬挂于水泥池中,保持微流水,每天清洗网箱一次。每天投喂鳗鱼饲料3次,采取过量投喂法[13],以避免因抢食引起的个体生长分化。一直把鱼饲养到可以压片检测性腺雌雄为止,一般为期60 d。
1.2.3 体质量测量和性腺检测 分别于7、14、21、28和60 DPH称量体质量,每个平行组随机取15尾鱼,快速用吸水纸吸干体表水分、放于滤纸上称量,然后放回原实验组继续饲养。60 DPH体质量采用百分之一电子天平 (SETRA,BL-2000)、精确到0.1 g;其它都采用万分之一分析天平 (SETRA,BL-200S)、精确到0.1 mg。
待鱼性腺生长发育到可通过压片分辨雌雄时(60 DPH),人工解剖取性腺,解剖前向鱼体腔注射约1 mL的体积分数为5%的醋酸溶液,使性腺显白色,以利于取出性腺。性腺取出后,滴少许铁醋酸洋红进行染色,压片后在ZEISS显微镜下观察判断雌雄。雌鱼性腺表面可见清晰卵粒 (图1);雄鱼性腺表面无清晰细胞间隔 (图2)。如压片不能清楚分辨雌雄时,揭开盖玻片,滴少许结晶紫溶液,如果是雌性,则可见明显卵细胞;无卵细胞样的则为雄性。


1.3 数据分析
采用 Excel2003进行数据整理,并运用SPSS18.0版本进行差异显著性分析。用卡方 (х2)检验[14]比较各组的存活率、雄性率的差异,进行多重比较时,为了降低Ⅰ类误差,需对比较平准进行校正,校正的比较平准为α'=α/比较次数。用Duncan氏检验[14]比较体质量和绝对增质量率的差异。绝对增质量率按下式计算:
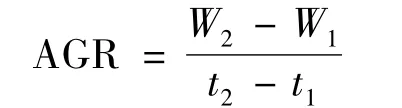
式中:W1,初始体质量;W2,终末体质量;t1,控温结束时间;t2,60 DPH。
2 结果
2.1 温度调控诱导雄性化
由各控温时段、各温度条件下雄性率的两两比较 (图3)可知:当温度为36℃时,3个控温时段7-14 DPH、7-21 DPH、7-28 DPH的雄性率较其它各组的雄性率显著提高、与对照组有显著差异 (P<0.05),分别高达 93.85%、96.00%、96.92%;这3个组之间的雄性率没有显著差异(P>0.05)。其它各组两两比较没有显著差异、与对照组均没有显著差异 (P>0.05)。
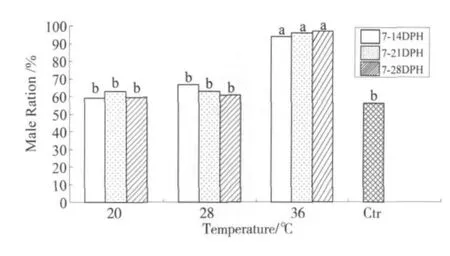
图3 3种温度条件下、不同处理时段雄性率的比较Fig.3 The male ratio of the different diposal groups at three different temperature
2.2 控温对增质量率的影响
由控温时段结束至60 DPH的终末体质量组内组间比较、绝对增质量率的组内比较 (表1)可知,初始体质量大小排序为:Ctr>28℃ >36℃ >20℃,组内两两比较有显著差异 (P<0.05)。60 DPH时,终末体质量的组内、组间比较结果如下:当控温时段为7-14 DPH时,28℃的终末体质量和对照组没有显著差异 (P>0.05)、36℃与28℃的终末体质量没有显著差异 (P>0.05)、20℃与36℃的终末体质量也没有显著差异 (P>0.05);其它各组的终末体质量都有显著差异 (P<0.05)。
控温时段结束至60 DPH的绝对增质量率组内比较结果如下:当控温时段为7-14 DPH时,28℃、36℃的绝对增质量率与对照组没有显著差异(P>0.05),20℃与36℃的绝对增质量率没有显著差异 (P>0.05);其它各组绝对增质量率组内比较都有显著差异 (P<0.05)。
2.3 控温对存活率的影响
由各控温时段、各温度条件下存活率的两两比较 (图4)可知:当处理组合 (温度+控温时段)为(20℃+7-21 DPH)和(20℃+7-28 DPH)时,成活率较其它各组显著降低、与对照组有显著差异 (P<0.05),分别和其它各组都有显著差异(P<0.05),这两组之间没有显著差异 (P>0.05);其它各组的存活率比较没有显著差异、与对照组也没有显著差异 (P>0.05)。
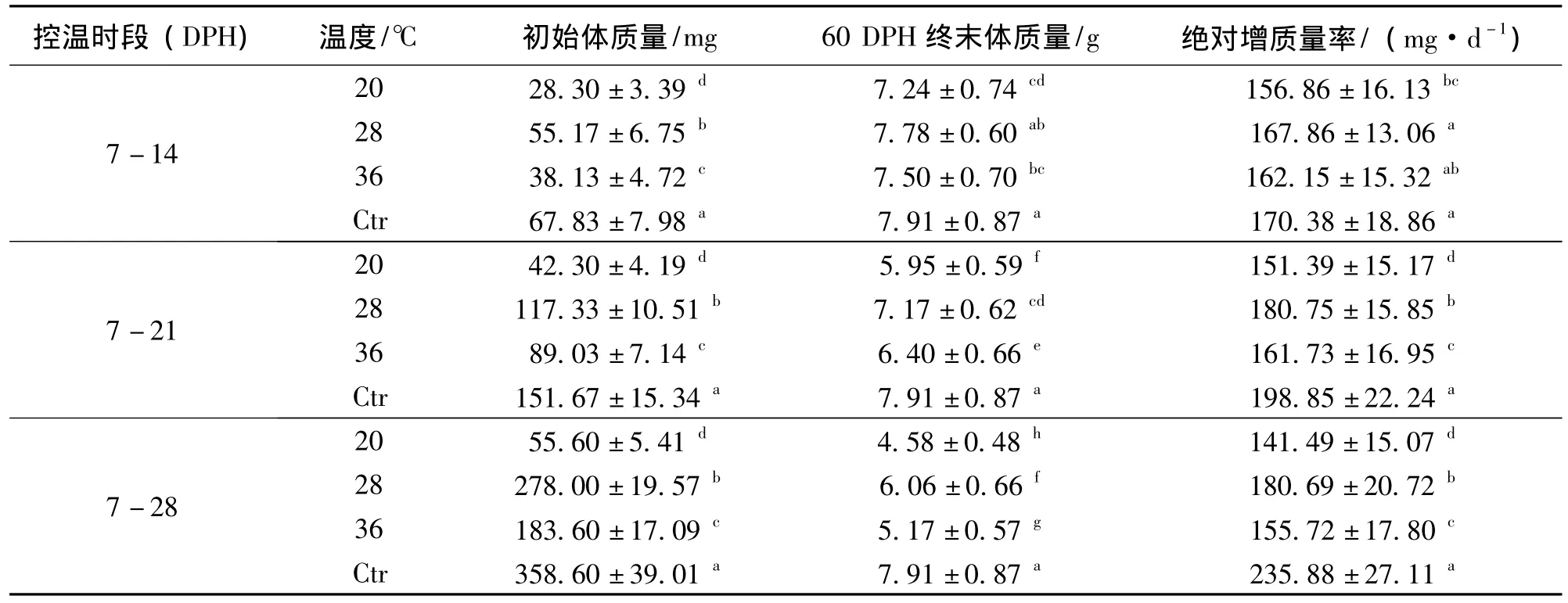
表1 控温时段结束至60DPH,终末体质量的组内组间比较、绝对增质量率的组内比较1)Table 1 The comparison of end weight and AGR from the time of end processing to 60DPH at different water temperature
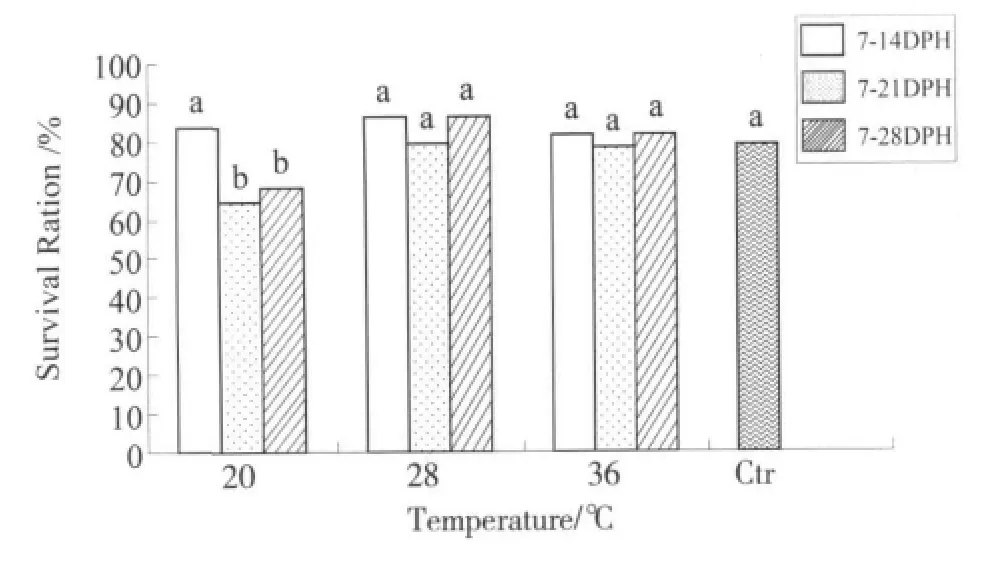
图4 3种温度条件下、不同处理时段成活率的比较Fig.4 The survival ratio of the different diposal groups at three different temperature
3 讨论
3.1 温度调控诱导雄性化
本研究中,当温度为36℃时,3种控温时段7-14 DPH、7-21 DPH、7-28 DPH的雄性率显著增高、分别高达93.85%、96.00%、96.92%,这3组之间雄性率没有显著差异。这可以说明3个方面的问题:①温度为36℃时,可以显著提高雄性率;②3种处理持续时间 (7、14、21 d)长短的不同对雄性率无显著影响;③3种控温时段 (7-14 DPH、7-21 DPH、7-28 DPH)均可显著提高雄性率、且无显著差异,据此可判断温度敏感期在7-14 DPH这段时间内。在爬行动物中温度敏感期和激素敏感期大致平行[15-17]。根据我们之前的研究结果,尼罗罗非鱼温度敏感期和激素敏感期也基本平行[18]。这应该与特定条件下温度和激素有着共同的生理途径有关。
Baroiller[11]在尼罗罗非鱼温度敏感期 (不晚于受精后13 d)以36℃处理10 d,雄性率由53%增加到81%。本研究所采用温度与之相同、都为36℃,处理持续时间也基本吻合。从诱导雄性化效果来看,本研究中雄性率更高。雄性率的差异可能是由于控温处理开始时间有所不同引起的,控温处理开始时间不同、温度敏感性就会有所差异。温度敏感性的差异可能是由TSD性别决定机制来决定的。TSD性别决定的机制十分复杂,至今在学术界还没有统一答案,大致机制可能如此:温度会影响某些性别决定基因的表达或活性,或者改变了某些基因表达产物的构象、抑或作为修饰剂改变分子的空间构型,这些产物作为关键时期雄性决定因子 (Male Determine Factor,MDF)积累到一定水平时,就朝雄性方向发展、否则就发育为雌性。
Ewert和Nelson[17]将TSD总结为3种类型:在低温下产生雄性,在高温下产生雌性、即MF模式;在低温下产生雌性,在高温下产生雄性、即FM模式;在低温和高温下均产生雌性,在中间温度下产生雄性、即FMF模式。根据本文结果,尼罗罗非鱼在低温 (20℃、28℃)时雄性比例不明显增加、在高温 (36℃)时雄性率显著升高,据此可判定尼罗罗非鱼TSD类型为FM模式。
3.2 控温对增质量率的影响
为了综合评价各处理组合 (温度+控温时段)诱导雄性化的效果,本实验除了研究雄性率外、还同步研究了相应的增质量率和存活率。温度对增质量率的影响方面:从初始体质量比较来看,增质量率的排序为Ctr>28℃ >36℃ >20℃。这说明恒定水温并不利于生长,推测是由于在恒定水温环境中,鱼体的生理效能不能发挥到最大、机体调节能力也受限所致。
从控温时段结束至60 DPH(控温状态消除、自然水温生长)这段时间的绝对增质量率与自然水温 (26~30℃)对照组比较来看,只有当控温时段为7-14 DPH时、36℃的绝对增质量率与对照组没有显著差异,这说明短时间 (7-14 DPH)的恒定高温 (36℃)处理对后续生长没有显著影响,但长时间 (7-21 DPH、7-28 DPH)恒定高温 (36℃)处理对后续生长速度会有一定影响。因此,在高温 (36℃)诱导雄性化的处理中,在保证雄性率的前提下,应在尽量短的时间内完成。
另外需要说明的是,尼罗罗非鱼存在雄性优势生长的现象。3种控温时段 (7-14 DPH、7-21 DPH、7-28 DPH)、36℃下雄性率较高,理论上绝对增质量率应比对照组高,但实际并非如此,这可能存在两个方面的原因:一是由于初始体质量不同、生长率有所差异,初始体质量大的增质量率要快些;二是在60 DPH前体质量还相对偏小、还不足以体现出雌雄增质量速度的差异。
3.3 控温对存活率的影响
温度对成活率的影响方面:在鱼虾类中只有一些零星的报道,在幼体中的报道更少,施兆鸿等[19]指出了锯缘青蟹幼体成活与温度的关系:相对高温会使水中的溶氧含量下降,NH3含量上升,或者高温导致胚胎发育不完全、病害增多、代谢加快等,从而导致幼体死亡。本研究中高温 (36℃)对成活率没有明显影响、从而保证了控温诱导雄性化时的成活率。这应该与尼罗罗非鱼对高温和氨氮的耐受能力较强有关。我们之前的研究表明,从1 DPH-35 DPH高温处理尼罗罗非鱼仔鱼成活率显著降低[18]。而本实验是从7 DPH开始的,从这两种结果的差异,可以推测高温引起死亡率升高可能是发生在个体发育早期 (卵黄囊完全吸收以前),此时的仔鱼还没有转化为外源性营养,对高温环境的耐受力较弱。
本研究中,长时间 (7-21 DPH、7-28 DPH)的低温 (20℃)处理能引起死亡率升高,这可能是由于罗非鱼属温水性鱼类、不能耐受低温,仔鱼对低温的耐受能力更弱,长时间低温使其产生了应激反应。
4 结论
当控温时段为7-14 DPH、温度为36℃(±0.5℃)时。此时平均雄性率93.85%、最高能达到96.96 %;存活率与对照组无显著差异;控温状态消除后、在自然水温条件下的增质量率也不受影响。因此综合比较来看,控温诱导尼罗罗非鱼仔鱼雄性化的最优处理组合 (温度+控温时段)为(36℃ +7-14 DPH)。
[1]王斌.中国罗非鱼出口贸易国际竞争力研究[D].南京:江南大学,2011.
[2]李思发.我国罗非鱼养殖业世纪展望[J].中国水产,2000(1):15-20.
[3]戈贤平,刘柱军,宋迁红.淡水优质鱼类养殖大全[M].北京:中国农业出版社,2005:415-436.
[4]夏德全.中国罗非鱼养殖现状及发展前景[J].科学养鱼,2000,5:1-2.
[5]ABUCAY J S,MAIR G C,SKIBINSKI D O F,et al.Environmental sex-determination:the effect of temperature and salinity on sex ratio in Oreochromis niloticus L.[J].Aquculture,1999,173:219-234.
[6]MAIR G C,BEARDMORE J A,SKIBINSKI D O F.Experimental evidence for envionmental sex-determination in Oreochromis spp[C]//HIRANO R,HANYU I.Proceedings of the Second Asian Fisheries Forum.Tokyo,Japan,1990:555-558.
[7]CHOO B L,CHOU L M,Does incubation temperature influeuce the sex of embryos in Trionyx sinensis[J].J Herpetol,1985,26(3):341 -342.
[8]聂刘旺,郭超文,汪鸣,等.中华鳖的性别决定机制[J].应用与环境生物学报,2001,7(3):258-261.
[9]CONOVER D O,HEINS W.Adaptive variation in environmental andgenetic sex determination in a fish[J].Nature,1987,326:496 -498.
[10]CARLOSA S,TSUYOSHI S,MEISEI U,et al.Thermal thresholds and critical period of thermolabile sexmination in two atherinid fishes,Odontesthes bonariensis and Patagonina hatchery[J].J Exp Zool,1997,278:167 -177.
[11]童一中.生物统计法[M].长沙:湖南科技出版社,1986:450-478.
[12]王 岩.食物水平和初始体重对杂交罗非鱼生长和个体生长分化的影响[J].应用生态学报,2003,14(2):237-240.
[13]李春善,王志和,王文林.生物统计学[M].2版.北京:科技出版社,2000:71-80.
[14]焦保卫,王德寿,邓思平.爬行动物温度依赖性性别决定研究进展[J].动物学杂志,2002,37(4):74-78.
[15]WIBBLES T,BULL J J,CREWS D.Synergism between temperature and estradiol:a common pathway in turtle sex determination[J].J Exp Zool,1991,260:371 -381.
[16]GUTZKE W H N,CREWS D.Embryonic temperature determination adult sexuality in a reptile[J].Nature,1988,332:832-834.
[17]EWERT M A,NELSON C E.Sex determination in turtle:diversepatterns and some possible adaptive values[J].Zoology,1991,270:3-15.
[18]陈兴汉.尼罗罗非鱼仔鱼生长发育和温度调控与雄激素诱导雄性化的研究[D].广州:中山大学,2005.
[19]施兆鸿,夏连军,王建钢.影响锯缘青蟹幼体成活的几个因素[J].海洋渔业,2004,4(26):281-285.

