香榧体细胞胚发生的初步研究
姚 进,黄坚钦,胡恒康,裘林艳,朱旻华,张启香
(1.浙江农林大学 亚热带森林培育国家重点实验室培育基地,浙江 临安311300;2.上海园林绿化建设有限公司,上海 200333;3.浙江农林大学 林业与生物技术学院,浙江 临安 311300)
香榧Torreya grandis‘Merrillii’是实生榧树Torreya grandis的优良变异类型或优株经人工嫁接繁殖而成的的优良品种[1],为中国特有的珍稀干果树种,经济寿命长,栽培效益高,具有巨大的发展潜力[2]。长期以来,香榧的繁殖主要通过嫁接等方法进行,繁殖技术落后,繁殖系数低,严重制约了香榧的大规模栽培,因此,开展香榧离体快繁技术的研究对推动香榧产业摆脱发展瓶颈,提升产业规模具有重要意义。关于香榧离体快繁的研究仅国内有报道,至今尚未建立高效、稳定的再生体系。2004年姜新兵等[3]首次报道了香榧体细胞胚胎发生的研究,但仅停留在体胚的增殖阶段;刘海琳等[4]以香榧茎段为外值体,通过器官发生途径,获得了再生植株;金航标等[5]对香榧腋芽组培及嫩枝嫁接技术进行了初步研究。本试验以香榧胚为外植体,研究了基本培养基、复合添加物、碳源和植物生长调节物质对香榧胚性愈合组织(callus)诱导的影响,筛选出胚性愈合组织诱导与增殖的适宜培养条件,初步进行了体细胞胚的诱导与萌发试验,为进一步建立高效、稳定的香榧体胚发生和遗传转化体系奠定基础。
1 材料与方法
1.1 供试材料与外植体处理
香榧种子(图1-1)采自浙江省富阳市洞桥镇55年生香榧树上,去除假种皮后,用洗涤剂漂洗干净,自来水冲洗3~4 h。超净工作台上用体积分数为75%乙醇表面灭菌3 min,无菌水冲洗3~4次,稀释10倍的次氯酸钠溶液(50 mL加1滴吐温)真空抽滤20 min,无菌水冲洗5~6次。表面灭菌后的种子用剪刀剪去外种皮,显微镜下剥取完整胚(胚处于早期心形胚阶段,图1-2),接入相应培养基。
1.2 愈合组织诱导
1.2.1 基本培养基和复合添加物 在基本培养基 MS(Murashige-Skoog)[6],SH(Schenk and Hildebrandt)[7]和 B5(Gamborg 等)[8]中分别添加不同种类复合添加物谷氨酰胺(Gln),水解酪蛋白(CH)和肌醇,各 500 mg°L-1,并设置基本培养基空白对照,共12个处理。各个处理均附加0.10 mg°L-16-苄氨基腺嘌呤(6-BA),0.50 mg°L-12,4-二氯苯氧乙酸(2,4-D),30 g°L-1蔗糖,9.5 g°L-1琼脂,pH 5.7,暗培养。接种幼胚20个°处理-1,重复 3 次。
1.2.2 碳源及其质量浓度 研究不同质量浓度(20,30,45 g°L-1)葡萄糖、蔗糖和麦芽糖组成的9个处理对香榧愈合组织形成的影响。基本培养条件为 SH+0.10 mg°L-16-BA+0.50 mg°L-12,4-D+9.5 g°L-1琼脂,pH 5.7,暗培养。接种20个胚°处理-1,重复3次。
1.2.3 植物生长调节物质 研究不同质量浓度6-BA(0,0.10,0.50,1.00 mg°L-1),细胞激动素KT (0,0.10,0.50,1.00 mg°L-1),2,4-D(0,0.10,0.50,1.00,2.00 mg°L-1)组合以及 6-BA(0,0.10,0.50,1.00 mg°L-1),KT(0,0.10,0.50,1.00 mg°L-1),NAA(0.10,0.50,1.00,2.00 mg°L-1)组合,共 32 个处理对香榧愈合组织形成的影响。基本培养条件为SH+30 g°L-1蔗糖+9.5 g°L-1琼脂,pH 5.7,暗培养。接20个胚°处理-1,重复3次。

图1 香榧体细胞胚的诱导与萌发Figure 1 Somatic embryogenesis of Torreya grandis ‘Merrillii’
1.3 胚性愈合组织形成和增殖
选择生长势基本一致的愈合组织转入到较佳的胚性愈合组织诱导培养基,植物生长调节物质减少为1/2,4周继代1次。胚性愈合的增殖试验中,先将胚性愈合组织在待试验处理中培养4周,统计第2次继代的增殖情况,30管°处理-1,重复3次。
1.4 体细胞胚的诱导与萌发
以SH为基本培养基,添加ABA和PEG 6000,初步进行了体细胞胚的诱导试验,获得的体胚在1/2SH基本培养基上萌发。
1.5 数据统计分析
胚接种4周,在体视显微镜下观察其生长状况,统计各个处理的愈合组织形成率和褐化率。胚性愈合组织增殖试验接入4周后称量;接入的胚性愈合组织质量为G0=G2-G1,增殖4周的胚性愈合组织质量为G3=G5-G4;式中G1为培养基与试管的质量,G2为接入胚性愈合组织后试管的质量。G5为增殖后胚性愈合与试管的质量,G4为取出胚性愈合后的试管质量。实验数据采用SigmaPlot 8.0和SPSS 17.0软件进行统计分析,Duncan氏新复极差检验法进行多重比较。
愈合组织形成率(%)=(各个处理中形成愈合组织的外植体总数/各个处理中未污染的外植体总数)×100%;褐化率(%)=(各个处理褐化的外植体总数/各个处理中未污染的外植体总数)×100%;胚性愈合组织增殖倍数=G3/G0。
2 结果与分析
2.1 愈合组织诱导
2.1.1 基本培养基和复合添加物对愈合组织形成的影响 香榧胚接种到相应培养基上,大部分脱分化形成愈合组织或萌发产生子叶肥厚的畸形苗,少数胚褐化。幼胚一般2周左右开始膨大(图1-3),4周左右可见明显的愈合组织。显微镜下观察发现:诱导的愈合组织大致可分为2类:水渍状愈合组织和疏松状愈合组织。方差分析和多重比较结果(图2)表明:不同处理中外植体愈合组织形成率和褐化率存在显著性差异(P<0.05)。基本培养基对愈合组织形成率的影响大于复合添加物。SH,MS和B5等3组试验中,平均褐化率依次为MS>B5>SH,平均愈合组织形成率依次为SH>MS>B5。试验的12个处理中,SH+Gln的愈合形成率最高,为50.8%。在SH和MS中添加500 mg°L-1Gln,有利于降低褐化率,提高愈合组织形成率,但形成的愈合组织多呈水渍状,增殖速度慢且容易褐化。SH+肌醇和SH+CH处理的愈合组织形成率虽略低于SH对照处理,但其诱导的疏松愈合组织比例高,生长势旺盛。
2.1.2 不同碳源对愈合组织形成的影响 不同碳源种类和质量浓度对香榧愈合组织形成的影响(图3)存在显著差异 (P<0.05)。添加蔗糖组的形成率明显高于葡萄糖组和麦芽糖组,蔗糖组和麦芽糖组产生的愈合组织多为金黄色疏松,偶有乳白色愈合组织,葡萄糖组水渍状愈合组织比例较高。3种碳源不同质量浓度间的愈合组织形成率,随着质量浓度的升高而降低,当蔗糖的质量浓度为20 g°L-1时愈合形成率最高,达51.3%;质量浓度为30 g°L-1,愈合组织形成率为47.5%,可能由于碳源量充足,愈合组织生长量比 20 g°L-1高。
2.1.3 植物生长调节物质对愈合诱导的影响 以SH为基本培养基,6-BA,KT,2,4-D等3种植物生长调节物质不同质量浓度配比均能诱导形成愈合组织。方差分析与多重比较结果(表1)显示:各处理的愈合组织形成率和褐化率差异性显著(P<0.05)。培养基中不添加6-BA时,随着2,4-D浓度的升高,愈合组织诱导率逐渐下降,疏松愈合组织数也依次减少,0.10 mg°L-12,4-D的愈合组织诱导效果最好,诱导率为52.1%。当2,4-D为0.50 mg°L-1,愈合组织诱导率随BA质量浓度的升高而下降。添加1.00 mg°L-1的KT,能降低褐化率。从表1和表2的结果来看,以SH为基本培养基,单独添加低质量浓度的NAA或 2,4-D对愈合组织形成有促进作用,低质量浓度的NAA比低质量浓度的2,4-D效果好。表3中6-BA,KT和NAA不同质量浓度水平的愈合组织诱导率和褐化率差异性显著(P<0.05)。随着6-BA质量浓度的升高平均愈合组织诱导率逐渐降低,培养基中不添加6-BA时,愈合组织平均诱导率最高。0.10 mg°L-1NAA处理的诱导率最高,为60.1%,且大部分愈合呈疏松状。4组6-BA处理的外植体褐化率随着KT质量浓度的升高呈先升高后降低趋势,在6-BA为0.10 mg°L-1,并添加0.10 mg-L-1KT和0.10 mg°L-1NAA的培养基上,褐化率最低,仅为2.4%。试验中还发现当6-BA和NAA质量浓度均较高时,幼胚多萌发产生子叶肥厚的畸形苗。

图2 基本培养基和复合添加物对香榧愈合组织形成的影响Figure 2 Effect of basal media and composite additives on callus formation of Torreya grandis ‘Merrillii’

图3 不同碳源对香榧愈合组织形成的影响Figure 3 Effect of carbon sources on callus formation of Torreya grandis ‘Merrillii’
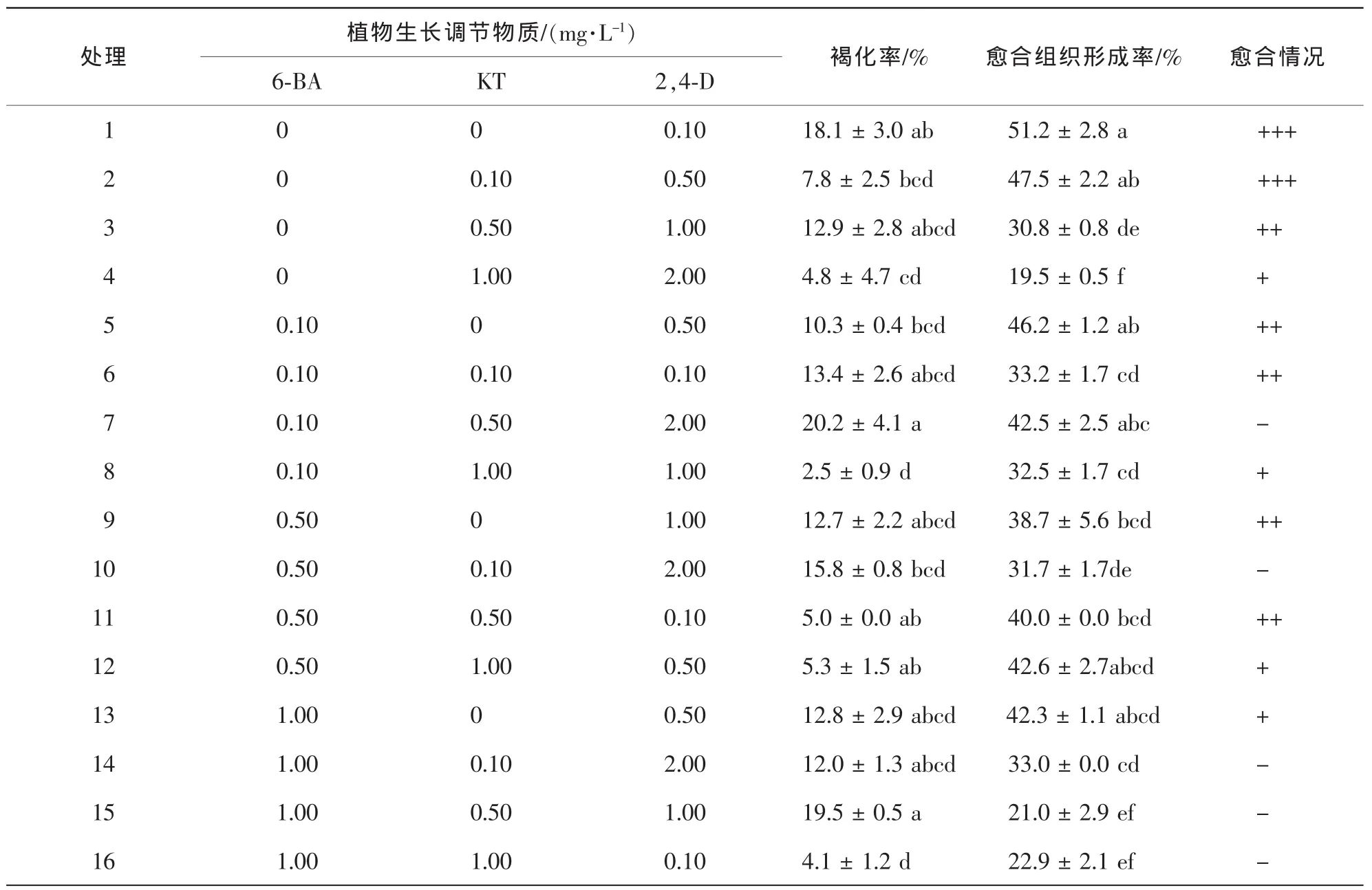
表1 6-BA,KT和2,4-D对香榧愈合组织形成的影响Table 1 Effect of 6-BA,KT and 2,4-D on callus formation of Torreya grandis ‘Merrillii’
2.2 胚性愈合组织的形成和增殖
2.2.1 胚性愈合组织的形成 筛选生长势基本一致的愈合组织分别转入到较佳的愈合组织诱导培养基,植物生长调节物质减少为 1/2,即 SH+0.05 mg°L-16-BA+0.25 mg°L-12,4-D,SH+0.05 mg°L-12,4-D,SH+0.05 mg°L-1NAA。水渍状愈合组织接种1周后即褐化,几乎停止生长,只有疏松状愈合组织能继续增殖(图1-4)。疏松状愈合组织在SH+0.05 mg°L-1NAA培养基上,3周左右开始产生乳白色半透明的胚性愈合组织(图1-5),并能大量增殖(图1-6)。疏松状愈合组织在 SH+0.05 mg°L-16-BA+0.25 mg°L-12,4-D,SH+0.05 mg°L-12,4-D培养基上生长缓慢,易发生褐化,需要2~3次的继代,增殖速度才开始加快。继代过程中 SH+0.05 mg°L-12,4-D 培养基上能产生乳白色愈合组织,而 SH+0.05 mg°L-16-BA+0.25 mg°L-12,4-D 培养基上多形成淡黄色颗粒状愈合组织。

表2 6-BA,KT和NAA对香榧愈合组织形成的影响Table 2 Effect of 6-BA,KT and NAA on callus formation of Torreya grandis ‘Merrillii’
2.2.2 胚性愈合组织的增殖 为了获得适宜的胚性愈合组织增殖培养基,根据前期愈合组织诱导效果筛选了5个处理进行了筛选试验。结果(表3)表明:以4周作为1个继代周期,不同处理间的增殖倍数存在显著差异(P<0.05)。SH基本培养基的增殖倍数最大,达9.7,但易出现玻璃化。SH+0.05 mg°L-1NAA的增殖效果最好,而且多次继代后,胚性培养物仍呈乳白色、透明状。胚性愈合组织在SH+0.05 mg°L-1KT+0.25 mg°L-1NAA 上继代后多产生乳白色黏稠愈合组织。在 SH+0.05 mg°L-16-BA+0.10 mg°L-12,4-D 培养基上胚性愈合组织增殖过程中易失去胚性,表现为褐化或黄色黏稠状。

表3 胚性愈合组织的增殖结果比较Table 3 Effect of plant growth regulators on embryogenic tissue proliferation
2.3 体细胞胚的诱导与萌发
初步的实验结果表明:在添加ABA和PEG6000的SH培养基上培养2~3周,胚性愈合组织能产生体胚(图1-7),实验的3个处理中,5 mg°L-1ABA+10 g°L-1PEG 6000培养基上形成的体胚数最多且畸形体胚比例较小。体胚在弱光(1 200 lx)下(图1-9)的萌发效果比黑暗条件(图1-8)下好。部分体胚在1/2SH基本培养基上萌发,子叶展开良好,但部分体胚发育至早期胚时期便开始脱分化,形成畸形体胚。
3 结论与讨论
香榧幼胚接入不同培养基上,诱导形成的愈合组织大致可分为水渍状愈合和疏松状愈合2类。水质状愈合组织易褐化,几乎不生长,只有疏松状愈合组织能继续增殖。香榧幼胚愈合组织诱导的基本培养基应选择SH为宜,碳源以蔗糖最好。于大德等[9]指出,添加Gln作为氮源可有效提高云南松Pinus yunnanensis成熟合子胚的愈合组织诱导率并减少褐化比例。本研究中也发现在SH和MS中添加500 mg°L-1Gln,有利于降低褐化率,提高愈合组织诱导率,但诱导的愈合组织多呈水渍状,且容易褐化。SH+肌醇和SH+CH等2个处理诱导的愈合组织质量虽较高,但愈合组织形成率却低于SH对照处理。可见,Gln,肌醇和CH对幼胚愈合组织发生的诱导效果不明显。
不同发育阶段的外植体由于生理状态不一样,会对相同的培养条件产生不同反应[10-11],针叶树种合子胚的发育阶段,是影响其愈合组织形成的关键因素[12-14]。姜新兵等[3]曾报道在 SH+0.1 mg°L-16-BA+0.5 mg°L-12,4-D 培养基上,胚的愈合诱导率可达 69.8%。本研究发现,SH+0.1 mg°L-1BA+0.5 mg°L-12,4-D培养基上的愈合诱导率均在50%以下,可能是由外植体的采集时期不同引起。高质量浓度的2,4-D,BA和KT组合对多数针叶树种合子胚快速诱导形成愈合组织有利;冷杉Abies fabri属树种的胚发生培养物也可在只含细胞分裂素而无任何生长素的培养基上诱导产生[15],而NAA激素组合比2,4-D组合更有利于东北红豆杉Taxus cuspidata的愈合组织诱导[16]。本研究中,NAA或2,4-D与其他生长调节物质的组合使用,愈合组织诱导效果不明显,低质量浓度NAA或2,4-D单独使用促进愈合组织发生,尤以低质量浓度NAA的效果最好,当NAA为0.1 mg°L-1时,愈合组织形成率达60.1%。
2,4-D在植物胚性愈合组织的诱导中起着重要作用[17],松柏类植物胚性组织诱导一般需要添加2,4-D,但在胚性组织增殖阶段,应该及时去掉或降低2,4-D质量浓度[18]。华北落叶松Larix principis-rupprechtii胚性愈合组织长期在含有高质量浓度2,4-D的培养基上继代,会导致体细胞胚成熟能力的丧失,用NAA代替2,4-D明显提高了成熟胚的质量[19]。香榧胚性愈合组织的诱导必须去掉2,4-D[20]。本试验中,2,4-D不利于胚性愈合组织的形成和增殖,SH+0.05 mg°L-1NAA是胚性愈合组织形成和增殖最理想培养条件。
体细胞胚的成熟和萌发是多数木本植物建立体细胞胚再生体系时的主要难题[21]。姜新兵等[3]首次获得了香榧体细胞胚,但未提及体胚成熟和萌发问题。本研究发现,香榧的体胚发生有一定难度,次生胚发生率较高,一定程度上抑制了体胚的成熟,在1/2SH基本培养基上部分体胚发育至早期胚时期便开始脱分化,形成畸形体胚,仅少量体胚萌发,子叶展开良好。因此,仍需加强对体胚诱导、成熟和萌发条件的系统研究,为建立高效稳定的香榧体胚发生和遗传转化体系铺平道路。
[1]黎章矩,程晓建,戴文圣,等.香榧品种起源考证[J].浙江林学院学报,2005,22(4):443-448.LI Zhangju,CHENG Xiaojian,DAI Wensheng,et al.Origin of Torreya grandis ‘Merrillii’ [J].J Zhejiang For Coll,2005,22 (4): 443-448.
[2]黎章矩,程晓建,戴文圣,等.浙江香榧生产历史、现状与发展[J].浙江林学院学报,2004,21(4):471-474.LI Zhangju,CHENG Xiaojian,DAI Wensheng,et al.History and status and development of Torreya grandis ‘Merrillii’ in Zhejiang Province [J].J Zhejiang For Coll,2004,21 (4): 471-474.
[3]姜新兵,陈力耕,何新华.香榧体细胞胚发生的研究[J].园艺学报,2004,31(5):654-656.JIANG Xinbing,CHEN Ligeng,HE Xinhua.Studies on the somatic embryogenesis of Torreya grandis [J].Acta Hortic Sin,2004,31 (5): 654-656.
[4]刘海琳,陈立耕,童品璋,等.香榧茎段离体培养再生植株的研究[J].果树学报,2007,24(4):477-482.LIU Hailin,CHEN Ligeng,TONG Pinzhang,et al.In vitro organogenesis and plant regeneration from stem segments of Torreya grandis [J].J Fruit Sci,2007,24 (4): 477-482.
[5]金航标,戴文圣,吴慧敏,等.香榧腋芽组培及嫩枝嫁接技术研究[J].浙江林业科技,2008,28(3):56-58.JIN Hangbiao,DAI Wensheng,WU Huimin,et al.Study on tissue culture for axillary bud and softwood grafting technique of Torreya grandis ‘Merrillii’ [J].J Zhejiang For Sci Technol,2008,28 (3): 56-58.
[6]MURASHIGE T,SKOOG F.A revised medium for rapid growth and bioassay with tobacco tissue cultures [J].Physiol Plant,1962,15: 373-497.
[7]SCHENK T,SCHENK R U,HILDEBRANDT A C.Medium and techniques for induction and growth of monocotyledonous and dicotyledonous plant cell cultures [J].Can J Bot,1972,50: 199-204.
[8]GAMGORG O L,MILLER R A,OJAMA K.Nutrient requirements of suspension cultures of soybean root cells [J].Exp Cell Res,1968,50: 151-158.
[9]于大德,肖宁,王企珂,等.云南松胚性愈伤组织诱导及增殖[J].西北植物学报,2011,31(10):2119-2123.YU Dade,XIAO Ning,WANG Qike,et al.Induction and proliferation of embryo callus from Pinus yunnanensis Franch [J].Acta Bot Boreali-Occident Sin,2011,31 (10): 2119-2123.
[10]WILHELM E.Somatic embryogenesis in oak (Quercus spp.) [J].In Vitro Cell Dev Biol Plant,2000,36 (5): 349-357.
[11]LELU M A,MICHELE B C,KLIMASZEWSKA K.Clonal plant production from self-and cross-pollinated seed families of Pinus sylvestris (L.) through somatic embryogenesis [J].Plant Cell Tiss Org Cult,2008,92: 31-45.
[12]MACKAY J J,BECWAR M R,PARK Y S,et al.Genetic control of somatic embryogenesis initiation in loblolly pine and implications for breeding [J].Tree Genet Genomes,2006,2: 1-9.
[13]ATTREE S M,FOWKE L C.Embryogeny of gymnosperms: advances in synthetic seed technology of conifers [J].Plant Cell Tiss Org Cult,1993,35: 1-35.
[14]CARNEROS E,CELESTINO C,KLIMASZEWSKA K,et al.Plant regeneration in stone pine (Pinus pinea L.) by somatic embryogenesis [J].Plant Cell Tiss Org Cult,2009,98: 165-178.
[15]黄健秋,卫志明.针叶树体细胞胚胎发生的研究进展[J].植物生理学通讯,1995,31(2):85-90.HUANG Jianqiu,WEI Zhiming.Progress of the study on somatic embryogenesis in conifers [J].Plant Physiol Commun,1995,31 (2): 85-90.
[16]王森林,胡风庆.东北红豆杉愈伤组织培养研究[J].辽宁大学学报:自然科学版,2002,29(1):75-77.WANG Senlin,HU Fengqing.Study on callus culture of Taxus cuspidata [J].J Liaoning Univ Nat Sci Ed,2002,29(1): 75-77.
[17]张涛.芸芥体细胞胚胎发生的组织细胞学研究[J].园艺学报,2007,34(1):131-134.ZHANG Tao.Histological studies of somatic embryogenesis in Eruca sativa Mill.[J].Acta Hortic Sin,2007,34(1): 131-134.
[18]江波,杨映根,郭奕明,等.松柏类植物体细胞胚胎发生的研究进展[J].植物学通报,2004,21(4):495-505.JIANG Bo,YANG Yinggen,GUO Yiming,et al.Recent advances in conifer somatic embryogenesis [J].Chin Bull Bot,2004,21 (4): 495-505.
[19]齐力旺,韩一凡,韩素英,等.麦芽糖、NAA及ABA对华北落叶松体细胞胚成熟及生根的影响[J].林业科学,2004,40(1): 52-57.QI Liwang,HAN Yifan,HAN Suying,et al.Effects of maltose,NAA and ABA on somatic maturation and radicle rooting of Larix principis-rupprechtii[J].Sci Silv Sin,2004,40 (1): 52-57.
[20]姜新兵.香榧离体再生系统建立的研究[D].杭州:浙江大学,2004.JIANG Xinbing.Tissue Culture and Plantlet Regeneration Through Somatic Embryogenesis in Torreya grandis [D].Hangzhou: Zhejiang University,2004.
[21]PULLMAN G S,JOHNSON S.Somatic embryogenesis in loblolly pine: improving culture initiation rates [J].Ann For Sci,2002,59: 663-668.

