三维适形放疗与调强放疗同步化疗对Ⅲ期非小细胞肺癌的疗效比较
劳小芳
非小细胞肺癌(non-small cell lung cancer,NSCLC)占肺癌的85%以上,因手术切除困难或身体耐受力差等原因失去了手术时机,故放疗成为临床主要的治疗方法。大量临床研究显示,同步放化疗的综合治疗效果优于单纯放疗,但由于放疗后的毒副作用而影响了其临床应用[1]。我科采用三维适形放疗和调强放疗同步化疗积累了一定的经验,现分析2种同步放化疗方案治疗NSCLC的近期疗效、不良反应以及靶区剂量学的差异,为临床治疗提供一定的参考。
1 资料与方法
1.1 一般资料
选取2010年1月-2012年1月行同期放、化疗治疗的局部晚期非小细胞肺癌(NSCLC)病例作为研究对象,共60例患者纳入本次研究,均经病理检查确诊。其中男性 44例,女性16例,年龄45~71岁,平均(60.3±7.1)岁,入选患者均为初诊,既往无放疗史。根据放疗方法分为IMRT组(调强放疗)和3D-CRT组(三维适形放疗),两组患者平均年龄、性别、病理类型、肿瘤位置、靶区体积以及临床分期见表1,两组临床资料比较无显著性差异(P>0.05),具有可比性。
表1 两组患者临床资料比较(例)
1.2 治疗方法
1.2.1 放疗方法 ①CT扫描勾画靶区:固定体位后行CT定位扫描,层厚、间距均为4 mm;勾画原发病灶的大体肿瘤靶区(gross target volume,GTV),并根据病理类型勾画临床靶区(clinical target volume,CTV),即鳞癌在GTV上外扩6 mm、腺癌外扩8 mm。透视测量患者呼吸运动幅度制定计划靶区(planning target volume,PTV),并勾画正常肺组织、食管、脊髓和心脏等危及器官。②根据分组制定3-5野3D-CRT或5野静态IMRT放疗计划。3D-CRT组采用适形照射野,遵循高剂量靶区集中于病变范围,尽可能保护正常组织原则,以GTV几何中心为治疗中心,进行共面等中心照射,调整各照射野权重、入射方向及楔形板角度,使高剂量区与靶区适形。IMRT组应用5野静态调强技术,采用逆行动态优化设计方案,兼顾靶区、正常肺组织受照容积、脊髓受照量,心脏受照容积等多个因素。两组总照射量 DT为 66 Gy,2 Gy/次,1 次/天,5 次/周,至少95%PTV达到处方剂量以上。放射次序为:靶区、脊髓、肺、食管和心脏。
1.2.2 化疗方法 两组患者均采用相同的化疗方案化疗,紫杉醇40 mg/m2,卡铂 AUC=2,静脉滴注,21 d为1个周期。化疗前给予地塞米松、甲氰咪胍、苯海拉明等预防过敏反应,心电监护仪监测所有患者血压、心率和血氧饱和度。化疗共4个周期,根据情况给予粒细胞集落刺激因子(G-CSF)等支持治疗。
1.3 研究方法和评价标准
观察并记录所有患者放疗后肿瘤局部控制情况,1年生存率及放疗相关并发症;根据放疗计划记录相关剂量参数。①肿瘤局部控制情况在放疗结束后2~3个月,依据胸部CT、MRI等影像学检查结果进行评价:病灶完全消退,且维持4周以上为完全缓解(CR);病灶体积消退>50%,维持4周以上且无新病灶为部分缓解(PR);病灶体积消退<50%或病灶体积范围增大<25%为无变化(SD);病灶体积增大超过25%或者出现新病灶为肿瘤进展(PD),有效率=CR+PR。②放疗相关并发症及分级标准依据RTOG标准:包括急性放射性肺炎、急性放射性食管炎和急性放射性脊髓炎等。③放射剂量学参数:包括靶区(PTV)平均剂量PTV-Dmean、最大剂量 PTV-Dmax、最小剂量 PTVDmin。依据适形指数(conformity index,CI)和异质性指数(heterogeneity index,HI)评估剂量分布。依据肺 V5-V30、MLD,脊髓 Dmax和食管 V50、V60,评价危及器官照射情况。
1.4 统计学处理
应用SPSS 13.0软件包进行统计学分析,计量资料以均数±标准差(±s)表示,组间均数的两两比较采用LSD检验,疗效的比较采用χ2检验。
2 结果
2.1 近期疗效及放疗后并发症(表2)
IMRT组CR 5例,PR 17例,3D-CRT组 CR 4例,PR 17例;IMRT组1年生存率为76.7%(23/30),3DCRT组为73.3%(22/30);两组总有效率和1年生存率比较无显著性差异;放疗后毒副作用以放射性肺炎为主,放射性食管炎也较为常见,IMRT组两者发生率分别为30.0%和16.7%,3D-CRT组分别为53.3%和33.3%;IMRT组放射性食管炎和放射性肺炎发生率显著低于3D-CRT组(P<0.05),具有统计学意义。
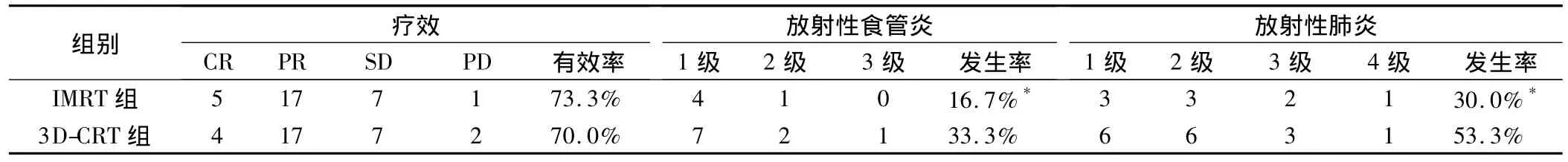
表2 两组近期疗效及放疗并发症情况比较(例)
2.2 两组靶区剂量分布情况(表3)
两组患者PTV剂量分布参数Dmean、Dmin、Dmax比较无显著性差异,IMRT组HI高于3D-CRT组,而CI低于3D-CRT组(P<0.05),提示IMRT靶区适形度更高,而3D-CRT均匀性更好。

表3 两组患者靶区剂量分布的比较
2.3 两组全肺组织剂量学参数比较(表4)
IMRT组 MLD、V10、V20、V30 均低于 3D-CRT组(P<0.05),而V5高于3D-CRT组,提示IMRT可降低正常肺组织暴露于高剂量照射的体积,但低剂量体积增加。

表4 两组患者全肺组织剂量学参数比较
2.4 两组食管、心脏、脊髓剂量学参数比较(表5)
IMRT组食管 V50、V60、心脏 V35以及脊髓Dmean均低于3D-CRT组(P<0.05),提示IMRT对上述危及组织均具有更好地保护作用。

表5 两组患者食管、心脏、脊髓剂量学参数比较
3 讨论
三维适形放疗(3D-CRT)与调强适形放疗(IMRT)是NSCLC的常用治疗方法,2种放疗方式均是通过放射治疗计划系统设计、优化,使放疗靶区得到精确定位,可提高肿瘤局部控制率,并尽可能的避免损伤周围正常组织。本次研究中IMRT组近期有效率达73.3%,3D-CRT组达70.0%,两组总有效率无显著性差异,均显著高于常规放疗,与其他报道的相符[2-3]。Kong等[4]回顾性分析2004-2010年间85例 NSCLC的临床资料,放疗中位剂量为70 Gy(60~86 Gy),低于70 Gy患者与高于70 Gy患者的中位生存时间分别为18.2、41.9个月,具有显著性差异;但也有学者认为高剂量放疗并未体现出预后生存优势,在这项随机临床研究中采用同期放化疗方案,化疗药物均为卡铂联合紫杉醇、西妥珠单抗,根据放疗剂量大小分为60 Gy和74 Gy,由于高剂量放疗毒副反应增加,接受74 Gy放疗患者生存率明显低于60 Gy者,该研究提前结束[5]。本次研究中放疗剂量较适中,两组放疗计划的PTV剂量分布,Dmean、Dmin、Dmax无显著性差异,随访1年,两组生存率无显著性差异,提示3D-CRT与IMRT同步化疗疗效较好,与国内其他研究相符。
3D-CRT采用多野共面或者非共面等中心照射,使高剂量照射区与肿瘤靶区形状相近,但由于PTV基于CT图像三维重建,形状不规则,因此3D-CRT组很难与PTV高度一致[6]。本研究比较3D-CRT组与IMRT组的适形度(HI)和均匀性(CI),IMRT组HI高于3D-CRT组,而CI低于3D-CRT组,提示IMRT靶区适形度更高,而3D-CRT均匀性更好。我们认为IMRT在适形的基础上通过控制子野的剂量强度,使剂量分布在三维方向上与靶区达到高度一致,因此HI更高;也正是因为IMRT通过加强若干个子野形成流强相加效应,这种多次多子野方法有可能增加了靶区剂量的不均匀性[7]。我们认为IMRT对靶区体积较大的患者效果明显,而靶区体积较小的患者获益较小。
两组患者放疗后的毒副作用以放射性肺炎为主,放射性食管炎也较为常见,IMRT组发生率分别为30.0%和16.7%,3D-CRT 组分别为 53.3%和33.3%。IMRT组放射性食管炎和放射性肺炎发生率显著低于3D-CRT组。进一步比较两组患者危机器官的剂量学参数,IMRT 组肺 V10、V20、V30 、MLD,食管 V50、V60,心脏V35以及脊髓Dmean均低于3D-CRT组,而V5高于3D-CRT组。大量的临床报道指出,放射性肺炎是胸部肿瘤放疗的最常见并发症,照射体积与照射剂量是影响放射性肺炎的主要因素,推荐V20应控制在30%~35%[8-9],但由于人种、体型等差异,在国内仅用于参考。本次研究中发现肺组织V10、V20、V30、MLD对于放射性肺炎具有一定的预测性,有学者认为V20超过28%、MLD超过13 Gy与急性放射性肺炎有相关性,在对我国NSCLC患者实施放疗计划中,应将V20 低于28%、MLD 低于13 Gy,可能安全性更高[10]。食管损伤是另一个限制因素。张延可等[11]在 NSCLC放疗引起的放射性食管炎的研究中指出,食管V45是预测放射性食管炎的敏感指标。
综上所述,IMRT与3D-CRT治疗Ⅲ期非小细胞肺癌的总有效率和1年生存率无显著性差异,但后者靶区剂量分布更合理,可降低毒副作用,更值得临床推广使用。鉴于我国NSCLC患者的耐受性及安全性,3DCRT同步放化疗的放射性肺炎和食管炎发生率较高,如何降低3D-CRT的并发症,如何控制IMRT同步放化疗相关并发症的同时提高局控率和生存率仍有待进一步研究。
[1]王培荣,张纬建,洪金省,等.26例非小细胞肺癌调强放疗的近期疗效和毒副反应〔J〕.肿瘤基础与临床,2010,23(6):490.
[2]韩国平,李 刚,吕桂泉,等.同步放化疗与序贯放化疗治疗67例局部晚期非小细胞肺癌的疗效比较〔J〕.肿瘤学杂志,2010,16(12):934.
[3]温翠侠,任洪荣,丁 纪,等.非小细胞肺癌 PET-CT定位同步加量调强放射治疗的剂量学研究〔J〕.实用癌症杂志,2012,27(6):645.
[4]Kong FP,Ten Haken J,Hayman N,et al.Personalized high dose radiation(>70 Gy)is significant associated with better local regional control and overall survival in non-small cell lung cancer treated with concurrent chemoradiation〔J〕.Int J Radiat Oncol Biol Phys,2011,81(2):S594.
[5]Ruysscher DD,Elmpt WV,Lambin P,et al.Radiotherapy with curative intent for lung cancer:A continuing success story〔J〕.Radiother Oncol,2011,101:237.
[6]张富利,许卫东,高军茂,等.逆向3D-CRT与IMRT计划设计方法在非小细胞肺癌放疗中的剂量学比较〔J〕.中国医学物理学杂志,2010,27(2):1704.
[7]陈金梅,张纬建,林育毅,等.三维适形放疗与调强放疗在不同肺叶非小细胞肺癌中的剂量学研究〔J〕.肿瘤基础与临床,2011,24(6):499.
[8]Vogelius I S,Bentzen S.Clinical factors associated with risk of radiation pneumonitis:a litterature based meta-analysis〔J〕.Radiotherapy and Oncology,2010,96(supp):125.
[9]李洪选,吕长兴,王家明,等.肺癌患者急性放射性肺损伤发生的相关因素分析〔J〕.肿瘤学杂志,2012,18(3):170.
[10]杨 阳,闫 婧,刘 娟,等.胸部放疗放射性肺炎病因学相关因素分析〔J〕.中华肿瘤防治杂志,2012,19(6):446.
[11]张延可,李宝生,杨曼茹,等.适形放疗晚期肺癌放射性食管炎相关因素分析〔J〕.中国肿瘤临床与康复,2011,18(3):252.

