老年肝癌患者肝癌切除术后早期肠内营养支持治疗的临床价值
徐国辉 吕赛平 解长佶 周 铮 何 均 徐宗全
肝癌切除术是原发性肝癌最主要的治疗手段,但创伤较大。老年肝癌患者进行肝癌切除术后常常出现营养不良,免疫系统功能受抑制,且术后易出现并发症,增加肿瘤复发、转移的可能[1-3],因此尽早给予老年肝癌切除术患者营养支持治疗是十分必要的。本研究旨在探讨老年肝癌患者肝癌切除术后早期肠内营养支持治疗的临床价值,现报告如下。
1 资料与方法
1.1 一般资料
选取2009年1月-2012年12月在我科接受肝切除术或肝局部切除术的76例患者作为研究对象。纳入标准:①术后经病理检查确诊为原发性肝癌;②年龄>60岁;③术前肝功能Child-Pugh评级A或B级;④术后未发生腹腔内出血,或急性呼吸窘迫综合征,或肝肾功能衰竭等并发症。排除标准:①同时接受门静脉阻断术或肝动脉阻断术的患者;②入院前一周服用α受体阻断剂、肾上腺皮质激素和利尿剂的患者;③合并糖尿病、甲亢等内分泌性疾病的患者;④合并高血压的患者;⑤发生围手术期死亡患者。将入选的76例患者随机分为观察组与对照组。观察组男性25例,女性13例;Child-Pugh A级22例,B级16例。对照组男性27例,女性11例;Child-Pugh A级25例,B级13例。2组患者一般资料相比差异无统计学意义(P>0.05),见表1。
表1 观察组与对照组一般资料的比较(±s)
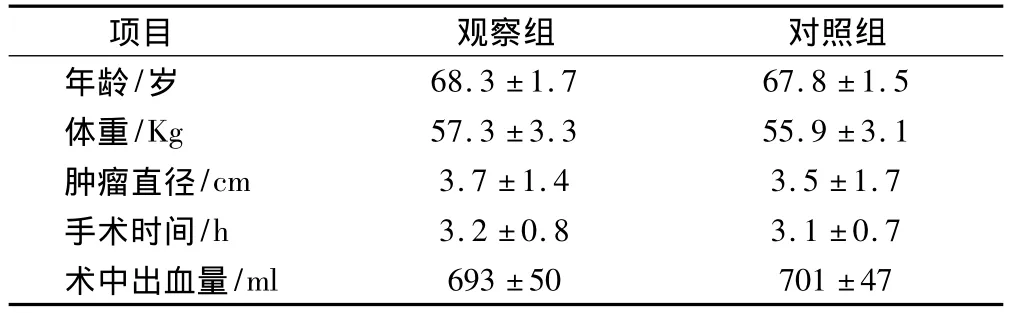
表1 观察组与对照组一般资料的比较(±s)
观察组 对照组年龄/岁项目68.3 ±1.7 67.8 ±1.5体重/Kg 57.3 ±3.3 55.9 ±3.1肿瘤直径/cm 3.7 ±1.4 3.5 ±1.7手术时间/h 3.2 ±0.8 3.1 ±0.7术中出血量/ml 693±50 701±47
1.2 方法
观察组患者术后早期接受肠内营养治疗,方法如下:术中于空肠上段行空肠穿刺造口放置福尔凯肠营养管(Flocare空肠造口管,荷兰Nutricia公司),头端放置于十二指肠悬韧带远端25 cm,营养管方向应顺肠道方向走行放置,以免打折致营养管堵塞,影响术后肠内营养支持。营养支持方案选用百普素(粉剂,荷兰Nutricia,含碳水化合物 11 g,蛋白质 2.37 g,总热量59.5 kcal)15 g,稀释至60 ml由营养泵经空肠造瘘管输入。对照组患者接受肠外营养治疗,方法如下:使用肠外营养制剂,其中含葡萄糖11 g,氨基酸2.5 g,总热量57.6 kcal,总容量60 ml,由输液泵经静脉途径恒速输入。所有病例术后第18 h开始营养支持实验,各营养方案均持续2 h且不使用胰岛素。
1.3 统计学处理
采用SPSS19.0统计软件进行数据分析;计量资料采用均数±标准差(±s)表示,计数资料采用百分率表示,组间计量资料的比较采用成组设计t检验,组间计数资料率的比较采用四格表χ2检验。
2 结果
2.1 2组患者治疗前后肝功能指标以及营养指标的比较
手术前,2 组患者 TBIL、ALT、ALB、PCHE、PA 相比差异无统计学意义(P>0.05)。手术后第7天,观察组TBIL、ALT显著低于对照组,ALB、PCHE、PA显著高于对照组(P<0.05),见表2。
表2 2组患者治疗前后肝功能指标以及营养指标的比较(±s)
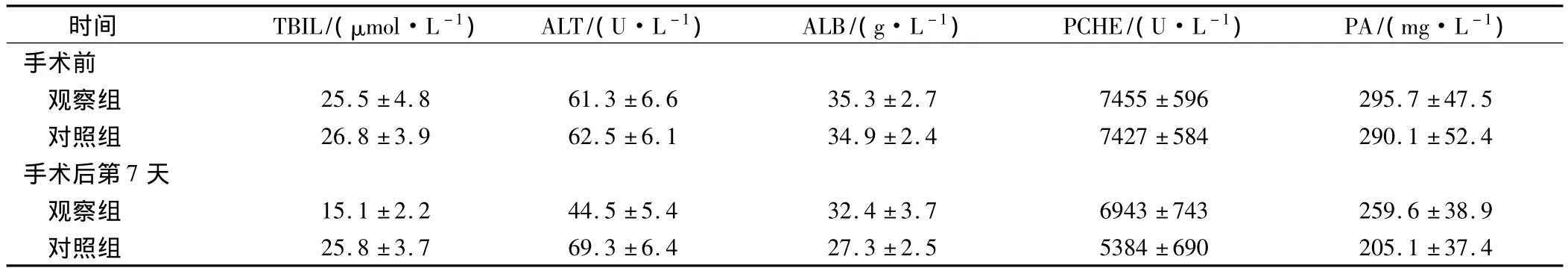
表2 2组患者治疗前后肝功能指标以及营养指标的比较(±s)
时间 TBIL/(μmol·L-1)ALT/(U·L-1)ALB/(g·L-1)PCHE/(U·L-1)PA/(mg·L-1)手术前观察组 25.5 ±4.8 61.3 ±6.6 35.3 ±2.7 7455 ±596 295.7 ±47.5对照组 26.8 ±3.9 62.5 ±6.1 34.9 ±2.4 7427 ±584 290.1 ±52.4手术后第7天观察组 15.1 ±2.2 44.5 ±5.4 32.4 ±3.7 6943 ±743 259.6 ±38.9对照组 25.8 ±3.7 69.3 ±6.4 27.3 ±2.5 5384 ±690 205.1 ±37.4
2.2 2组患者治疗前后免疫功能的比较
手术前,2组患者 CD4+T细胞、CD8+T细胞、CD4+T细胞/CD8+T细胞比值相比,差异无统计学意义(P>0.05)。手术后第7天,观察组CD4+T细胞、CD8+T细胞、CD4+T细胞/CD8+T细胞比值显著高于对照组(P<0.05),见表3。
2.3 2组患者手术并发症发生率的比较
观察组有2例(5.3%)患者发生肺部感染,1例(2.6%)患者发生胆瘘;对照组有8例(21.1%)患者发生肺部感染,8例(21.1%)患者发生胆瘘。观察组术后肺部感染、胆瘘发生率显著低于对照组(P<0.05)。
表3 2组患者治疗前后免疫功能的比较(±s)

表3 2组患者治疗前后免疫功能的比较(±s)
时间 CD4+T细胞CD8+T细胞 CD4+T细胞/CD8+T细胞手术前观察组 0.37 ±0.18 0.22 ±0.14 1.73 ±0.36对照组 0.39 ±0.18 0.23 ±0.15 1.75 ±0.29术后第7天观察组 0.46 ±0.18 0.31 ±0.19 1.65 ±0.37对照组0.25 ±0.09 0.19 ±0.07 1.31 ±0.26
3 讨论
随着目前人口老龄化的逐渐加重,老年恶性肿瘤患者逐渐增多,且这类患者常存在不同程度的营养不良及免疫功能受限,手术创伤又会加速分解代谢,增加机体营养消耗,因此术后患者易发生营养不良,进一步增加患者并发症发生率、延迟患者康复。而诸多研究均表明,在术后给予患者必要的营养支持可以减轻患者术后的负氮平衡,在维持重要脏器的功能、减少外科手术并发症等[4]。
原发性肝癌是我国常见的恶性肿瘤之一,死亡率占肿瘤死亡率的第3位[5-6]。对于原发性肝癌患者术后营养支持,肠内和肠外两个途径的哪个更为安全尚未有定论,但有研究表明,肠外营养支持有促进恶性肿瘤细胞生长的表现[7]。而在近期疗效方面,与肠外营养相比,肠内营养则具有明显的优越性:①肠内营养时营养底物从肠道吸收,经门静脉进入肝脏符合生理,有利于内脏蛋白的合成与代谢;②肠内营养为黏膜细胞提供营养物质,可维持肠黏膜屏障,防止细菌异位;③肠内营养经肠道吸收的脂肪酸不能为肿瘤细胞利用;④肠内营养可减少肝胆并发症等。此外,与胃肠道手术不同,肝癌切除术患者胃肠道完整,因此肠内营养途径较为安全的。
近年来随着对肠道功能的再认识,术后早期肠内营养受到重视,它是指手术后6~24 h内开始给予患者肠内营养支持。一般情况下,小肠功能在术后6~12 h即可恢复,尽管其吸收功能仍然受到一定抑制,但是其保留功能足以吸收满足机体需要的营养素,因此术后早期肠内营养支持可以改善患者的营养状态[8]。但是既往术后早期肠内营养由于受到“肛门排气方可进食”传统观念的影响,并且实施麻烦,患者有时出现腹胀、腹泻等不适症状,所以术后早期肠内营养的临床应用一直受到限制。
本研究总结分析了我院76例老年肝癌肝脏切除术患者,其中36例观察组患者术后早期接受肠内营养治疗,36例对照组患者术后接受肠外营养治疗,结果显示手术后第7天,观察组TBIL、ALT显著低于对照组,ALB、PCHE、PA、CD4+T 细胞、CD8+T 细胞、CD4+T细胞/CD8+T细胞比值显著高于对照组(P<0.05)。此外,我们还发现早期肠内营养对降低肺部感染并发症有明显的作用,这可能是该方法可以增加肠道血流,进而增加肝内血流,保护了肝的网状内皮系统,维护了新生肝组织抵抗病原体能力所致。
总之,老年肝癌患者术后进行早期肠内营养支持,能降低机体应激反应,加快分解代谢向合成代谢转变;能促进肝细胞的修复,并加快胆汁的生成和分泌;能减少肠源性感染的机会,维护新肝抗病原体的能力。在肠道通畅的情况下,术后早期应用肠内营养治疗能促进患者的恢复,对临床的治疗有一定的参考价值。
[1]Ni CY,Yang Y,Chang YQ,et al.Fast-track surgery improves postoperative recovery in patients undergoing partial hepatectomy for primary liver cancer:A prospective randomized controlled trial〔J〕.Eur J Surg Oncol,2013,39(6):542.
[2]尹正录,吴万垠,孟兆祥,等.经肝动脉灌注栓塞治疗232例原发性肝癌患者的临床分析〔J〕.实用癌症杂志,2011,26(5):500.
[3]Shi HY,Lee KT,Lee HH,et al.Comparison of artificial neural network and logistic regression models for predicting inhospital mortality after primary liver cancer surgery〔J〕.PLoS One,2012,7(4):e35781.
[4]Pignata S,Gallo C,Daniele B,et al.Characteristics at presentation and outcome of hepatocellular carcinoma(HCC)in the elderly.A study of the Cancer of the Liver Italian Program(CLIP)〔J〕.Crit Rev Oncol Hematol,2006,59(3):243.
[5]Liu D,Zhi L,Ma M,et al.Primarily screening and analyzing ESTs differentially expressed in rats'primary liver cancer〔J〕.Chin J Cancer Res,2013,25(1):71.
[6]王 娟,纪 钧,陈大可,等.金米冲剂联合化疗栓塞治疗原发性肝癌的疗效观察〔J〕.实用癌症杂志,2012,27(2):131.
[7]Mitchell J,Jatoi A.Parenteral nutrition in patients with advanced cancer:merging perspectives from the patient and healthcare provider〔J〕.Semin Oncol,2011,38(3):439.
[8]Kolios G,Kotzampassi K,Manousou P,et al.Enteral nutrition affects nitric oxide production in peripheral blood and liver after a postoperative lipopolysaccharide-induced endotoxemia in rats〔J〕.Nutrition,2007,23(7-8):575.

