TLR4基因在宫颈癌组织中的表达及其与HIF-1α的相关性
陈赣洪
炎症是许多重要疾病的公共通路,而宫颈癌是病原体感染获得性疾病,其发展经历了从炎症到上皮非典型增生再到癌变的阶段。那么,病原体感染激活的天然免疫反应在宫颈癌进展过程中发挥了什么作用呢?天然免疫防疫系统的识别作用主要是由TLRs来完成的。其中TLR4不但识别外源的病原体,还可识别内源性物质及其降解产物[1]。其激活的TRAF6可以结合ECSIT,激活MAPK途径,活化NF-кB和低氧诱导因子-1ɑ(hypoxia inducible factor-1ɑ,HIF-1α)信号[2]。本组研究TLR4和HIF-1α在宫颈病变组织中的表达趋势及其相关性,以探索TLR4基因在宫颈癌发生发展过程中的作用。
1 材料与方法
1.1 研究对象
选自我院妇科2011年3月至2012年10月收治的经活检病理检查诊断为宫颈炎合并HPV感染、CINⅠ期、CINⅡ期、CINⅢ期和宫颈癌的患者。行阴道镜检测同时,取宫颈脱落细胞进行杂交捕获(Hybridization Capture)HPV DNA分析,确定HPV 16感染才记入。所有患者为初发患者。每组20例,同时以健康无HPV感染的20例宫颈组织(如因子宫肌瘤、功血等切除子宫)作为对照组。
1.2 方法
将新鲜组织置于液氮中保存,实验前研磨成粉末后,取0.5 g匀浆研碎组织裂解后提取总 RNA,纯度A260/A280在1.8~2.2,逆转录后再行 PCR 扩增,产物凝胶电泳后用凝胶成像系统分析。内对照β-actin的mRNA分别与TLR4和HIF-1α的mRNA在同一体系共同扩增,以降低干扰因素对实验结果的影响,凝胶在图像系统上分析出所有mRNA的密度后,将β-actin的密度作为内对照,目的基因与内对照的密度之比为目的基因表达的相对值。每组实验重复3次,取平均值。TLR4上游引物 5'-AATCTAGAGCACTTGGACCTTTCC,下游引物 3'-GGGTTCAGGGACAGGTCTAAAGA;HIF-1α 上游引物 5'-TCAAAGTCGGACAGCCTCA,下游引物 3'-CCCTGCAGTAGGTTTCTGCT;β-actin 上游引物 5 '-AAGAGAGGCATCCTCACCCT,下游引物3 '-TACATGGCTGGGGTGTTGAA。
1.3 统计学方法
所有数据应用SPSS13.0软件统计,组间比较采用方差分析。
2 结果
2.1 TLR4 RNA含量的变化
RT-PCR检测结果显示,从正常宫颈组织→感染HPV16的宫颈炎性组织→CIN组织→宫颈癌组织,TLR4表达量逐渐增加,对照组显著减少。经灰度值分析,各组TLR4表达值见表1,经统计分析,差异非常显著(表1、图1)。
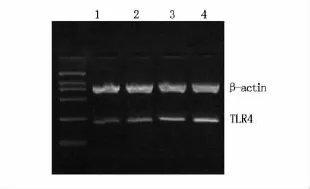
图1 RT-PCR检测TLR4基因在各组宫颈组织中的表达
2.2 HIF-1αRNA 含量的变化
经灰度值分析,各组织中HIF-1α表达值见表1,经统计分析,差异非常显著(表1、图2)。
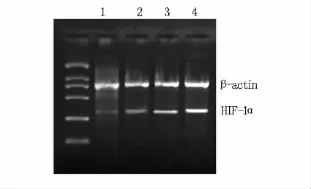
图2 RT-PCR检测HIF-1α基因在各组中的表达情况
2.3 宫颈癌组织中TLR4和HIF-1α表达的相关性
对宫颈癌组织中TLR4和HIF-1α的基因含量进行双因素相关性分析,结果γ=0.491,表示两者呈正相关性,经对相关系数的假设检验,P<0.05。
3 讨论
研究表明TLR4在许多皮肤黏膜表面表达,通过识别病原微生物激活天然免疫防疫反应,调控致炎因子的释放,在皮肤及黏膜的免疫反应中发挥重要的作用。同时,其介导了炎症反应是许多重要疾病、特别是肿瘤发生的公共通路[3]。
HIF-1α是决定恶性肿瘤预后的重要因子,其过度激活可促进肿瘤细胞的生长、浸润和转移,并诱导肿瘤细胞对化疗和放疗的抵抗[4]。临床研究发现高表达HIF-1α宫颈癌患者2年生存率明显低于低表达HIF-1α患者。我们前期研究亦发现,宫颈癌组织中HIF-1α表达明显升高,转染HIF-1α特异性小干扰RNA可显著降低HIF-1α的表达,并减缓宫颈癌细胞在裸鼠中的生长[5]。
国外研究发现多种外源性因素和内源性炎症介质上调HIF-1α的表达、聚集和活化,不同的细胞对不同微环境刺激,其HIF-1α表达调控并不一样,即有细胞特异性和刺激原的依赖性[6]。丝裂原活化的蛋白激酶(P44/42MAPK)途径干扰HIF-1α表达已被多个研究证实,而丝裂原活化的蛋白激酶的活化广泛地受增殖和炎症信号调控[7];在单核细胞和巨噬细胞中,细菌的脂多糖(LPS)通过模式识别受体(pattern recognition receptor,PRR)诱导 P44/42 的活化,激活 NF B,调控HIF-1α转录水平,而识别细菌LPS的模式识别受体Toll-like receptor 4(TLR4)在很多疾病中都有高表达,其调控的信号通路不仅可以激发机体的先天免疫,同时对后续的继发免疫反应发生发展具有一定的作用[8-9]。大量研究表明HIF-1α的高表达促进中性粒细胞和巨噬细胞增殖,抑制其凋亡,同时通过增加趋化因子的表达,诱导中性粒细胞和巨噬细胞由外周血迁移至局部皮肤,并调节炎症介质(如IL-6、8和TNF-α)的合成和释放。调控局部的炎性微环境,促进炎症的发生发展,故HIF-1α又称之为免疫感受器,具有导致和放大炎症的作用,还可通过上调TLR表达维持机体的先天免疫[10-11]。故HIF-1α下游通路和TLR4信号通路通过正反馈效应相互作用,放大免疫反应,延续机体炎症微环境。
本研究发现,从宫颈感染HPV病毒开始,到宫颈病变进展直至宫颈癌的过程中,TLR4和HIF-1α的表达含量逐渐升高,且差异均有显著性意义。表明TLR4和HIF-1α参与了宫颈癌的发生发展。而相关性分析表明TLR4和HIF-1α在宫颈癌中的表达呈正相关的模式,说明TLR4在宫颈癌中的作用与HIF-1α有关。
表1 RT-PCR法检测TLR4和HIF-1ɑ基因在各组中的相对含量(±s)

表1 RT-PCR法检测TLR4和HIF-1ɑ基因在各组中的相对含量(±s)
基因 正常宫颈 宫颈炎 CIN 宫颈癌 F值 P值16.23 0.0041 HIF-1α 0.19 ±0.03 0.37 ±0.05 0.59 ±0.04 0.75 ±0.12 15.TLR4 0.32 ±0.02 0.48 ±0.03 0.65 ±0.04 0.83 ±0.12 42 0.0072
我们研究证明了TLR4和HIF-1α均参与了宫颈癌的致病过程,而TLR4的上升可能是宫颈癌发生的一个参与因素,其通过和HIF-1α的相互正反馈放大效应,促进了宫颈病变发展过程中的局部炎症效应,参与了宫颈癌的发生。但TLR4在宫颈癌发生过程中的具体作用机制还需要进一步研究。
[1]Challa S,Woelfel M,Guildford M,et al.Viral cell death inhibitor MC159 enhances innate immunity against vaccinia virus infection〔J〕.J Virol,2010,84(20):10467.
[2]Ramanathan M,Luo W,Csóka B,et al.Differential regulation of HIF-1alpha isoforms in murine macrophages by TLR4 and adenosine A(2A)receptor agonists〔J〕.J Leukoc Biol,2009,86(3):681.
[3]Kutikhin AG.Impact of Toll-like receptor 4 polymorphisms on risk of cancer〔J〕.J Hum Immunol,2011,72(2):193.
[4]Nakamura M,Bodily JM,Beglin M,et al.Hypoxia-specific stabilization of HIF-1alpha by human papillomaviruses〔J〕.J Virology,2009,387(2):442.
[5]Oh JM,Ryoo IJ,Yang Y,et al.Hypoxia-inducible transcription factor(HIF)-1 alpha stabilization by actin-sequestering protein,thymosin beta-4(TB4)in Hela cervical tumor cells〔J〕.J Cancer Lettm,2008,264(1):29.
[6]Guo AM,Scicli G,Sheng J,et al.20-HETE can act as a nonhypoxic regulator of HIF-1alpha in human microvascular endothelial cells〔J〕.JAm J Physiol Heart Circ Physiol,2009,297(2):H602.
[7]Ramanathan M,Luo W,Csóka B,et al.Differential regulation of HIF-1alpha isoforms in murine macrophages by TLR4 and adenosine A(2A)receptor agonists〔J〕.J Leukoc Biol,2009,86(3):68.
[8]Djamiatun K,Ferwerda B,Netea MG,et al.Toll-like receptor 4 polymorphisms in dengue virus-infected children〔J〕.Am J Trop Med Hyg,2011,85(2):352.
[9]El-Hage N,Podhaizer EM,Sturgill J,et al.KF.Toll-like receptor expression and activation in astroglia:differential regulation by HIV-1 Tat,gp120,and morphine〔J〕.Immunol Invest,2011,40(5):498.
[10]Spirig R,Potapova I,Shaw-Boden J,et al.TLR2 and TLR4 agonists induce production of the vasoactive peptide endothelin-1 by human dendritic cells〔J〕.Mol Immunol,2009,46(15):3178.
[11]Kim SY,Choi YJ,Joung SM,et al.Hypoxic stress up-regulates the expression of Toll-like receptor 4 in macrophages via hypoxia-inducible factor〔J〕.Immunology,2010,129(4):516.

