用紫外分光光度法和电位滴定法测定几种植物激素的电离常数
朱金花,徐 辉, 2,东莹莹, 2,李德亮,刘绣华, 2*
(1.河南大学 化学化工学院,河南 开封 475004; 2.河南大学 天然药物与免疫工程重点实验室,河南 开封 475004)
植物激素是植物体内合成的对植物生长发育有显著作用的微量有机物,能从产生部位转移到作用部位,在低浓度下就能调节植物的生长发育,几乎参与了调控植物生长发育的每一过程[1]. 植物激素主要包括乙烯、生长素、脱落酸、赤霉素、细胞分裂素、茉莉酸、油菜素内酯和水杨酸等. 当植物受到病原体侵染、害虫及动物的啃咬、干旱及盐胁迫等生物和非生物的伤害后,植物激素在植物启动防御反应的过程中发挥着巨大的作用[2-4]. 植物激素既可以通过调控作物生长发育等过程而直接影响作物产量,又可以通过参与调控作物对各种不利条件的适应性而减少产量损失,其研究成果对提高作物产量起到了革命性的推动作用,具有较大的农业应用价值,因而植物激素的研究越来越引起人们的重视. 电离常数是反映离解性物质理化性质的重要参数之一,其意义在于它能够揭示出在任意选定的pH下离解性物质分子型和离子型的比例. 测定脱落酸等植物内源激素的电离常数,可以预测它们在植物体内的最佳吸收部位和吸收分数, 在研究植物生命活动的过程中具有重要的实际意义. 因此,作者对脱落酸、生长素、赤霉素、水杨酸(分析物结构如图1所示)四种酸性植物内源激素的电离常数进行测定,为其后续进行含量的准确测定提供依据和参考. 测定小分子物质Ka值的实验方法有电位滴定法[5-6]、分光光度法[7-9]、电导率法[10]、pH计法[11]、毛细管电泳法[12-13]、核磁共振法[14]、薄层色谱法[15-16]、溶解度法等. 毛细管电泳法、核磁共振法和薄层色谱法所需仪器价格昂贵,大多数实验室均不具备,使其应用受到较大的局限性. 由于电位滴定法和紫外分光光度法测试过程简单,数据处理方便等优点,因此,作者采用这两种方法测定了这四种植物激素的电离常数.

图1 分析物结构图Fig.1 The structures of analytes
1 实验部分
1.1 实验原理
1.1.1 电位滴定法
电位滴定法是在滴定过程中根据指示电位和参比电极的电位差或溶液的pH的突跃来确定终点的方法. 在酸碱电位滴定过程中,随着滴定剂的不断加入,被测物与滴定剂发生反应,溶液pH不断变化,就能确定滴定终点.
如将被测物质的分子结构式简写为RCOOH,则其电离方程为

(1)
电离平衡常数Ka的定义为
(2)
当滴定分数为50%时,[RCOO-]=[RCOOH],此时有Ka=[H+],即pKa=pH. 在pH-V曲线上,查出体积相当于0.5ΔVep时的pH,即为该物质的pKa.
1.1.2 紫外-可见分光光度法
将被测物质的分子结构式简写为RCOOH,将方程式(2)两边取对数整理,得
(3)
设溶液的总浓度为[c总],其值为
[c总]=[RCOOH]+[RCOO-]
(4)

(5)
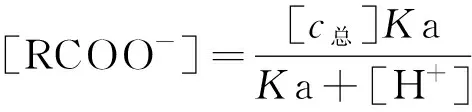
(6)
RCOOH的电离情况不同,当溶液中[RCOOH]和[RCOO-]发生变化时,溶液对紫外光谱的吸收度也随之发生变化,因此,溶液中[RCOOH]和[RCOO-]可以由测定其吸光度间接得到.
由吸光度的可加和性可知,溶液的吸光度为
A=ARCOOH+ARCOO-=εRCOOH[RCOOH]+εRCOO-[RCOO-]
(7)
将(5)、(6)代入(7)得
(8)

(9)
因此,如果配制一系列pH不同,而总浓度[c总]相同的RCOOH溶液,测出这些溶液的A值,通过计算则可最终求出RCOOH的电离常数.
1.2 仪器与试剂
紫外可见分光光度计(北京莱伯泰科仪器有限公司),pHS-3D 型酸度计(上海精密科学仪器有限公司),碱式滴定管(50 mL). 电子分析天平(北京赛多利斯天平有限公司),KQ-600DB型数控超声波仪(昆山市超声仪器有限公司),XK78-1磁力搅拌器(姜堰市新康医疗器械有限公司). 脱落酸(AR)、3-吲哚乙酸(AR)、赤霉素(AR)、水杨酸(AR)购自上海晶纯试剂有限公司,磷酸二氢钠固体、氯化钾、浓磷酸、NaOH固体、浓盐酸、甲醇、乙醇及其他所用试剂均为分析纯,实验用水为二次蒸馏水.
1.3 试剂的配制
①分别称取一定质量的脱落酸、3-吲哚乙酸、赤霉素、水杨酸,用少量乙醇溶解后,用蒸馏水定容于100 mL的容量瓶中作为储备液备用. ②配制1.0 mol/L的氢氧化钠和1.0 mol/L盐酸水溶液作为母液备用. ③配制0.2 mol/L的磷酸二氢钠水溶液备用. 用1.0 mol/L的氢氧化钠或1.0 mol/L盐酸水溶液,将磷酸二氢钠水溶液的pH调到测定所需pH. ④用0.2 mol/L KCl和1.0 mol/L HCl配制pH范围1~2的系列缓冲溶液.
1.4 实验步骤
1.4.1 电位滴定法
用25 mL的移液管准确吸取25.00 mL被测物质储备液至50 mL的烧杯中,放入pHS-3D 型酸度计复合玻璃氢电极并搅拌,用碱式滴定管向溶液中滴加0.01 mol/L NaOH溶液,观察并记录加入NaOH的体积和溶液的pH. 当溶液完全为碱性时即可停止滴加,重复测定三次.
1.4.2 紫外-分光光度法
准确移取一定体积的分析物储备液分别置于25 mL比色管中,分别用不同pH的缓冲液定容至25 mL,以蒸馏水作为对照,于200~400 nm波长范围扫描,得到浓度相同的分析物溶液在不同pH环境下的系列吸收曲线. 选择随pH的改变溶液的吸光度变化较大的波长为测定波长,测定该波长下不同pH的分析物溶液的吸光度,重复测定三次. 根据吸光度的变化趋势, 用图解法计算分析物的Ka值.
3 结果与讨论
3.1 分析波长的选择
根据1.4.2项操作步骤,测得脱落酸、水杨酸、3-吲哚乙酸、赤霉素的紫外分析波长分别为248、297、279、253 nm.
3.2 分析物pKa的粗测
用移液管准确吸取20 mL的分析物储备液至25 mL的烧杯中,测量其pH(测量三次取其平均值). 然后将母液逐级稀释,分别测定浓度为母液的0.5倍、0.25倍、0.125倍等溶液的pH值,记录测量结果. 根据公式(2)粗略计算分析物的pKa值(表1). 根据分析物粗测pKa结果,选择缓冲溶液合适的pH范围(pKa±2)进行紫外分光光度测定.
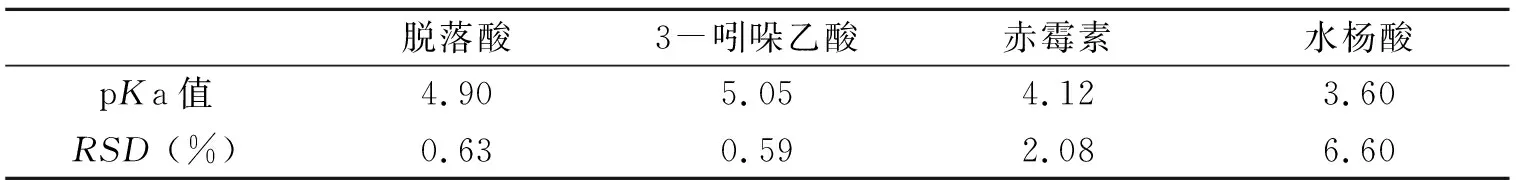
表1 pKa的粗略测定结果Table 1 The rough value of pKa
3.3 分析物pKa的精确测定
3.3.1 电位滴定法
用0.01 mol/L NaOH溶液分别滴定脱落酸、3-吲哚乙酸、赤霉素、水杨酸溶液,根据实验数据绘制pH-V曲线如图2所示.


a:脱落酸;b:3-吲哚乙酸;c:赤霉素;d:水杨酸图2 电位滴定的pH-V曲线Fig.2 The curves of pH-V by potentiometric titration
由图2可以看出,各物质的滴定pH突跃较明显,且数据分布科学合理,根据各物质滴定数据的二阶微商,可以计算得出其滴定终点体积,从pH-V曲线上可得出其对应的pH即为其pKa值. 计算和测定结果如表2所示.
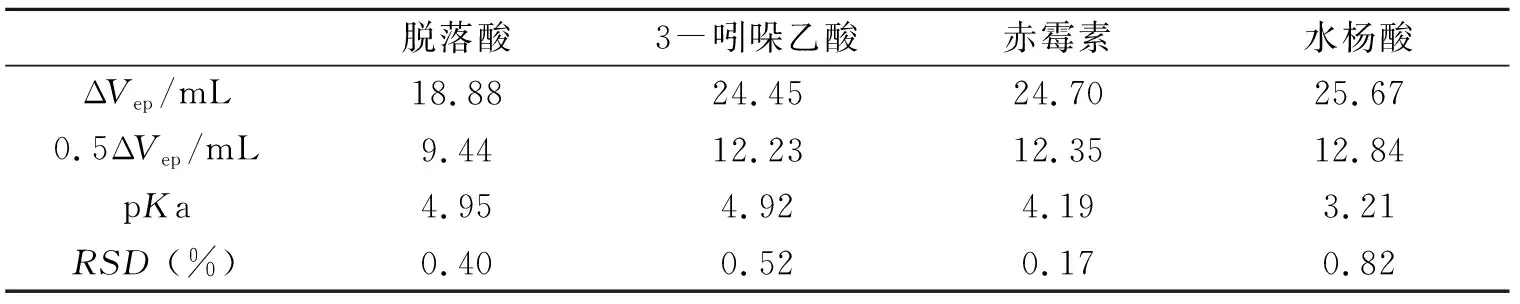
表2 电位滴定测定结果Table 2 The result of potentiometric titration method
3.3.2 紫外分光光度法
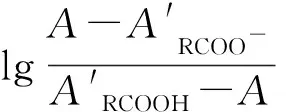
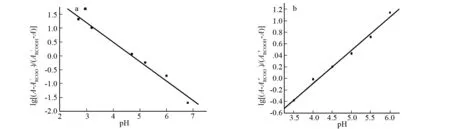
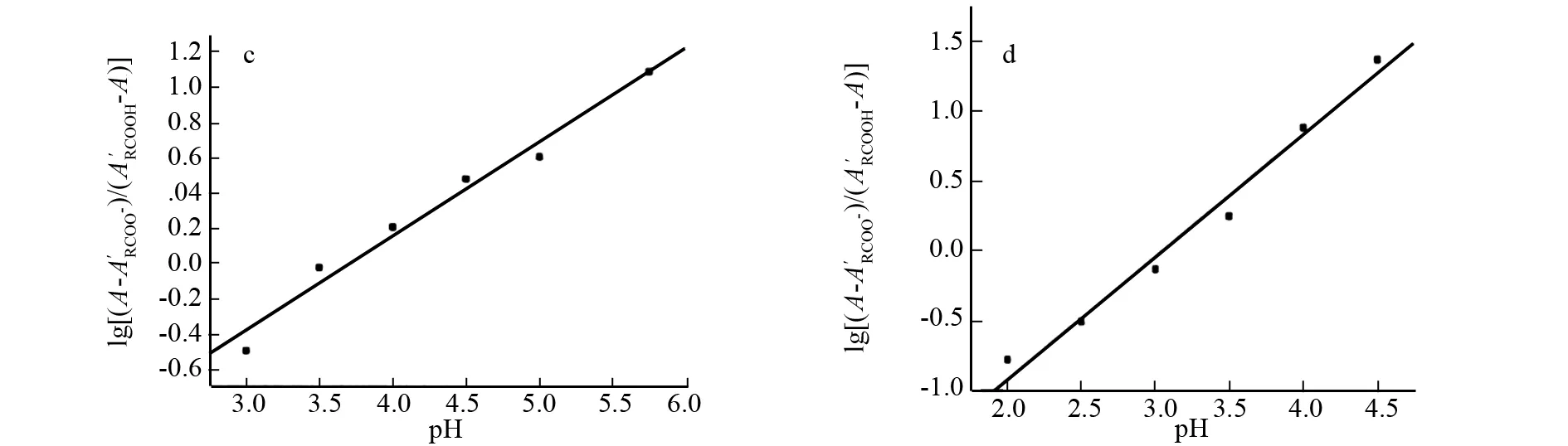
图与pH关系曲线Fig.3 Relationship between and pH

表3 分光光度法测定结果Table 3 The result of spectrophotometry method
3.4 方法比较
将电位滴定法和紫外分光光度法所得脱落酸、3-吲哚乙酸、赤霉素和水杨酸的pKa值与文献报道值进行比较,结果如表4所示.

表4 实验测得数据与文献值的比较Table 4 The comparison of the results with reference
由表4可知,电位滴定法和紫外分光光度法测得的数值与文献报道值较一致. 用紫外分光光度法测定3-吲哚乙酸的pKa值与文献报道值有一定的差异(标准偏差SD﹥12.84%),主要原因可能是3-吲哚乙酸水溶液能被紫外光分解所致. 对于此类物质,可选用电位滴定法测定其电离常数.
4 结论
采用电位滴定法和分光光度法测定了脱落酸等四种植物内源激素的电离常数,实验操作简单、快速,准确度高,且重现性较好,所得数据为后续用色谱对植物激素的定量分析提供参考依据. 从实验数据可以看出,电位滴定法和紫外分光光度法相互补充,对于无法用酸或碱进行电位滴定的稀溶液物质,可用紫外分光光度法测定其电离常数;对于光吸收的或有色浑浊物质,可用电位滴定法测定其电离常数.
参考文献:
[1] DAVIES P J. Plant hormones: physiology, biochemistry and molecular biology [M]. Dordrecht, Netherlands: Kluwer, 1995.
[2] HARMAN G E, HOWELL C R, VITERBO A. Trichoderma species-opportunistic avirulent plant symbionts [J]. Nat Rev Microbiol, 2004, 2: 43-56.
[3] BRAY E A. Abscisic acid regulati on of gene expression during water-deficit stress in the era of the arabidopsis genome [J]. Plant Cell Environ, 2002, 25: 153-161.
[4] DURRANT W E, DONG X. Systemic acquired resistance [J]. Annu Rev Phytopathol, 2004, 42: 185-209.
[5] 王国清,喻定开,周润亚.电位滴定法测定槐定碱和拉马宁碱的电离常数[J]. 沈阳药学院学报, 1991, 8(3):215-216.
[6] 于晓彩,孙亚光,高恩君.两点电位滴定法测定醋酸电离常数及其热力学参数[J]. 沈阳师范学院学报:自然科学版, 2000, 18(2):50-53.
[7] 李广领,张育平.水杨酸pKa 的紫外-可见分光光度法测定[J]. 河南科技学院学报:自然科学版, 2005, 33(1):75-77.
[8] 王文俊,邵自强,李永红,等.紫外分光光度法测定羟丙基甲基纤维素偏苯三甲酸酯的电离常数[J]. 北京理工大学学报, 2008, 28(1):78-84.
[9] 赵秀丽, 陈大为, 罗轶凡,等.紫外分光光度法测定丁香酚的电离常数[J]. 沈阳药科大学学报, 2003, 20(6):445-447.
[10] 张敬来.物理化学实验[M].开封:河南大学出版社, 2008.
[11] 徐家宁,门瑞芝. 基础化学实验(上册)[M].北京:高等教育出版社, 2006.
[12] 刘海兴.毛细管电泳法测定电离平衡常数[J]. 分析化学, 2002, 30(1):125.
[13] FOULON C, DUHAL N, LACROIX-CALLENS B, et al. Determination of pKa values of benzoxa-, benzothiaand benzoselena-zolinone derivatives by capillary electrophoresis. Comparison with potentiometric titration and spectrometric data [J]. Eur J Pharm Sci, 2007, 31 (3/4):165-171.
[14] 庄瑞舫,李巧英.核磁共振法(NMR)和pH法研究Zn(Ⅱ)与HEDP(1-羟基乙叉-1,1-二膦酸)的配合物[J]. 无机化学学报, 1989, 5(1):68-73.
[15] 袁 波,王国清,李 军,等.薄层色谱pH法测定有机酸的电离常数[J]. 沈阳药科大学学报, 2000, 17(4):275-277.
[16] BIDLO M. Thin-layer pH-chromatography of mono and idbasic organic acids on buffered silica gel layers [J]. Acta Chim Acad Sci H, 1976, 88(2):116.
[17] 江海亮,王 强.离子液体作添加剂对高效液相色谱分离植物激素的影响[J]. 分析化学研究简报, 2007, 35(9):1327-1330.

