近平滑假丝酵母发酵产甘露醇
魏文婷,张涛,江波,沐万孟,缪铭
(江南大学食品科学与技术国家重点实验室,江苏无锡,214122)
甘露醇是一种天然糖醇,许多水果和蔬菜如南瓜、蘑菇、洋葱和海藻,尤其是褐色海藻中均有存在[1]。甘露醇具有不吸湿,甜度适宜,热量低,无毒副作用,在人体内代谢与胰岛素无关,不提高血糖值,不致龋齿等特点,可用作糖尿病人、肥胖病人的甜味剂和功能性食品添加剂[2]。在目前工业化生产甘露醇所采用的方法中,除提取法外,其他方法均伴有副产物山梨醇的产生,不仅降低了原料转化为甘露醇的转化率,也为甘露醇的分离和纯化带来了困难[3]。而发酵法能够利用酶系统完成立体有选择的氢化作用,所得的甘露醇产率高且不产生山梨醇[4],具有选择性高,反应条件温和的优势[5]。
自然界中许多微生物可以发酵生产甘露醇,如细菌、酵母菌、真菌等[6-8]。近些年人们多关注于异型发酵的乳酸菌、明串珠菌,它们主要将果糖转化为甘露醇[9]。YUN[10]等研究了2 株乳酸菌产甘露醇的条件,它们利用100 g/L果糖分别得到73和26 g/L的甘露醇。侯建革[11]等采用布氏乳杆菌(Lactobacillus buchneri)发酵48 h产生甘露醇68.5 g/L,培养基总糖为 150 g/L,其中果糖与葡萄糖比值为 3∶1。Song[7]等筛选出1株木兰假丝酵母,利用150 g/L果糖摇瓶培养168 h可产生67 g/L甘露醇。但果糖作为底物相对比较昂贵,不利于工业化生产,为了降低生产成本,必需选择廉价的底物[12]。
为了克服上述缺点,本文首先从甘蔗汁中筛选出1株利用葡萄糖产甘露醇的菌株,经鉴定为近平滑假丝酵母(C.parapsilosis)。它能以高浓度葡萄糖为原料得到较高产量的甘露醇,且不必添加果糖。葡萄糖价格相对低廉,并且大量存在于自然界中,降低了生产成本,这对于今后工业化制备甘露醇具有较大的应用价值。本文在单因素实验基础上,使用正交实验设计优化得到了发酵产甘露醇的最佳培养基,并利用此培养基进行30 L发酵分批培养,探索利用该菌种发酵产甘露醇工业化生产条件。
1 材料和方法
1.1 实验材料
1.1.1 菌株
近平滑假丝酵母(C.parapsilosis),保藏于中国典型培养物保藏中心,编号为CCTCC No.M 2012491。
1.1.2 培养基
富集培养基(g/L):葡萄糖 500,酵母膏 10,pH 5.0。
筛选培养基(g/L):葡萄糖500,酵母膏10,琼脂20,pH 5.0。
斜面保藏培养基(g/L):葡萄糖20,酵母膏 20,琼脂 20,pH 5.0。
种子培养基(g/L):葡萄糖 20,酵母膏 20,pH 5.0。
初始发酵培养基(g/L):葡萄糖150,酵母膏20,MgSO42,KH2PO42,pH 5.0。
1.2 主要仪器
高效液相色谱仪;Agilent 1260;分离柱;Sugarpak-1钙型阳离子交换柱;检测器;Shodex RI-101示差折光检测器;30 L发酵罐;扬中市威柯特生物工程设备有限公司。
1.3 实验方法
1.3.1 菌种筛选方法
取自然放置72 h的甘蔗汁(市购)10 mL接种于100 mL已灭菌的富集培养基中,30℃摇床培养48 h,然后取1 mL培养液梯度稀释涂布于筛选培养基上,倒置于30℃培养箱中,培养48 h。利用高浓度葡萄糖形成的高渗透压(低水活度)环境进行初筛,观察微生物生长情况,用接种环挑选微生物形态、大小、色泽等不同的菌落进行3次平板划线纯化,得到的纯菌落转接到斜面培养基中培养48 h保存。从斜面培养基上挑取1环接种到初始发酵培养基中进行复筛,发酵条件为30℃,200 r/min,培养72 h。发酵结束后将发酵液10 000 r/min离心20 min取上清液,用HPLC检测上清液中是否有甘露醇存在。
1.3.2 培养方法
将生长良好的斜面菌种1环,接种于种子培养基培养,培养条件:30℃,200 r/min,培养24 h。然后以4%接种量接种于装有50 mL发酵培养基的250 mL三角瓶中,培养条件:30℃,200 r/min,培养72 h。
1.3.3 生物量的测定
离心干重法:发酵液30 mL在4 000 r/min下离心10 min收集细胞,蒸馏水洗涤2次再离心,60℃烘干至恒重。
1.3.4 甘露醇产量和葡萄糖的含量
甘露醇和葡萄糖测定:HPLC法。将发酵液10 000 r/min离心20 min,取上清液,经0.45 μm 膜过滤后用HPLC检测发酵液中甘露醇产量和葡萄糖的含量。
色谱条件:流动相:纯水(经0.45 μm膜过滤);流速:0.4 mL/min,柱温:85 ℃;进样量:10 μL。
1.3.5 葡萄糖和果糖对近平滑假丝酵母发酵产甘露醇的影响
改变初始发酵培养基里的碳源,分别以葡萄糖、葡萄糖和果糖质量比分别为 3∶1、2∶1、1∶1、1∶2、1∶3的混合物以及果糖作为不同的碳源进行研究,碳源总浓度均为150 g/L;其次考虑最适碳源的浓度对近平滑假丝酵母发酵产甘露醇的影响。
1.3.6 氮源对近平滑假丝酵母发酵产甘露醇的影响
改变初始发酵培养基里的氮源,研究不同种类氮源(酵母膏、牛肉膏、麦芽浸膏、胰蛋白胨、鱼粉蛋白胨以及尿素)对近平滑假丝酵母发酵产甘露醇的影响;其次考察最适氮源的添加量。
1.3.7 无机盐对近平滑假丝酵母发酵产甘露醇的影响
分别以不同浓度梯度的无机盐(CaCl2·2H2O、FeCl3·2H2O、MgSO4·7H2O、CoCl2·2H2O、CuSO4·5H2O、ZnSO4·7H2O、NiCl2·2H2O 以及 MnSO4·4H2O)添加到初始发酵培养基中,比较无机盐对近平滑假丝酵母发酵产甘露醇的影响。
1.3.8 正交实验设计
根据单因素实验结果,以葡萄糖、酵母膏、CaCl2·2H2O、FeCl3·2H2O以及MgSO4·7H2O浓度为5因素,设计L16(45)正交实验。
1.3.9 30 L发酵罐分批培养
根据正交实验所得优化培养基,将近平滑假丝酵母在30 L发酵罐中进行分批培养,接种量为4%,初始 pH 5.0,30 ℃,通气量0.5 vvm,转速 200 r/min,定期取样测定发酵过程中生物量、pH、葡萄糖以及甘露醇含量的变化情况。
2 结果和讨论
2.1 菌种筛选和鉴定
2.1.1 高效液相对样品的检测结果
利用以高浓度葡萄糖为唯一碳源的富集培养基和筛选培养基,从甘蔗汁中分离得到的SK26.001产甘露醇能力最高,其HPLC测定结果如图1和图2所示。菌株产生的菌落呈粘稠污白色,显微镜下为单细胞个体,呈球形椭圆形等,未见芽殖及假丝菌,如图3所示。
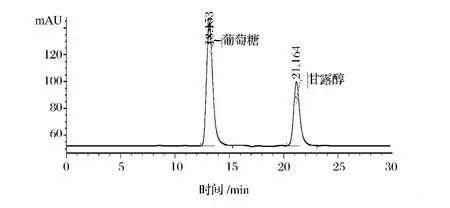
图1 葡萄糖和甘露醇标样的HPLC图Fig.1 HPLC profiles of standard glucose and mannitol

图2 发酵液HPLC图Fig.2 HPLC profiles of fermentation liquid

图3 菌株SK26.001的细胞形态(×400)Fig.3 The morphology of the strain SK26.001(×400)
2.1.2 菌种鉴定结果
进行18S rDNA测序,结果表明:菌株SK26.001的18S rDNA序列含有1446个碱基。将该序列进行BLAST比 对 发 现,该 菌 株 与 C.parapsilosis BG090809.6.8.4.1.12(JQ008831.1)同源性最高,18S rDNA序列同源性达100%。依据形态学、生理生化特性等特征,参照细菌鉴定手册[13],结合18S rDNA序列比对结果,鉴定SK26.001为近平滑假丝酵母(C.parapsilosis)。将 C.parapsilosis SK26.001的18S rDNA序列提交到GenBank得到登录号为KF255835,并将其保藏在中国典型培养物保藏中心,保藏号为CCTCC No.M 2012491。
2.2 葡萄糖和果糖对近平滑假丝酵母发酵产甘露醇的影响
研究不同配比的葡萄糖和果糖对近平滑假丝酵母发酵产甘露醇的影响,结果见图4。
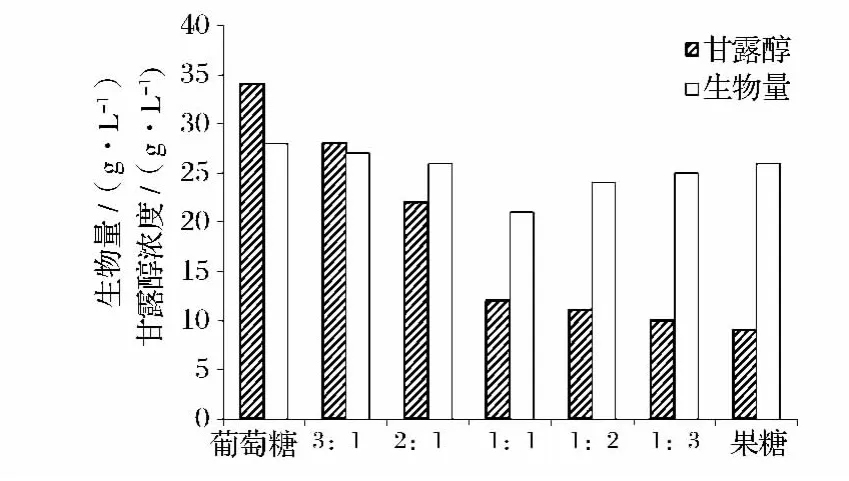
图4 不同配比碳源对发酵过程的影响Fig.4 Effect of different proportion of carbon sources on fermentation
从图4可以看出,虽然利用不同配比的葡萄糖和果糖都能获得与葡萄糖接近的生物量,但甘露醇的产量都不及仅以葡萄糖为碳源时的产量高,这说明近平滑假丝酵母代谢不同糖类的机制可能不同,影响到细胞内 mannitol dehydrogenase、mannitol-1-phosphatase的活力和合成[1],最终造成甘露醇的合成受限。近平滑假丝酵母以果糖为碳源也可以产生少量的甘露醇,但是果糖的存在反而减少甘露醇的生成,随着果糖比例的增加,甘露醇的产量随之减少。因此,选择葡萄糖作为唯一碳源,并研究不同浓度葡萄糖对产甘露醇的影响。
从图5可以清晰看出,葡萄糖含量为200 g/L时获得最大的甘露醇产量,但随着糖含量进一步增加,甘露醇产量反而降低,这是因为甘露醇受底物葡萄糖浓度的影响,葡萄糖浓度过大,不仅对菌体生长抑制作用增加,也影响甘露醇的转化生成,这可能是由于渗透压过高而引起的[7],酵母通过胞内积累多元醇等相容性溶质来适应高渗环境生长,甘油被认为是主要的相容性溶质[14]。这些相容性溶质可以以较高的浓度在细胞内积累而对细胞酶系出现抑制或灭活[15]。
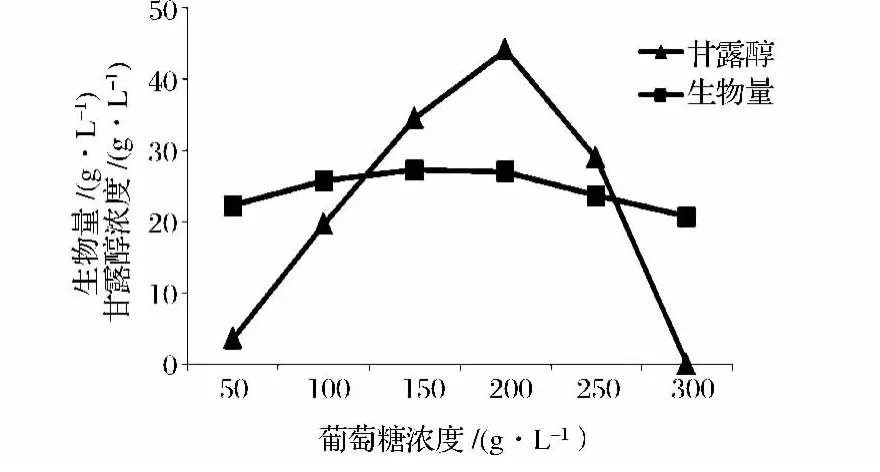
图5 葡萄糖浓度对发酵过程的影响Fig.5 Effect of glucose concentration on fermentation
2.3 氮源对近平滑假丝酵母发酵产甘露醇的影响
氮源对甘露醇发酵的影响,结果如图6所示。由图6可知,氮源对甘露醇发酵影响比较大,其中酵母膏的效果最好。酵母膏富含完全蛋白质,均衡的必需氨基酸以及B族维生素、核苷酸、微量元素等,是最为理想的生物培养基原料和发酵工业中的主要原料,其功效与8倍的酵母相当,可以大大提高菌种的生产速率及发酵产品得率。因此,确定酵母膏为近平滑假丝酵母发酵产甘露醇的最适氮源,再研究不同浓度酵母膏对产甘露醇的影响。
由图7可知,在酵母膏浓度低于10 g/L时,产物甘露醇的生成量相对较低;当酵母膏浓度低于5 g/L时,菌体量不高,这说明低的酵母膏浓度不能满足菌体的生长;当酵母膏浓度高于20 g/L时,菌体量相对变化不大,此可以判断此时的酵母膏的量对于菌体的生长已经满足,但产物甘露醇的生成量随着酵母膏浓度的增大而增加,在酵母膏浓度为25 g/L时达到最大,此时发酵得到的甘露醇产量为39.1 g/L。
2.4 无机盐对近平滑假丝酵母发酵产甘露醇的影响
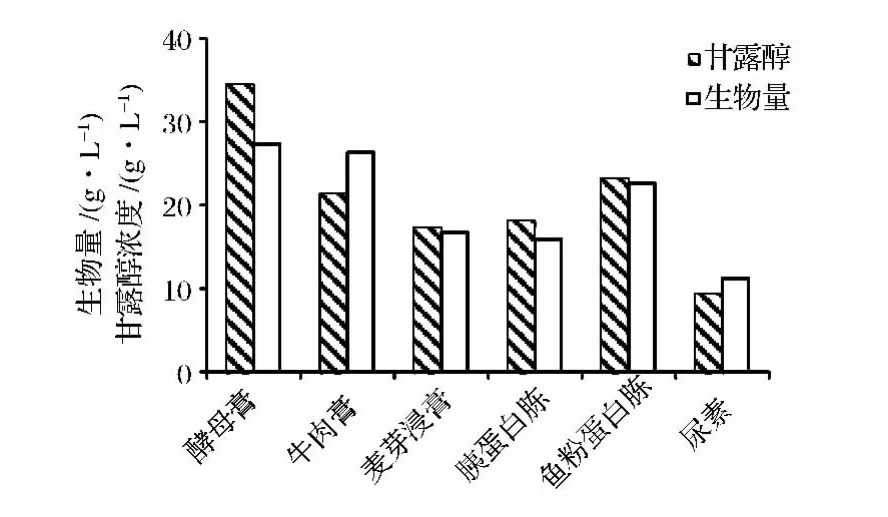
图6 氮源种类对发酵过程的影响Fig.6 Effect of nitrogen sources on fermentation
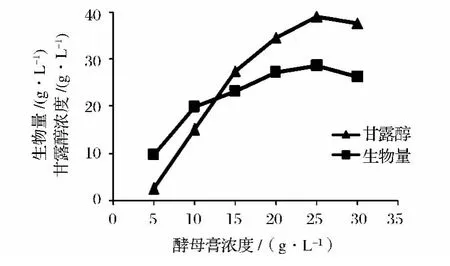
图7 酵母膏浓度对发酵过程的影响Fig.7 Effect of the concentration of yeast extract on fermentation
从图8可以看出,CaCl2·2H2O、FeCl3·2H2O可以明显提高甘露醇的产量,而MgSO4·7H2O能够略微促进甘露醇的生成,它们的最佳浓度分别为0.1 g/L、0.02 g/L、0.2 g/L,其中添加 0.02 g/L FeCl3·2H2O时甘露醇的产量达到55 g/L。据研究发现,Ca2+可以减少胞内甘露醇含量,Cu2+可以增加甘露醇脱氢酶的活力[16],然而Cu2+对近平滑假丝酵母产甘露醇却没有促进作用。Mg2+一般是微生物代谢路径里很多酶的激活剂,在糖酵解、呼吸、氧化磷酸化等过程中起重要作用[17];而Fe3+是细胞色素和铁氧化还原蛋白的氧化还原反应中必不可少的电子载体,在电子传递体系中起至关重要的作用,微生物对Fe3+的需求是微量的,浓度过高会引起抑制或毒害作用[18]。从图9可以看出CoCl2·2H2O、CuSO4·5H2O、ZnSO4·7H2O 严重阻碍甘露醇的生成,而 NiCl2·2H2O、MnSO4·4H2O也对甘露醇的生成有一定影响。某些蛋白质容易受Co2+影响而变性;Cu2+是多种生物过程的基本辅酶,当Cu2+过量时会促使产生活性氧化物,与生物大分子(如蛋白质)结合,从而破坏该大分子的正常生理功能[19]。推测其余几种金属离子也是影响了代谢途径中某些酶的合成和活力而使甘露醇产量减少。

图8 无机盐离子对发酵过程的影响ⅠFig.8 Effect of inorganic salt ions on fermentationⅠ
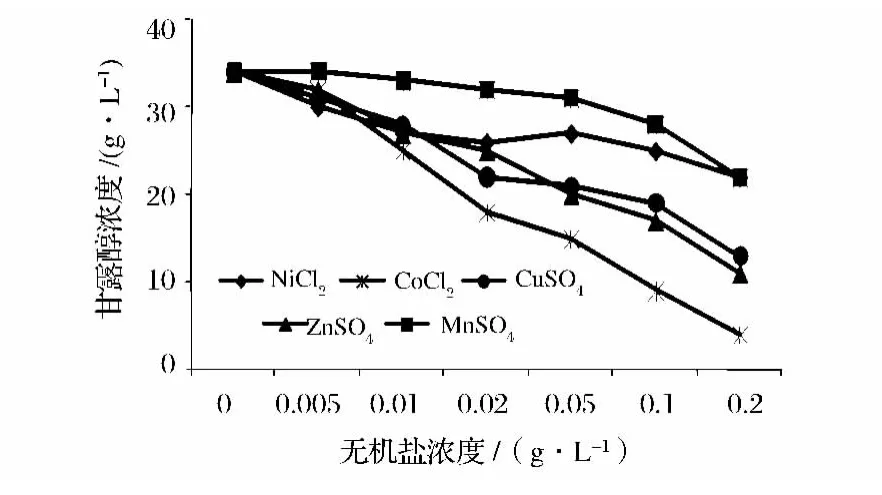
图9 无机盐离子对发酵过程的影响ⅡFig.9 Effect of inorganic salt ions on fermentationⅡ
2.5 正交优化实验结果
考虑到各因素间的交互作用对甘露醇发酵的影响,在单因素实验的基础上,设计L16(45)正交实验,实验因素及水平见表1,实验结果见表2。
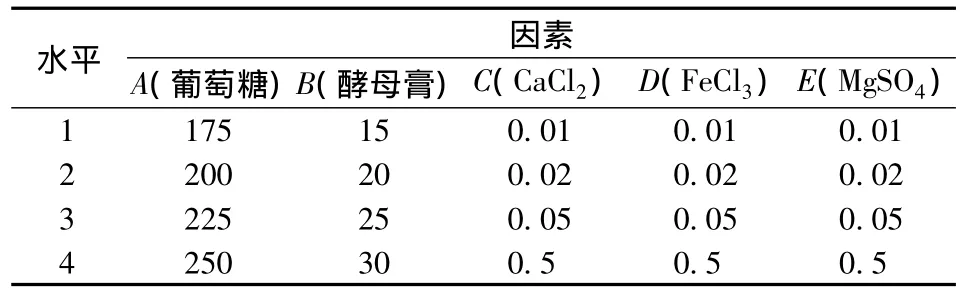
表1 正交实验因素水平表Table 1 Factors and levels of orthogonal experiment
由表2极差分析可知,各因素影响甘露醇产量的顺序为:B>D>A>C>E,即酵母膏>FeCl3>葡萄糖>CaCl2>MgSO4,可以确定最优条件为:A2B4C3D2E4,即葡萄糖浓度为200 g/L,酵母膏浓度为30 g/L,CaCl2·2H2O浓度为0.05 g/L,FeCl3·2H2O浓度为0.02 g/L,MgSO4·7H2O浓度为0.5 g/L。在此条件下进行摇瓶培养,甘露醇产量达到61.7 g/L。
2.6 30 L发酵罐分批培养
为了研究近平滑假丝酵母的细胞生长情况和代谢规律,进行分批发酵,将优化后的发酵培养基一次性加入30 L发酵罐中,发酵过程不流加底物葡萄糖,直至发酵结束。发酵液中甘露醇含量、葡萄糖含量、pH、生物量的变化情况,结果见图10。由图10可知,在前30 h酵母细胞快速生长,随后进入稳定期,之后生物量仍有略微增长。初始pH为5,对数期时pH下降为3.7,这是由于产生了乳酸等酸性物质[21],然而72 h后pH又略有回升,这可能是由于葡萄糖耗尽引起的代谢变化,因此在发酵过程中要控制pH值来促进甘露醇的产生。葡萄糖在前24 h呈线性消耗,主要是用来提供菌体生长;24 h后葡萄糖一方面是用来提供菌体生长,另一方面用来合成甘露醇,在72 h时葡萄糖完全耗尽,此时甘露醇产量达到最大值80.3 g/L。甘露醇在前18 h时没有产生,这段时间是菌体的快速增长期。值得注意的是,当培养基中葡萄糖用尽时,近平滑假丝酵母开始代谢已经生成的甘露醇,这表明甘露醇作为碳源被消耗用来维持菌体生长,这与Gaspar P[20]报道的同型发酵乳酸菌在培养基中葡萄糖用尽的情况下代谢已经生成的甘露醇的情况相一致。由此可以考虑尝试在发酵中期补充葡萄糖和控制pH等方法来提高甘露醇的产量。

表2 正交实验结果和极差分析Table 2 The results of the orthogonal experiment and range analysis
3 结论

图10 近平滑假丝酵母的发酵曲线Fig.10 The curve of fermentation of C.parapsilosis
从甘蔗汁中筛选出了1株能利用葡萄糖产甘露醇的菌株,经鉴定为近平滑假丝酵母(C.parapsilosis)。通过单因素实验和正交实验,得到其产甘露醇的最佳条件为200 g/L葡萄糖,30 g/L酵母膏,0.05 g/L CaCl2·2H2O,0.02 g/L FeCl3·2H2O,0.5 g/L MgSO4·7H2O,在此条件下摇瓶培养得到的甘露醇产量为61.7 g/L。以葡萄糖为底物要优于以果糖为底物,甘露醇产量在葡萄糖浓度为200 g/L时达到最高,葡萄糖浓度过高反而抑制甘露醇的生成。进行30 L发酵罐分批培养,根据发酵曲线得知72 h时甘露醇最大产量为80.3 g/L。本研究获得的菌株具有应用于实际生产的潜能,其结果为高效、低成本工业化生产和应用奠定了基础,进一步的发酵过程研究目前还在进行中。
[1]Saha B C,Racine F M.Biotechnological production of mannitol and its applications[J].Applied microbiology and biotechnology,2011,89(4):879-891.
[2]汪园.利用生物技术生产甘露醇的研究进展[J].现代食品科技,2006,22(3):291-293.
[3]于冬梅,杜煜光.生物合成法生产D-甘露醇的研究进展[J].农产品加工学刊,2008(1):36-39.
[4]周文英,范家恒.甘露醇工业化制造方法的评述[J].甘蔗糖业,2005(5):46-50.
[5]蒋华.产甘露醇乳酸菌的研究[D].无锡:江南大学,2005:4-5.
[6]Racine F M,Saha B C.Production of mannitol by Lactobacillus intermedius NRRL B-3693 in fed-batch and continuous cell-recycle fermentations[J].Process Biochemistry,2007,42:1 609-1 613.
[7]Song K H,Lee J K,Song J Y,et al.Production of mannitol by a novel strain of Candida magnoliae[J].Biotechnology Letters,2002,24(1):9-12.
[8]Onishi H,Suzuki T.Production of D-mannitol and glycerol by yeasts[J].Applied Microbiology,1968,16(12):1847-1852.
[9]林琳,岳敏,曹海龙,等.产甘露醇菌株的育种研究进展[J].食品工业科技,2012,33(11):426-430.
[10]Yun J W,Kim D H.A comparative study of mannitol production by two lactic acid bacteria[J].Journal of Fermentation and Bioengineering,1998,85(2):203-208.
[11]侯建革,王芳,王丽丽,等.布氏乳杆菌产生甘露醇的发酵研究[J].河北科技大学学报,2010,31(2):132-136.
[12]Song S H,Vieille C.Recent advances in the biological production of mannitol[J].Applied Microbiology and Biotechnology,2009,84(1):55-62.
[13]巴尼特,胡瑞卿.酵母菌的特征与鉴定手册[M].青岛:青岛海洋大学出版社,1991.
[14]袁野,王正祥.产多元醇酵母的耐高渗生长特征[J].无锡轻工大学学报:食品与生物技术,1999,18(3):42-46.
[15]王正祥,诸葛健.酵母细胞渗透压调节与甘油代谢[J].生物工程进展,1999,19(5):34-38.
[16]Lee J K,Oh D K,Song H Y,et al.Ca2+and Cu2+supplementation increases mannitol production by Candida magnoliae[J].Biotechnology Letters,2007,29(2):291-294.
[17]Tang Y,Yue L,Peng C,et al.The affect of growth and phenol degrading on phenol degrading strain XH-10 with different metal ions[J].Bioprocess,2012,2:31-39.
[18]寇明旭,刘全阳.金属离子对活性污泥微生物影响研究进展[J].山西建筑,2007(5):176-177.
[19]Ghoreishi S M,Shahrestani R G.Innovative strategies for engineering mannitol production[J].Trends in Food Science& Technology,2009,20(6):263-270.
[20]Gaspar P,Neves A R,Ramos A,et al.Engineering Lactococcus lactis for production of mannitol:high yields from food-grade strains deficient in lactate dehydrogenase and the mannitol transport system[J].Applied and Environmental Microbiology,2004,70(3):1466-1474.

