解耦联蛋白2在不同年龄大鼠脾、胸腺中的分布与表达
胡祥上 宫德正 易传安 邹 原 (怀化医学高等专科学校基础医学部,湖南 怀化 48000)
衰老又称老化,是指生物体在其生命的后期所进行的全身性、多方面、循序渐进的退化过程,这种退化过程在整体水平、组织细胞水平及分子水平均有体现〔1〕。实验研究表明,由于机体免疫功能随年龄下降,从而导致自身免疫疾病以及癌症发生的增多〔2〕。解耦联蛋白2(UCP2)属于线粒体内膜上质子转运家族中的成员之一,广泛表达于哺乳动物多种组织,其诱导质子漏的一个重要作用是减少线粒体ROS的产生。UCP2的高表达可预防氧化损伤,而抑制UCP2的表达则可在多种细胞类型中促进氧化损伤〔3〕。本研究拟观察不同年龄、生理状态下大鼠脾、胸腺组织中UCP2表达与ROS含量的关系,探讨UCP2在不同生理状态下抗脾、胸腺组织氧化损伤与细胞衰老及免疫功能的关系与作用。
1 材料与方法
1.1 实验动物 健康雄性SD大鼠30只〔由大连医科大学动物实验中心提供,系清洁级动物,实验动物使用许可证号SYXK(辽)2002~0005〕,按年龄分为幼年组〔年龄21 d,体重(82±5)g〕、成年组〔年龄3个月,体重(181±12)g〕和老年组〔年龄18个月,体重(500±20)g〕,每组10只,不同组别动物分笼喂养,动物自由进食进水,室温,自然昼夜。实验室适应性喂养7 d后进行实验,术前禁食12 h。
1.2 主要试剂 UCP2山羊抗人多克隆抗体(Santa Cruz公司,美国)、HRP标记兔抗山羊IgG(Santa Cruz公司,美国)、生物素化兔抗山羊IgG(Santa Cruz公司,美国)、正常兔血清(北京中山生物技术有限公司)、浓缩型SABC试剂盒(武汉博士德生物工程有限公司)、丙二醛测定试剂盒、谷胱甘肽测定试剂盒(南京建成生物工程研究所)、ATP生物试剂盒(碧云天生物试剂公司)。
1.3 方法 ①脾、胸腺组织中MDA、GSH含量的测定:取脾、胸腺组织各0.5 g,分别加入4.5 ml PBS制成10%匀浆,3 000 r/min离心15 min后取上清。按试剂盒说明书操作,测定丙二醛(MDA)和谷胱甘肽(GSH)的含量。上述操作均在冰上进行,用Bradford法测定蛋白含量。②脾、胸腺指数测定:术前禁食、禁水12 h,将大鼠断头处死,采用无菌方法取脾脏和胸腺,用电子天平称重,并计算指数。③免疫组织化学方法检测大鼠脾、胸腺内UCP2蛋白的表达:分别取脾、胸腺组织大约1 cm×1 cm×1 cm,洗净血污,除去结缔组织。10%中性甲醛固定,常规石蜡包埋切片(3~4 μm),贴片(多聚赖氨酸挂片)后烤干。用SABC法进行免疫组织化学检测。常规脱蜡至水;3%过氧化氢甲醇室温孵育15 min,以消除内源性过氧化物酶反应;0.01 mol/L枸橼酸热修复抗原15 min;正常兔血清室温封闭30 min;羊抗UCP2(1∶150)4℃孵育过夜;生物素化兔抗羊IgG(1∶150),室温孵育30 min;SABC 试剂(1∶100)室温孵育30 min;新鲜配制0.05%DAB(含0.01%H2O2)显色,适时用PBS终止反应。以上各步骤间均用PBS-T(0.01mol/L PBS,0.05%Tween-20,pH7.4)清洗切片5 min×4次。乙醇梯度脱水、二甲苯透明、中性树胶封片、光镜下检查并摄片。
1.4 统计学方法 采用SPSS13.0软件,实验数据以s表示,用t检验进行统计分析,组间差异的比较采用方差分析。
2 结果
2.1 不同年龄大鼠脾、胸腺组织内MDA含量的变化 MDA测定结果显示,老年组大鼠脾、胸腺组织中MDA含量〔(14.21±0.81)、(4.22 ±0.26)nmol/mg〕明显高于幼年组〔(13.18 ±2.38)、(2.35±1.05)nmol/mg〕和成年组〔(27.16±0.47)、(16.19 ±2.42)nmol/mg,P <0.01〕。
2.2 不同年龄大鼠脾、胸腺组织GSH含量的变化 不同年龄大鼠脾、胸腺组织GSH测定结果显示,GSH在老年大鼠脾组织中含量较成年大鼠及幼年大鼠显著下降〔(177.09±39.22)vs(285.36±5.01)、(378.85 ±43.23)mg/g,P <0.01〕,在老年大鼠胸腺组织中含量较幼年大鼠显著下降〔(114.61±1.75)vs(225.30±4.54)mg/g,P <0.01〕与成年大鼠无差异〔(120.36±14.93)mg/g,P >0.05〕。
2.3 不同年龄大鼠脾、胸腺指数的变化 不同年龄大鼠脾、胸腺指数测定结果显示,老年大鼠胸腺指数、脾指数均下降〔(16.19±3.42)、(0.85±0.02)mg/g〕。老年大鼠胸腺指数明显低于幼年组和成年组〔(2.35±1.05)、(0.32±0.04)mg/g,(4.22 ±0.26)、(0.24±0.06)mg/g,P <0.01〕。
2.4 不同年龄大鼠脾、胸腺实质细胞UCP2表达的变化 幼年组、成年组大鼠脾、胸腺实质细胞内UCP2表达较少(几乎无表达),而老年组大鼠脾、胸腺实质细胞内UCP2表达较多。见图1。
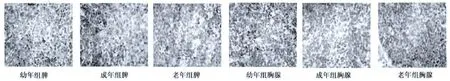
图1 不同年龄组大鼠脾、胸腺细胞UCP2表达的免疫组织化学观察(DAB,×400)
3 讨论
MDA、GSH含量的变化 MDA、GSH含量的多少,均可以反映胸腺内活性氧(ROS)水平〔4,5〕。体内ROS的来源可分为内源性和外源性两方面,其中线粒体膜可产生各种各样的ROS。ROS除了通过氧化损伤对细胞造成直接损伤外,还能启动一系列的衰老信号传导途径,促进细胞衰老〔6〕。本实验结果表明老年大鼠脾、胸腺组织的抗氧化损伤能力降低。
随年龄的增长,机体的免疫功能发生紊乱并逐步衰退。有实验证实〔7〕,衰老使老年人及实验动物的免疫功能下降。衰老大鼠脾淋巴细胞的增殖能力及巨噬细胞的吞噬功能均明显下降〔8〕。IL-2和IL-6是反映机体免疫功能强弱的重要指标,IL-2主要由活化的T细胞产生,IL-6主要由单核巨噬细胞、T细胞、B细胞等产生的细胞因子。IL-2产生减少和IL-6水平异常升高均加速机体的衰老进程〔9,10〕。目前研究认为〔11〕,UCP2 可通过控制细胞ROS水平,反映在巨噬细胞介导的免疫起重要作用。本研究结果,在生理状态下随大鼠年龄的增长,脾、胸腺组织内ROS含量增多,ROS含量增多对 UCP2的表达有激活作用,UCP2的激活又反馈降低细胞内ROS的含量,从而延缓机体衰老,增强机体免疫功能。
研究显示〔12,13〕,在许多细胞内存在 UCP2-ROS 抗氧化系统,UCP2通过降低ROS产生,保护细胞免受ROS诱导的细胞凋亡。随动物年龄增加,体内ROS含量增多,ROS含量对UCP2表达有激活作用〔14〕;UCP2的激活又可以降低细胞内ROS的含量〔15〕。本结果发现老年组大鼠脾、胸腺实质细胞内UCP2表达较多,幼年组和成年组大鼠脾、胸腺实质细胞内UCP2表达较少(甚至无表达)。老年组大鼠脾、胸腺组织ROS增多,引发UCP2的表达增多;UCP2又可以降低ROS对细胞氧化损伤能力,从而对延缓机体由于细胞氧化损伤而引起的衰老有着积极意义。
目前,UCP2调节ROS的机制尚未完全明了,因此,UCP2与ROS、ROS与衰老之间调节及UCP2对免疫功能影响的作用机制有待进一步研究。
1 Frisard M,Ravussin E.Engery metabolism and oxidative stress:impact on the metabolic syndrome and the aging process〔J〕.Endocrine,2006;29(1):27-32.
2 Weng NP.Ageing of the immune system:how much can the adaptive immune system adapt〔J〕.Immunity,2006;24(5):495-9.
3 Cannon R,Shabalina IG,Kramarova TV,et al.Uncoupling proteins a role in protection against reactive oxygen species-or not〔J〕.Biochin Biophys Acta,2006;1757(5-6):449-58.
4 Dey A,Cederbaum AI.Ethanol-induced oxidative stress plays a major role in the mechanisms by which ethanol produces liver injury〔J〕.Hepatology,2006;43(2):63-74.
5 Kassmaul L,Hirst J.The mechanism of superoxide production by NADH:ubiqu in one oxidoreductase(complex I)from bovine heart mitochondria〔J〕.Proc Natl Acad Sci USA,2006;103(20):7607-12.
6 Ishii N.Role of oxidative stress from mitochondria on aging and cancer〔J〕.Comea,2007;26(9 suppl 1):S3-9.
7 Tarazona R,Solana R,Ouyang Q,et al.Basic biology and clinical impact of immunosenescence〔J〕.Exp Gerontol,2002;37:183.
8 陈志宏,谢红林,郭 森,等.中药天年饮对衰老大鼠免疫功能的影响〔J〕.时珍国医国药,2007;18(6):1300-1.
9 Sawin S,Clise-Dwyer K,Haynes L.Homeostasis and the age-associated defect of CD4 T cell〔J〕.Semin Immunol,2005;17(5):370.
10 Huang H,Pate DD,Manton KG.The immun system in aging roles of cytokines T cell and NK cells〔J〕.Front Biosci,2005;10:192.
11 Emere Y,Hutaud C,Nubel T,et al.Mitochondrial contribute to LPS-induced MAPK activation via uncoupling protein UCP2 in macophages〔J〕.Biochem J,2007;402(2):271-8.
12 Lacraz G,Figeac F,Movassat J,et al.Diabetic beta-cells can achieve self-protection against oxidative stress though an adaptive up-regulation of their antioxdant defenses〔J〕.Plos One,2009;4(8):e6500.
13 Galluzzi L,Blomgren K,Kroemer G.Mitochondrial membrane pemeabilization in neuronal injury〔J〕.Nat Rev Neurosci,2009;10(7):481-94.
14 Brand MD,Esteves TC.Physiological functions of the mitochondrial uncoupling proteins 2 and 3〔J〕.Cell Metab,2005;2(2):85-93.
15 Ishizawa M,Mizushige K,Noma T,et al.An antioxidant treatment potentially protects myocardial energy metabolism by requlating uncoupling protein 2 expression in a chronic beta-adrenergic stimulation rat model〔J〕.Life Sci,2006;78(25):2974-82.

