五味子甲素对单核巨噬细胞炎症相关介质表达的影响
杨德峰 刘志辉 陈一夫 吴 凡 陈 曦 (吉林大学第二医院眼科,吉林 长春 3004)
五味子为木兰科植物五味子或华中五味子的干燥成熟果实,是著名的滋补性中药。化学研究证明,五味子的主要化学成分有木脂素,挥发油和多糖〔1~4〕,其次还有有机酸、脂肪油等。其中木脂素包括五味子素、五味子甲素、五味子乙素等20多种成分〔5~7〕。关于五味子木脂素的化学成分及生物活性研究的报道很多,但目前关于五味子木脂素抗炎作用机制的研究尚未见报道。本课题首次对五味子甲素的抗炎免疫作用从细胞及分子水平进行阐述,以期为进一步开发五味子甲素提供理论依据。
1 材料与方法
1.1 动物与试剂 健康昆明种小鼠,体重17~22 g,雌雄各半(吉林医药学院实验动物中心提供);地塞米松磷酸钠注射液(吴中医药公司);小牛血清(杭州四季清);五味子甲素标准品(维克奇生物公司);DMSO(国产);3%巯基乙醇酸钠(实验室自备);青链霉素混合液、IMDM、MTT、PBS、RNA提取试剂盒、RT-PCR试剂盒及DNA-Marker(北京鼎国生物技术有限公司);NO试剂盒(南京建成生物工程研究所);小鼠IL-6、TNF-α检测试剂盒(RND分装)。
1.2 单核巨噬细胞制备 取6~8周龄昆明小鼠5只,每只小鼠腹腔注射3%巯基乙醇酸钠1 ml,饲养3 d。第3天脱颈处死,75%酒精浸泡5 min后,无菌条件下,倒立小鼠并腹腔注入无血清IMDM培养液5 ml,仰卧平放并轻轻揉腹部2 min,用镊子稍提起腹腔,并用剪子剪开一个小口,用吸管轻轻吸取细胞悬液,移入离心管中,1 000 r/min离心5 min,弃去上清。用PBS充分洗涤2次,1 000 r/min离心5 min,弃去上清后显微镜下计数,用IMDM培养液(含10%小牛血清,青链霉素混合液)调整细胞至所需浓度2.5×105,接种于96孔板中,每孔100 μl,置于37℃,5%CO2培养箱中,培养24 h后换液,去除未贴壁细胞备用。
1.3 单核巨噬细胞炎症模型制备 取一板已培养于96孔板的细胞,换液后加药,分为四组:A组:阴性对照组(DMSO),B组:阳性对照组(加地塞米松),C组:模型对照组〔细菌脂多糖(LPS)单独刺激组,LPS终浓度为1.1×10-2〕,D 组:五味子甲素组(终浓度分别是 D1:4×10-5mmol/L、D2:4 ×10-6mmol/L、D3:4 ×10-7mmol/L、D4:4 ×10-8mmol/L,4 组各 0.4 μl),每组为3孔平行,培养24 h。加药后室温静置5 min,加LPS(LPS终浓度为1.1×10-2)。
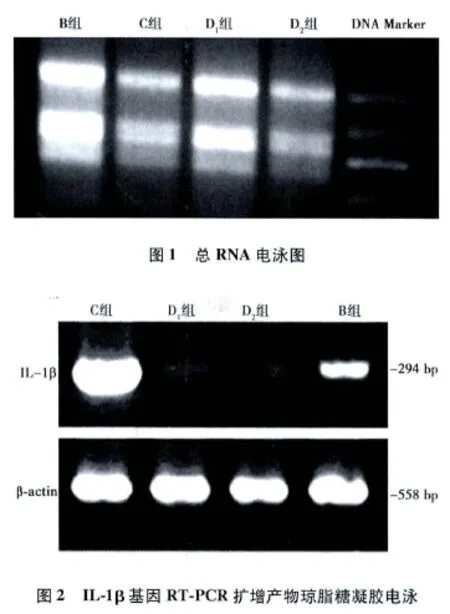
1.4 五味子甲素对单核巨噬细胞中IL-1β mRNA表达的影响提取单核巨噬细胞总RNA经紫外分光光度计测定OD260和OD280,OD260为 0.774 2;OD280为 0.412 1;OD260/OD280=1.876 7,介于1.8~2.2之间。另取出5 μl总RNA样品。在1%普通琼脂糖凝胶图谱中显示28 S、18 S和5 S三条带,并且三条带清晰,其中28 S和18 S宽度及亮度比例基本符合2∶1(图1),表明RNA完整性较好,无明显降解,适合做进一步的实验。其余部分放入-86℃保存。从GenBank中检出小鼠IL-1β基因cDNA序列(IL-1β:基因编号NM008361,cDNA大小为1 328 bp)。选用看家基因 β-actin作为内参照(β-actin:基因编号NM007393,cDNA大小为1 891 bp)。IL-1β的上游引物为5’-ctgaaagctctccacctc-3’,下游引物为5’-tgctgatgtaccagttgggg-3’。βactin的上游引物为5’-gttaccaactgggacgaca-3’,下游引物为5’-aagcctcagggcatcg-3’。按照RT-PCR试剂盒要求进行扩增。扩增产物进行1.0%琼脂糖凝胶电泳,以IL-1β与β-actin灰度值的比值分析IL-1β mRNA的表达量。
1.5 五味子甲素提取物对单核巨噬细胞中IL-6、TNF-α、NO含量的影响 取细胞,加药及分组同1.3。37℃孵育24 h,收集上清,分别严格按照小鼠IL-6、TNF-α及NO定量酶联检测试剂盒使用说明操作。
1.6 统计学分析 利用SPSS13.0软件行t检验。
2 结果
2.1 五味子甲素对小鼠单核巨噬细胞中IL-1β mRNA表达的影响 RT-PCR扩增产物经1%琼脂糖凝胶电泳检测可见清晰的特异性扩增条带(图2),与目的基因片段IL-1β(294 bp)大小相符。五味子甲素组单核巨噬细胞中IL-1β mRNA表达水平(0.327±0.122)明显低于模型对照组(1.025±0.042),阳性对照组单核巨噬细胞中IL-1β mRNA表达水平(0.640±0.019)也明显低于模型对照组,并且五味子甲素组单核巨噬中IL-1β mRNA表达明显低于阳性对照组。
2.2 五味子甲素对单核巨噬细胞中IL-6、TNF-α、NO含量的影响 与模型对照组及空白对照组比较,五味子甲素可明显减少单核巨噬细胞炎症模型上清液中TNF-α、IL-6、NO含量,且呈剂量依赖性。见表1。
表1 五味子甲素对单核巨噬细胞TNF-α、IL-6、NO含量的影响(s,n=5,mmol/L)

表1 五味子甲素对单核巨噬细胞TNF-α、IL-6、NO含量的影响(s,n=5,mmol/L)
与A组比较:1)P<0.05,2)P<0.01
组别 TNF-α 0.042 6±0.000 7 0.072 6±0.000 7 0.530±0.003 B组 0.025 2±0.000 52) 0.045 2±0.000 52) 0.262±0.0032)C组 0.041 9±0.000 5 0.071 9±0.000 5 0.512±0.004 D1组 0.021 6±0.000 32) 0.036 6±0.000 32) 0.211±0.0052)D2组 0.024 6±0.000 22) 0.038 6±0.000 22) 0.240±0.0032)D3组 0.037 2±0.000 21) 0.067 2±0.000 21) 0.402±0.0061)组D4 0.038 5±0.000 21) 0.068 5±0.000 21) 0.461±0.0041)IL-6 NO A组
3 讨论
IL-1β是一类单核细胞因子,具有很高的活性,从细胞中释放出来后表现为全身性激素样介质,在1 ng/L浓度时即可表现出非常强的生物学活性。IL-1β不仅能促进白细胞的聚集,还能直接诱发其他促炎因子的生成,并激活中性粒细胞,使之参与炎症反应。本实验结果说明,五味子甲素能有效抑制单核巨噬细胞中IL-1β mRNA的表达,提示抑制IL-1β分泌是五味子甲素发挥其抗炎作用机制之一。
细胞因子是由某些活化的免疫细胞和基质细胞分泌介导、调节免疫及炎症反应的一类小分子多肽,其中IL-6和TNF-α是最具有影响的介质,可以作为炎症恢复的判断指标,与炎症反应密切相关。其中IL-6具有广泛生物活性的细胞因子,在生物体内可以促进活化的B细胞进一步分化为浆细胞并产生相应的抗体(IgG,IgA和IgM),在机体急性应答中发挥重要的作用,被认为在多种炎症性疾病的病理生理过程中均发挥关键性作用;IL-6还可作用于多个靶细胞,通过调控成熟的炎性细胞作用成分,激活炎性细胞对炎性介质的效应,其作用的机制可能与IL-6改变细胞内G蛋白活性并参与中性粒细胞作用上调有关〔8〕。TNF-α是炎症反应早期最重要细胞因子之一,是一种由活化的单核-巨噬细胞分泌的促炎症因子,具有活化内皮细胞、中性粒细胞等作用,是导致炎性介质级联反应的始发因子。在炎症过程中TNF-α在局部组织中出现较早,并迅速达到高峰,从而诱发“次级”细胞因子如IL-6、IL-1β等的生成,是激活细胞因子级联反应主要介质,增强中性粒细胞的吞噬活性,合成和释放IL-6、IL-1、IL-8等;改变血管内皮细胞骨架,破坏完整性,导致毛细血管通透性增强,中性粒细胞合成和释放TNF,后者反过来促进中性粒细胞聚集,并激活中性粒细胞产生多种炎症介质,他们互相影响,互相作用,加重组织炎症和损伤〔9〕。它还参与免疫反应调节与放大,是炎症反应和免疫系统之间桥梁介质。
NO具有细胞内和细胞间信使以及神经递质作用的信息分子,参与很多病理和生理的过程。在很多组织中,尽管其真正释放量目前很难检测,但已确知会释放出不同浓度NO,并且浓度变化与机体生理机能密切关联。而过多NO通常伴随免疫紊乱和炎症,神经疾病,动脉粥样硬化,疼痛和癌症等〔10〕。NO的生物合成是在一氧化氮合酶(NOS)催化和辅助因子存在下由L-精氨酸与氧分子反应而来。诱导型NOS(iNOS)在静息细胞内不表达,当细胞受到细胞因子、其他微生物或免疫刺激下,iNOS表达才能增加并产生大量NO引起炎症反应〔11〕。NO是一种重要免疫分子和炎症介质,在炎症发展中具有双重作用,一方面通过刺激巨噬细胞诱导受感染细胞死亡和炎症,起到对抗外源性微生物的细胞毒作用,另一方通过促进周边非损伤细胞毒性或细胞炎症,加剧脓毒症,自身免疫或超敏反应的组织损伤〔12〕。本研究首次从分子水平证实了五味子甲素可影响单核细胞巨细胞中细胞因子IL-6,TNF-α,NO的表达,且具有剂量依赖性。
综上结果,推测五味子甲素可能通过抑制IL-1β、TNF-α、IL-6、NO表达等多种途径控制炎症,发挥其抗炎的作用,为进一步开发五味子甲素这种抗炎中药制剂提供理论依据。
1 郑占虎,董泽宏,余 茎.中药现代研究与临床应用(第一卷)〔M〕.北京:学苑出版社,1997:148-56.
2 李玉林.病理学〔M〕.第6版.北京:人民卫生出版社,2005:69-87.
3 Blando F,Gerardi C,Nicoletti I.Sour cherry(Prunus cerasus L)anthocyanins as ingredients for functional foods〔J〕.J Biom Biotech,2004;2004(5):253-8.
4 Seeram NP,Momin RA,Nair MG,et al.Cyclooxygenase inhibitory and antioxidant cyanidin glycosides in cherries and berries〔J〕.Phytomedicine,2001;8(5):362-9.
5 Tall JM,Seeram NP,Zhao C,et al.Tart cherry anthocyanins suppress inflammation-induced pain behavior in rat〔J〕.Behav Brain Res,2004;153(1):181-8.
6 沈映君.中药药理学〔M〕.北京:人民卫生出版社,1996:117.
7(德)沃格尔HQ,(美)沃格尔WH,编著.杜冠华,李学军,张永祥,等译.药理学实验指南——新药发现和药理学评论(Drug discovery and evaluation pharmacological assays)〔M〕.北京:科学出版社,2001:516.
8 Mayer J,Rau B,Gansauge F,et al.Inflammatory mediators in human acute pancreatitis:clinical and pathophysiologic amplications〔J〕.Gut,2000;47(4):546-52.
9 Xiong Z,Kirpalaut H,Tong D,et al.Polymorphonuclear leukocytes as a significant source of tumor necrosis factor-alpha in endotoxin-challenged lung tissue〔J〕.Am L Pathol,1993;143(4):1009-16.
10 Crowell JA,Steele VE,Sigman CC,et al.Is inducible nitric oxide synthase a target for chemoprevention〔J〕.Mol Cancer Ther,2003;2(8):815-23.
11 Panaro MA,Brandonisio O,Acquafredda A,et al.Evidences for iNOS expression and nitric oxide production in the human macrophages〔J〕.Curr Drug Targets Immune Endocr Metabol Disord,2003;3(30):210-21.
12 Ana LV,Margarida GM,Teresa C,et al.Dexamethasone prevents granulocyte/macrophage colony stimulating factor-induced nuclear factor-KB activation,inducible nitric oxide synthase expression and nitric oxide production in a skin dendritic cell line〔J〕.Mediators Inflamm,2003;12(2):71-8.

