牛磺酸联合血管紧张素转化酶抑制剂对大鼠急性肺损伤的保护作用
马晓薇 罗永艾 (重庆医科大学附属第一医院呼吸内科,重庆 400016)
急性肺损伤(ALI)是由多种病因引起的肺泡-毛细血管膜损伤,并伴有肺内大量分流及严重低氧血症的临床综合征〔1〕。目前研究认为其死亡率高的原因与诊断较晚及缺乏新的治疗方法有关。最新研究表明〔2〕,ALI是一种失控的炎症反应,以肺血管内皮细胞(EC)及肺泡上皮广泛损伤为病理特征,中性粒细胞(PMN)于肺内大量羁留是导致上述损伤的关键,并且肺血管内皮细胞损伤在ALI的早期及其发展变化中常伴随着内皮细胞的广泛激活〔3〕。已有研究显示,血管紧张素转化酶抑制剂〔4〕和牛磺酸〔5〕对ALI均有保护作用。本研究通过建立 ALI大鼠的动物模型,观察ALI大鼠内皮活化和损伤的情况以及牛磺酸和ACEI干预后急性肺损伤大鼠内皮细胞的变化情况,探讨血管内皮活化和损伤在ALI中的发生发展机制,并观察牛磺酸联合ACEI可能的肺损伤保护作用。
1 实验材料和方法
1.1 实验材料 健康雄性清洁级SD成年大鼠130只(体重160±20)g(宁夏医科大学实验动物中心提供);脂多糖(L2880,Ecolia O55,B5),购自 Sigma公司;卡托普利原料药(常州制药厂有限公司馈赠);牛磺酸原料药:购自Sigma公司;可溶性细胞间黏附分子-1(sICAM-1)、内皮素-1(ET-1)、血管性血友病因子(vWF)试剂盒购自为民生物有限公司。
1.2 方法
1.2.1 动物模型制备 130只大鼠,随机分为5组,正常对照组(n=10),脂多糖组,牛磺酸组,卡托普利组,牛磺酸和卡托普利组,每组30只,分为5个时间点。脂多糖组:腹腔注射脂多糖0.5 mg/kg,预激12 h,腹腔注射氯胺酮75 mg/kg麻醉后,给予颈静脉置管注射脂多糖5 mg/kg,建立ALI模型。正常对照给予等量生理盐水。牛磺酸组:脂多糖预激后12 h后,同上法麻醉,腹腔注射牛磺酸50 mg/kg,颈内静脉置管注射脂多糖5 mg/kg,3、6、9、12、24 h 时间点采集标本。卡托普利组:脂多糖预激后12 h后,同上法麻醉,腹腔注射卡托普利1.25 mg/kg,颈内静脉置管注射脂多糖 5 mg/kg,3、6、9、12、24 h 时间点采集标本;牛磺酸和卡托普利组:脂多糖预激后12 h后,同上法麻醉,腹腔注射牛磺酸50 mg/kg和卡托普利1.25 mg/kg,颈内静脉置管注射脂多糖 5 mg/kg,3、6、9、12、24 h 时间点采集标本。
1.2.2 标本采集 心脏采血 2 ml,EDTAK2管抗凝,3 000 r/min离心,留取血浆,-80℃低温冰箱保存待检。同时放血处死动物,暴露颈部,气管切开置入插管,结扎右肺,右上肺叶10%中性缓冲甲醛液组织固定后石蜡包埋,切片,HE染色。左肺经气管插管,4℃冰盐水1.5 ml肺泡灌洗,反复回抽3次,留取肺泡灌洗液,3 000 r/min,20 min离心,取上清液,-80℃低温冰箱保存待检。
1.3 检测指标 右上肺叶10%中性缓冲甲醛溶液组织固定后石蜡包埋,切片,HE染色观察肺组织。ELISA法分别检测血浆及肺泡灌洗液中的可溶性细胞间黏附分子-1(sICAM-1)、内皮素-1(ET-1)、血管性血友病因子(vWF):按照试剂盒标准操作步骤进行。
1.4 统计学处理 采用SPSS11.0软件进行,多组均数比较采用单因素方差分析,均数两两比较采用SNK检验。
2 结果
2.1 肺组织病理学变化 光镜下见正常对照组肺组织结构清晰,肺泡腔及支气管腔未见炎症细胞及渗出物。肺损伤组双肺肿胀,体积增大,重量增加,色泽暗淡,肺表面多见散在出血点,部分肺表面可见片状实变和梗死灶,支气管及肺组织切面有白色或淡红色泡沫状液体溢出。光镜下病变广泛,主要表现为肺组织水肿,小血管周围水肿套形成,管壁坏死及肺出血,灶性肺萎陷及肺气肿,较多中性白细胞浸润及部分单核细胞与嗜酸性细胞浸润,偶见微血栓及肺透明膜形成,部分小支气管腔见水肿液和白细胞,个别支气管黏膜坏死和脱落,可见点、片状出血,显示炎症和轻度肺水肿现象,肺泡间隔明显增厚,肺泡腔变窄。牛磺酸组、卡托普利组和牛磺酸及卡托普利组上述病理变化改善,尤其以牛磺酸及卡托普利组上述病理变化改善明显。见图1~图5。
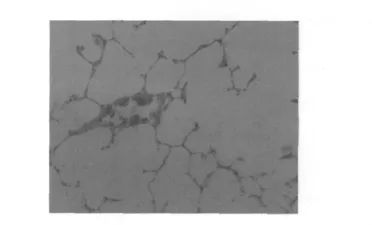
图1 正常对照组肺组织结构(HE,×200)

图2 肺损伤组肺组织病理学变化(HE,×200)
2.2 各组血浆、肺灌注液中sICAM-1水平 血浆中sICAM-1在肺损伤组中所有时间点均较正常值升高,尤以3,6,9,12 h点明显(P<0.01)。其余各治疗组均较肺损伤组下降,但仍较正常值略高(P<0.05)。肺泡灌洗液中sICAM-1在肺损伤组较正常对照组明显升高,尤以3,6 h点明显(P<0.01)。牛磺酸组、卡托普利3,6 h组均较肺损伤组有所下降,并略高于正常对照组,在9、12、24 h点逐渐恢复正常。肺灌洗液中sICAM-1牛磺酸加卡托普利组较肺损伤组下降明显(P<0.05),见表1。
2.3 各组大鼠血浆肺灌洗液ET-1水平 血浆中ET-1肺损伤组在3,6,9,12 h时间点较正常对照组升高,而在24 h升高不明显,各治疗组较肺损伤组略有降低。肺泡灌洗液中ET-1肺损伤组较正常对照组有升高,各治疗组在不同的时间点较损伤组下降,见表2。
2.4 各组大鼠血浆、肺灌洗液vWF水平 血浆中vWF肺损伤组各时间点均较正常对照组升高,各治疗组在不同的时间点较肺损伤组降低(均P<0.01),但仍较正常对照组略高;肺泡灌洗液中肺损伤组各时间点均较正常对照组升高。各治疗组在不同的时间点较损伤组下降,接近正常对照组。见表3。
表1 各组大鼠血及肺灌洗液中sICAM-1水平( s,ng/L)

表1 各组大鼠血及肺灌洗液中sICAM-1水平( s,ng/L)
与正常对照组比较:1)P<0.01,与肺损伤组比较:2)P<0.05,下表同
2 50.09±1.42血浆 215.93±5.23 215.93±5.23 215.93±7.77 215.93±5.23 215.93±5.23肺损伤组 6 肺灌洗液 81.28±18.171) 72.41±5.471) 63.79±6.3011) 67.82±1.901) 65.54±6.241)血浆 351.36±87.161) 335.97±87.161) 293.24±6.251) 281.3±17.491) 404.83±57.371)牛磺酸组 6 肺灌洗液 65.55±8.812) 44.43±1.412) 47.67±0.942) 54.73±5.122) 61.42±11.402)血浆 305.47±76.552) 255.54±21.452) 231.17±19.022) 263.26±43.062) 280.98±39.612)卡托普利组 6 肺灌洗液 52.26±2.162) 60.94±3.072) 59.94±9.092) 49.60±0.612) 48.23±3.302)血浆 267.33±67.192) 312.22±44.652) 274.89±35.282) 226.05±8.322) 299.38±90.292)牛磺酸+卡托普利组 6 肺灌洗液 65.47±0.792) 64.86±10.272) 58.51±6.042) 54.48±12.592) 51.35±2.892)血浆 287.28±88.432) 266.17±54.402) 213.04±33.882) 295.24±62.722) 281.00±43.632)3 h 6 h 9 h 12 h 24 h正常对照组 2 肺灌洗液 50.09±1.42 50.09±1.42 50.09±1.42 50.09±1.4组别 n
表2 各组大鼠血浆、肺灌洗液中ET-1水平(s,μg/L)
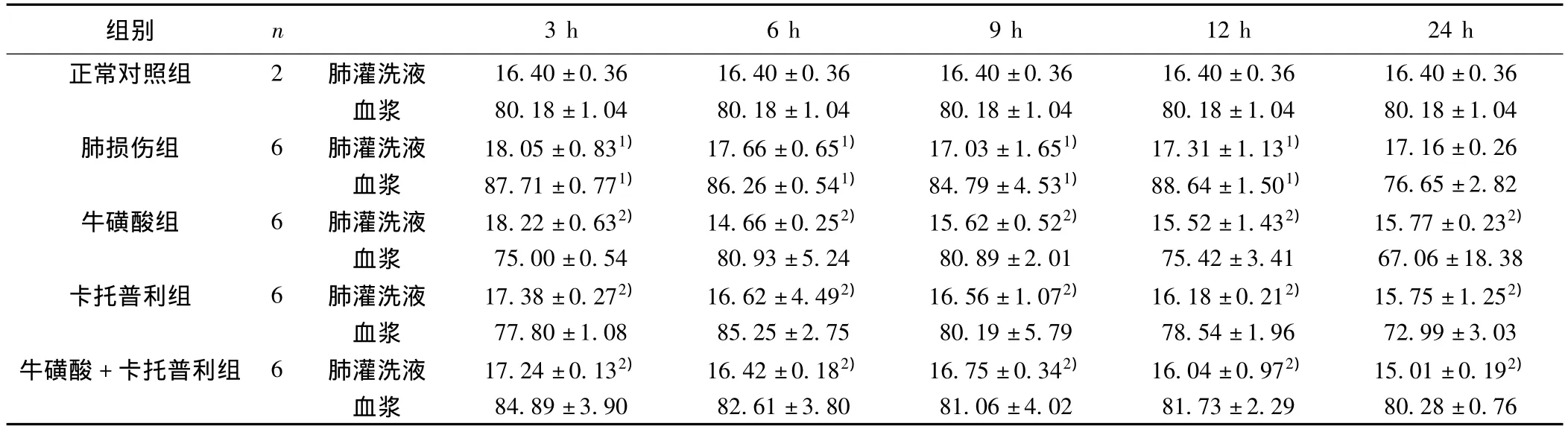
表2 各组大鼠血浆、肺灌洗液中ET-1水平(s,μg/L)
6 16.40±0.36血浆 80.18±1.04 80.18±1.04 80.18±1.04 80.18±1.04 80.18±1.04肺损伤组 6 肺灌洗液 18.05±0.831) 17.66±0.651) 17.03±1.651) 17.31±1.131) 17.16±0.26血浆 87.71±0.771) 86.26±0.541) 84.79±4.531) 88.64±1.501) 76.65±2.82牛磺酸组 6 肺灌洗液 18.22±0.632) 14.66±0.252) 15.62±0.522) 15.52±1.432) 15.77±0.232)血浆 75.00±0.54 80.93±5.24 80.89±2.01 75.42±3.41 67.06±18.38卡托普利组 6 肺灌洗液 17.38±0.272) 16.62±4.492) 16.56±1.072) 16.18±0.212) 15.75±1.252)血浆 77.80±1.08 85.25±2.75 80.19±5.79 78.54±1.96 72.99±3.03牛磺酸+卡托普利组 6 肺灌洗液 17.24±0.132) 16.42±0.182) 16.75±0.342) 16.04±0.972) 15.01±0.192)血浆 84.89±3.90 82.61±3.80 81.06±4.02 81.73±2.2 3 h 6 h 9 h 12 h 24 h正常对照组 2 肺灌洗液 16.40±0.36 16.40±0.36 16.40±0.36 16.40±0.3组别 n 9 80.28±0.76
表3 各组大鼠血浆、肺灌洗液中vWF水平( s,ng/L)

表3 各组大鼠血浆、肺灌洗液中vWF水平( s,ng/L)
±1.82 443.73±1.82血浆 2 305.10±97.01 2 305.10±97.01 2 305.10±97.01 2 305.10±97.01 2 305.10±97.01 LPS组 6 肺灌洗液 765.60±1.541) 697.48±1.341) 687.04±1.8291) 651.48±3.981) 586.29±3.7221)血浆 4 584.40±200.101) 4 950.10±2.941) 4 731.60±3.721) 4 110.10±2.801) 3 511.10±100.521)牛磺酸组 6 肺灌洗液 553.64±125.982) 569.24±38.932) 582.66±34.732) 607.57±63.442) 557.77±20.842)血浆 3 450.90±229.072)3 493.90±151.872)2 924.60±222.882)3 269.80±221.822)2 926.00±387.862)卡托普利组 6 肺灌洗液 705.00±1.652) 623.03±63.792) 642.95±71.942) 576.46±84.022) 538.32±27.042)血浆 2 332.00±257.392)3 496.50±61.042)3 584.30±519.342)3 316.40±173.072)2 883.40±498.112)牛磺酸+卡托普利组 6 肺灌洗液 636.11±96.362) 592.01±12.772) 668.09±289.232) 628.10±72.482) 531.88±75.922)血浆 3 062.00±279.302)3 996.60±297.342)2 898.70±100.802)4 295.00±988.342)2 835.30±107.302)3 h 6 h 9 h 12 h 24 h正常对照组 2 肺灌洗液 443.70±1.82 443.73±1.82 443.73±1.82 443.73组别 n

图3 牛磺酸组肺组织病理学变化(HE,×200)

图4 卡托普利组肺组织病理学变化(HE,×200)

图5 牛磺酸和卡托普利组肺组织病理学变化(HE,×200)
3 讨论
ALI的发病机制复杂,涉及环节多,受损的靶细胞多,虽然目前相应治疗手段已取得了一些进展,但发病率和死亡率仍较高,病死率是30% ~40%〔6〕。炎症反应失控是其中的主要原因,而其导致的弥漫性肺泡损伤是疾病的主要病理特征。目前真正用于临床治疗的有效手段只有小潮气量通气,因而ALI的死亡率居高不下。血管内皮细胞是覆盖于血管内侧面的单层扁平上皮细胞,除对各种大分子物质和血细胞成分进入周围组织起选择性通透屏障作用外,还具有重要的内分泌功能,在调节序贯舒缩状态及通透性、对抗血小板聚集、维持血管壁完整方面均有重要的意义〔7〕。本研究显示在ALI时,肺血管渗漏增加;其次,在ALI时,内皮细胞活化的细胞因子即sICAM-1、ET-1和vWF在血浆及肺泡灌洗液中均升高,随着不同的时间点而不同,在3、6、9 h这三个时间点较为明显,在12、24 h这两个时间点升高的值逐渐下降接近正常。因此,在ALI早期,存在肺血管内皮细胞活化和损伤。如果针对这一环节进行治疗,将会对ALI具有保护作用。
牛磺酸通过其抗氧化作用,调节细胞内钙离子的流动,阻止人内皮细胞功能丧失和细胞死亡,同时还可通过降低白细胞和血管内皮细胞之间的相互作用来阻止白介素-2诱导的肺组织损伤。此外,牛磺酸可显著减轻ALI时PMN的聚集,其机制可能与牛磺酸作为抗氧化剂以抑制NF-κB的活化有关〔8〕。本研究牛磺酸可通过减轻活化的中性粒细胞引起的内皮损伤以及调节细胞内钙离子流量来防止内皮细胞功能障碍,增加中性粒细胞活力,在阻止进一步的肺损伤中起到一定的治疗作用〔9〕。文献报道,牛磺酸治疗后可以减轻内毒素引起的细胞形态和生化方面的改变,因此牛磺酸具有内在的抗炎和抗氧化作用,可以阻止ALI的进一步恶化而起到治疗作用〔4〕。而本实验也验证了牛磺酸对ALI有保护作用,可以降低内皮细胞的损伤和活化。
血管紧张素转化酶抑制剂(ACEI)长期应用于高血压的治疗,在1996年被肯定对血管内皮功能障碍具有改善作用〔10〕。本研究提示血管紧张素转化酶抑制剂对ALI时的内皮细胞活化和损伤有保护作用,其可能的作用机制是通过抑制血管内皮细胞合成血管紧张素Ⅱ(AngⅡ)和ET-1的生成,增加缓激肽的浓度以及降低AngⅡ介导的超氧阴离子的产生,从而减少NO的分解;同时,ACEI可降低内皮细胞的凋亡水平,从而缓解肺血管内皮细胞功能的障碍,改善内皮功能,达到肺保护的作用。此外,ACEI药物如卡托普利抗氧化损伤作用也被大多数学者认同,Ghazi-Khansari等〔11〕研究发现,卡托普利是较强的氧自由基清除剂,此作用与其结构上的巯基(-SH)作用有关。巯基具有抗氧化或吞噬氧自由基的功能,类似于内源性氧自由基捕捉剂谷胱甘肽,从而具有抑制氧化应激的作用。
1 Dunne PJ,Macintyre NR,Schmidt UH,et al.Respiratory care year in review 2011:long-term oxygen therapy,pulmonary rehabilitation,airway management,acute lung injury,education,and management〔J〕.Respir Care,2012;57(4):590-606.
2 Bhargava M,Wendt CH.Biomarkers in acute lung injury〔J〕.Transl Res,2012;159(4):205-17.
3 Parekh D,Dancer RC,Thickett DR.Acute lung injury〔J〕.Clin Med,2011;11(6):615-8.
4 Neyrinck AP,Matthay MA.The role of angiotensin-converting enzyme inhibition in endotoxin-induced lung injury in rats〔J〕.Crit Care Med,2009;37(2):776-7.
5 Bhavsar TM,Cantor JO,Patel SN,et al.Attenuating effect of taurine on lipopolysaccharide-induced acute lung injury in hamsters〔J〕.Pharmacol Res,2009;60(5):418-28.
6 Hough CL,Herridge MS.Long-term outcome after acute lung injury〔J〕.Curr Opin Crit Care,2012;18(1):8-15.
7 Shen Y,Wang D,Wang X.Role of CCR2 and IL-8 in acute lung injury:a new mechanism and therapeutic target〔J〕.Expert Rev Respir Med,2011;5(1):107-14.
8 Parvez S,Tabassum H,Banerjee BD,et al.Taurine prevents tamoxifen-induced mitochondrial oxidative damage in mice〔J〕.Basic Clin Pharmacol Toxicol,2008;102(4):382-7.
9 Abreu SC,Antunes MA,Pelosi P,et al.Mechanisms of cellular therapy in respiratory diseases〔J〕.Intensive Care Med,2011;37(9):1421-31.
10 Kuba K,Imai Y,Penninger JM.Angiotensin-converting enzyme 2 in lung diseases〔J〕.Curr Opin Pharmacol,2006;6(3):271-6.
11 Ghazi-Khansari M,Nasiri G,Honarjoo M.Decreasing the oxidant stress from paraquat in isolated perfused rat lung using captopril and niacin〔J〕.Arch Toxicol,2005;79(6):341-5.

