β-连环素对人羊膜间充质干细胞增殖的影响*
张一折,芦俊萍,张东丽,梁 硕,迟连凯,赵永辉,王满仓,何 涛,乔露华,田 毅,杨 波,马 轩,关方霞#
1)郑州大学生物工程系 郑州 450001 2)郑州大学第一附属医院神经外科 郑州 450052
羊膜间充质干细胞(amniotic membrane derived mesenchymal stem cells,AMSC)是近年来备受关注的一种新型干细胞。它具有分离培养容易、增殖快、不受伦理学限制等优越性,同时呈现出低免疫原性与免疫抑制作用,体外诱导可以多向分化,是非常理想的干细胞来源。Wnt/β-连环素(β-catenin)信号是调控神经前体细胞谱系分化、神经发育及成体脑中再生神经元成熟的重要通路[1-2],其中β-catenin的表达水平直接决定神经前体细胞(neural precursor cell,NPC)的增殖与分化[3]。Wnt属分泌型糖蛋白,与细胞表面受体结合后,抑制细胞内糖原合成酶激酶-3β (GSK-3β) 活性,引起β-catenin在胞质内积累并进入细胞核,与淋巴样增强因子/T细胞因子(LEF/TCF)结合,激活转录因子,诱导相应的靶基因c-myc、neurogenins、Neuro D等表达,从而对细胞增殖分化进行调节。近来研究[4-5]发现:β-catenin活化的骨髓间充质干细胞能刺激造血干细胞的增殖,改善干细胞微环境,稳定的β-catenin表达是长期维持造血干细胞更新的基础。AMSC具有神经细胞生物学特性,能向神经元定向诱导。然而,β-catenin对AMSC增殖和分化的体内外调控作用尚不清楚。该实验旨在构建介导AMSC β-catenin高表达的重组腺病毒载体,研究其对AMSC增殖的影响。
1 材料与方法
1.1材料正常足月剖宫产胎儿的胎盘(郑州大学第一附属医院妇产科提供),HEK293细胞(郑州大学基础医学院韩圣娜副教授惠赠),pAd-β-catenin-GFP重组腺病毒(由郑州大学生物工程系细胞生物学研究室构建并保存),DMEM/F12培养基(购自赛默飞世尔生物化学制品有限公司),胎牛血清(购自杭州四季青生物工程材料有限公司);胰蛋白酶(购自Solarbio 公司),鼠抗β-catenin 单克隆抗体、鼠抗GSK-3β单克隆抗体(均购自Santa Cruz公司),鼠抗β-actin 单克隆抗体、HRP 标记山羊抗小鼠二抗、蛋白质Marker(购自北京鼎国昌盛生物公司)。
1.2人AMSC的分离与培养无菌条件下取正常足月剖宫产胎儿的胎盘,钝性分离胎盘脐带面的羊膜约10 cm×10 cm,用PBS缓冲液充分冲洗,然后将羊膜尽可能剪碎,加入2.5 g/L的胰蛋白酶,37 ℃消化30 min,终止消化后将液体倒掉,再以终质量浓度为1.0 g/L 胶原酶37 ℃消化90 min。过200目不锈钢网将消化下来的细胞制成单细胞悬液,1 300 r/min离心8 min收集细胞,接种于75 mL培养瓶内,置37 ℃培养箱中培养48~72 h后,更换培养液,弃去未贴壁的细胞,根据细胞生长情况,每3~4 d全量换液1次。待细胞达到80%~90%融合时,用2.5 g/L的胰蛋白酶消化。用倒置显微镜观察细胞消化情况,待细胞大部分胞体回缩、变圆,即终止消化,然后分为2~3份进行传代接种培养,并记为P1代。传代培养过程中每2~3 d全量换液,直至贴壁细胞彼此融合,铺满瓶底,再重复上述操作,传代培养记为P2代,其余类推。取P3代以后细胞用于实验操作。
1.3重组pAd-β-catenin-GFP腺病毒的扩增、纯化
HEK293细胞于75 mL培养瓶生长至丰度为70%左右时,以构建好的腺病毒原液5 μL进行感染,以未加腺病毒的正常培养细胞为对照。培养24 h后,于倒置相差显微镜下观察细胞形态变化,并于荧光显微镜下观察GFP的荧光现象。
1.4重组pAd-β-catenin-GFP腺病毒感染AMSC后细胞生长状态的测定AMSC铺满瓶底70%左右时,向75 mL培养瓶中加入100 μL腺病毒悬液,轻轻晃动瓶子,使混匀。以未加腺病毒的正常培养细胞作对照。感染24 h后,接种于96孔培养板,设3个复孔,接种后24 h采用CKK-8法测板,连测5 d。测定前每孔加入10 μL CKK-8溶液于37 ℃细胞培养箱继续孵育2 h,使用多功能酶标仪在450 nm波长读取吸光度值(A)并计算重组腺病毒稳定表达的AMSCs的增殖率。增殖率=(腺病毒感染组A值/对照组A值-1)×100%。
2 结果
2.1重组pAd-β-catenin-GFP腺病毒的扩增重组腺病毒感染HEK293细胞24 h后,倒置相差显微镜下观察细胞出现病变现象,主要变化为细胞伪足缩短、变圆、有部分细胞脱落,与对照组细胞形态明显不同(图1A和B)。同时荧光显微镜下能看到荧光现象(图1C)。重组腺病毒在HEK293细胞中得以大量扩增。
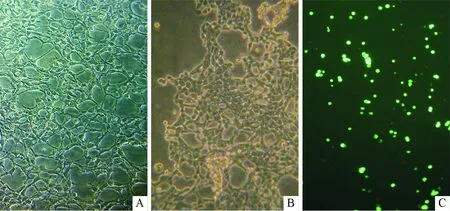
图1 HEK293细胞形态(×100)
2.2AMSCs中β-catenin表达的荧光检测结果GFP标记的含β-catenin的重组腺病毒感染AMSC 48 h后,倒置相差显微镜下观察,发现感染组细胞与对照组细胞相比没有明显的形态变化,但数量上稍有增加(图2A和B),在荧光显微镜下能看到大量的荧光现象(图2C)。
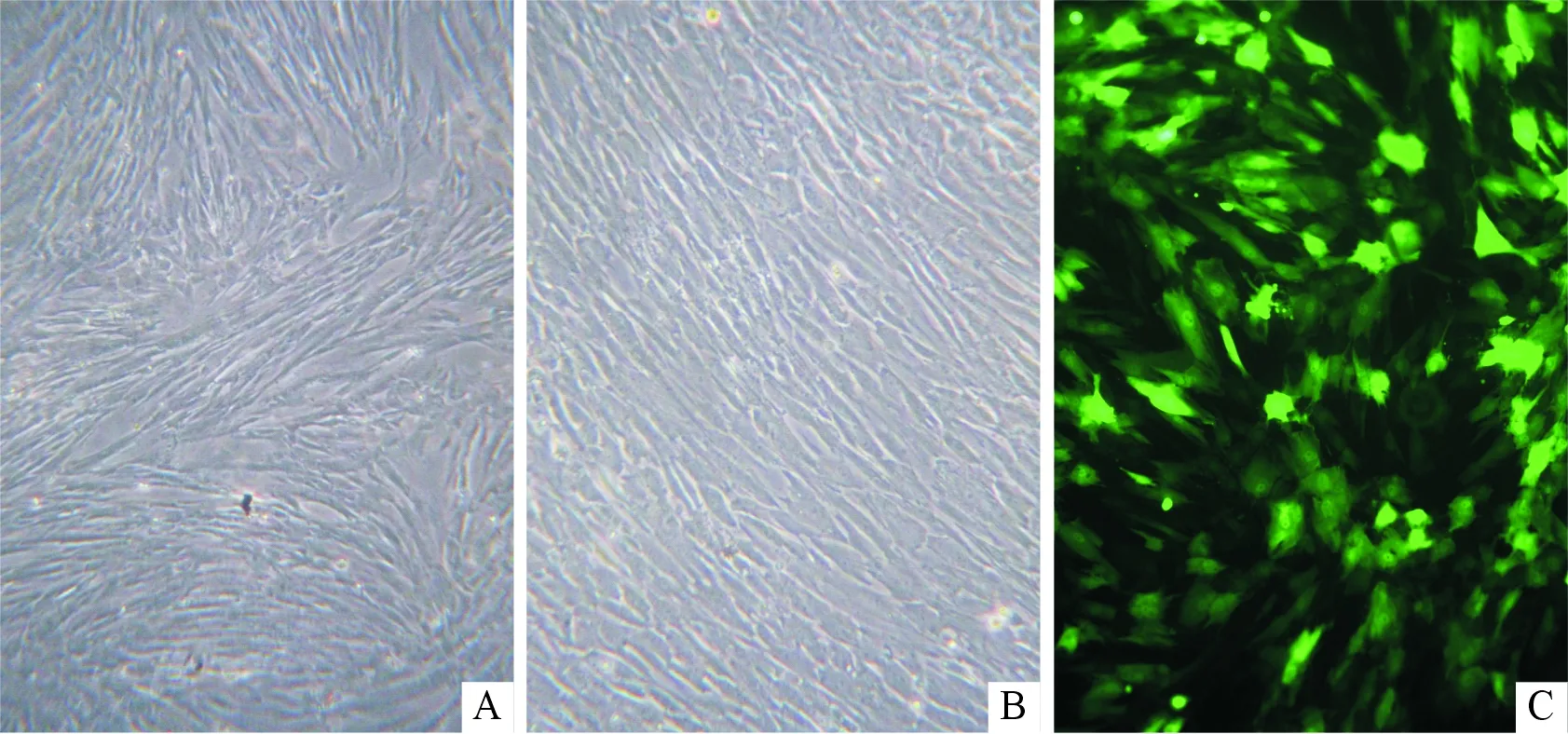
图2 AMSC形态(×100)
2.3重组pAd-β-catenin-GFP腺病毒感染AMSC后细胞生长状况的测定结果结果显示,第1~5天,β-catenin稳定高表达的AMSCs增殖率分别为50.0%、82.5%、92.6%、169.1%和128.2%,明显高于正常的AMSCs,说明高表达的β-catenin能有效地刺激AMSCs的增殖。
3 讨论
β-catenin在胞质中的含量升高积累,促使它可以进一步移位至细胞核内与T细胞因子形成复合物,从而激活Wnt靶基因的转录,调控细胞生长;另外,β-catenin在胞质内可与钙粘素和细胞骨架蛋白结合维持其稳定性,β-catenin的表达水平决定神经系统中NPC和神经干细胞(neural stem cell,NSC)的增殖与分化[6]。
脐血间充质干细胞、经血间充质干细胞、脂肪间充质干细胞、骨髓间充质干细胞、神经干细胞向神经元分化以及胚胎干细胞的早期增殖与Wnt 信号通路有关[7],而关于AMSC增殖、分化调控的明确机制无相关文献报道。
β-catenin作为Wnt 信号途径的关键成员,通过正、负反馈调节干细胞的数量,在内外因素中都发挥着重要的作用[8-9]。细胞内游离β-catenin在没有Wnt 信号刺激的情况下很容易被胞内降解系统所降解,极不稳定,细胞中仅有少量的β-catenin以保证正常细胞的生理生化功能,不至于成瘤化[10],所以引入外源的β-catenin或阻碍胞质内β-catenin的磷酸化与降解,都可以进一步促使β-catenin在胞质内的积累,达到一定量后进入细胞核。从某种程度上来说β-catenin的入核意味着Wnt/β-catenin信号通路的激活。β-catenin作为把核外信号传递到核内的信号蛋白,在Wnt信号通路中处于关键地位,该蛋白的表达水平直接影响Wnt信号通路的生物学效应。
GFP能够在紫外线的激发下发出明亮的绿色荧光[11],被认为是一种理想的报道基因,是研究细胞基因表达和表达产物分布的最好工具[12]。作者将GFP基因融合在β-catenin基因的5’端,既保留了β-catenin的转录激活功能,又能通过GFP直接观察β-catenin在活细胞内的分布和表达。
腺病毒载体能够感染多种哺乳动物细胞,宿主范围广,包装容量大,对人致病性低,携带的外源基因在靶细胞内以附加体形式存在,并不整合到宿主染色体中,具有极低的插入突变危险性和较低的遗传毒性;转移效率高,容量大,无需辅助病毒,可插入外源基因的片段达7~8 kb;对于细胞是否处于分裂期无严格要求,能够在增殖和非增殖细胞中感染和表达基因;同时制备简单,可以通过超离心得到高滴度的病毒[13]。
该研究通过建立GFP标记、重组腺病毒载体介导β-catenin高表达的AMSC和体外调控β-catenin的表达,研究了经典Wnt信号通路中的β-catenin对AMSC增殖的影响。通过荧光显微镜检测显示pAd-β-catenin-GFP重组腺病毒感染AMSC后,外源β-catenin于AMSC中成功表达,且外源β-catenin对AMSC的增殖有促进作用,明显高于对照组。
总之,该研究为了解β-catenin在AMSC细胞增殖和分化中的调节作用提供了实验支持,并为优化AMSC在中枢神经性疾病中的临床治疗效果奠定了重要的实验基础。
[1]Lie DC, Colamarino SA, Song HJ, et al. Wnt signalling regulates adult hippocampal neurogenesis[J]. Nature, 2005, 437(7063):1370
[2]Hirsch C, Campano LM, Wohrle S,et al. Canonical Wnt signaling transiently stimulates proliferation and enhances neurogenesis in neonatal neural progenitor cultures[J]. Exp cell Res, 2007,313(3):572
[3]Zechner D, Fujita Y, Hülsken J, et al. Beta-Catenin signals regulate cell growth and the balance between progenitor cell expansion and differentiation in the nervous system[J]. Dev Biol, 2003, 258 (2):406
[4]Nemeth MJ, Mak KK, Yang Y, et al. Beta-Catenin expression in the bone marrow microenvironment is required for long-term maintenance of primitive hematopoietic cells[J]. Stem Cells, 2009, 27 (5): 1109
[5]Ahn JY, Park G, Shim JS, et al. Intramarrow injection of beta-catenin-activated, but not naive mesenchymal stromal cells stimulates self-renewal of hematopoietic stem cells in bone marrow[J]. Exp Mol Med, 2010, 42(2):122
[6]Li J, Zhou BP. Activation of β-catenin and Akt pathways by Twist are critical for the maintenance of EMT associated cancer stem cell-like characters[J]. BMC Cancer,2011, 11:49
[7]Kahlert UD, Maciaczyk D, Doostkam S, et al. Activation of canonical WNT/β-catenin signaling enhances in vitro motility of glioblastoma cells by activation of ZEB1 and other activators of epithelial-to-mesenchymal transition[J].Cancer Lett,2012,325(1):42
[8]Fraser A. RNA interference: human genes hit the big screen[J]. Nature, 2004, 428(6981):375
[9]Harmer D,Gilbert M,Borman R,et al.Quantitative mRNA expression profiling of ACE2, a novel homologue of angiotensin converting enzyme[J].FEBS Lett,2002,532(1/2):107
[10]King TD,Suto MJ,Li Y.The Wnt/β-catenin signaling pathway:a potential therapeutic target in the treatment of triple negative breast cancer[J].J Cell Biochem,2012,113(1):13
[11]崔柳青,张璐,张磊,等.杜氏盐藻葡萄糖-6-磷酸异构酶在真核细胞中的表达[J]. 郑州大学学报:医学版,2012,47(4):434
[12]王博蔚,高尚,朱振威,等.脂质体法介导pIRES2-EGFP-hVEGF165转染人胎盘源间充质干细胞[J].吉林大学学报:医学版,2012,38(2):270
[13]Rodríguez ES, Pose AG, Moltó MP, et al.Biosafety evaluation of recombinant protein production in goat mammary gland using adenoviral vectors: preliminary study[J]. Biotechnol J,2012,7(8):1049

