澳洲茄胺单糖苷的合成及其抗肿瘤活性*
丁 丹, 沈平孃, 祁双红, 汤秀珍, 邹莲华, 杜晨杰, 卓 超
(1. 华东理工大学 药学院,上海 200237; 2. 国家中药制药技术工程研究中心,上海 201203)
茄科类植物龙葵是我国民间常用于治疗肿瘤的一种草药[1]。 龙葵提取物中主要成分为澳洲茄边碱和澳洲茄碱,它们是澳洲茄胺(4)的两个三糖苷化合物,对多种肿瘤细胞具有明显的抑制作用[2~6]。近年来,国内外关于甾体糖苷的合成,抗肿瘤活性及其作用机制的研究较多[7~11]。然而关于4的糖甙化和结构修饰的报道不多。本课题组对4进行3-位糖甙化合成,并筛选抗肿瘤活性,探索在4的3-位羟基引入不同的单糖对抗肿瘤活性的影响。
本文以单糖[D-葡萄糖(1a), D-半乳糖(1b), L-鼠李糖(1c), D-氨基葡萄糖(1d)和L-阿拉伯糖(1e)]进行4的单糖苷化。1a~1e经苯甲酰化保护及溴代制得中间体酰化溴代糖3a~3e。用Koenigs-Knorr合成法将3a~3e与4进行甙化缩合及脱保护基反应合成了5个澳洲茄

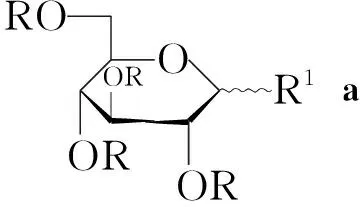

Ar=
Scheme1
胺单糖苷(5a~5e, Scheme 1),其结构经1H NMR,13C NMR和MS表征。其中5a和5b分别是γ-solamargine和γ-solasonin属天然澳洲茄胺单糖苷,而5c, 5d和5e是非天然澳洲茄胺糖苷化合物,5d和5e是新化合物。采用MTT法对人肺癌细胞(A549),人肝癌细胞(QGY7703),人白血病细胞(HL-60),人肠癌细胞(Colo205)和人乳腺癌细胞(MDA-MD-435,231)进行了体外抗肿瘤活性试验。结果显示在4的3-位引入不同的单糖,增强了其抗肿瘤活性, 其中5c和5d的活性要强于5a, 5b和5e; 5d对MDA-MB-231和HL-60有较好的抑制活性。
1 实验部分
1.1 仪器与试剂
SGW X-4型显微熔点仪(温度未校正);Brukor AVANCE(400 MHz或100 MHz)型核磁共振仪(DMSO-d6为溶剂,TMS为内标);HP5989A型低分辨质谱仪(EI-MS); Finigann MAT 8401型高分辨质谱仪(HR-MS); WellscanMK-2型全自动酶标仪。
培养液(RPMI1640+10%FBS+双抗),A549, QGY7703, HL-60, Colo205和MDA-MB-435,231,上海医药工业研究院;其余所用试剂均为分析纯。
1.2 合成
(1)3的制备(以3a为例)
在反应瓶中加入1a4 g(22 mmol),二氯甲烷60 mL和三乙胺13.6 g(130 mmol),搅拌下于-4 ℃滴加苯甲酰氯14.3 mL(120 mmol),滴毕,于室温反应16 h。加水60 mL和二氯甲烷30 mL,分液,有机层依次用水,稀盐酸,饱和NaHCO3溶液和饱和NaCl溶液洗涤,无水MgSO4干燥,旋干溶剂得黄色浆状粗品,丙酮/水重结晶得白色固体1,2,3,4,6-五-O-苯甲酰-β-D-葡萄糖(2a)10.8 g。
在反应瓶中加入2a10.8 g(15.4 mmol)和二氯甲烷70 m,冰浴冷却,搅拌下滴加30%溴化氢5.5 mL(30.0 mmol)的醋酸溶液,滴毕,于室温反应8 h。加冰水50 mL,依次用冰水(3×50 mL),饱和碳酸氢钠溶液(4×55 mL)和饱和NaCl溶液(2×55 mL)洗涤,无水MgSO4干燥,旋干溶剂得浅黄色浆状粗品,用乙醚/石油醚重结晶得白色粉末1-溴-2,3,4,6-四-O-苯甲酰-α-D-吡喃葡萄糖(3a)6.48 g。
用类似的方法合成白色固体3b~3e。
3a: 收率45.0%(以1a计,下同),m.p.128 ℃~129 ℃,;1H NMR(CDCl3)δ: 6.89(d,J=4.0 Hz, 1H, 1-H), 5.36(dd,J=10.0 Hz, 4.0 Hz, 1H, 2-H), 5.85(t,J=10.0 Hz, 1H, 3-H), 6.29(t,J=10.0 Hz, 1H, 4-H), 4.76(m, 1H, 5-H), 4.69(dd,J=12.4 Hz, 2.4 Hz, 1H, 6-Ha), 4.53(dd,J=12.4 Hz, 2.4 Hz, 1H, 6-Hb)。
3b: 收率67.2%, m.p.130 ℃~132 ℃;1H NMR(CDCl3)δ: 8.10~7.26(m, 20H, PhH), 7.00(d,J=4.0 Hz, 1H, 1-H), 6.14 (d,J=3.2 Hz, 1H, 2-H), 6.08(dd,J=10.4 Hz, 3.2 Hz, 1H, 3-H), 5.70(dd,J=10.8 Hz, 3.6 Hz, 1H, 4-H), 4.95(t,J=6.0 Hz, 1H, 5-H), 4.67(dd,J=12.0 Hz, 6.8 Hz, 1H, 6-Ha), 4.49(dd,J=11.2 Hz, 6.0 Hz, 1H, 6-Hb)。
3c: 收率73.9%, m.p.162 ℃~164 ℃;1H NMR(CDCl3)δ: 8.11~7.29 (m, 15H, Bz-H), 6.57(s, 1H, 1-H), 6.21(dd, 1H, 3-H), 5.89(dd, 1H, 2-H), 5.79(t, 1H, 4-H), 4.44 (m, 1H, 5-H), 1.44(d, 3H, CH3); EI-MSm/z: 459.1[M-79(-Br)]。
3d: 收率71.4%, m.p.126 ℃~127 ℃;1H NMR(CDCl3)δ: 8.16~7.23(m, 20H, PhH), 6.39(d,J=7.2 Hz, 1H, 1-H), 5.92(d,J=8.6 Hz, 1H, NH), 5.64(d,J=8.0 Hz, 1H, 2-H), 5.94(s, 1H, 3-H), 4.68(m, 1H, 4-H) , 4.06(m, 1H, 5-H), 4.69(dd, 1H, 6-Ha), 4.52(dd, 1H, 6-Hb);13C NMR(CDCl3)δ: 166.1, 165.1, 165.0, 164.7, 133.5, 133.4, 133.1, 132.3, 130.0, 129.7, 129.5, 129.3, 129.1, 128.7, 128.6,128.5, 128.4, 128.3, 126.4, 99.8(C1), 69.6(C3), 68.4(C2), 68.3(C4), 64.5(C6), 64.2 (C5)。
3e: 收率35.0%, m.p.122 ℃~125 ℃;1H NMR(CDCl3)δ: 6.68(d,J=3.6 Hz, 1H, 1-H), 5.80(s, 1H, 4-H), 5.78(dd, 1H, 3-H), 4.44(dd, 1H, 2-H), 4.29(dd, 1H, 5-Ha), 4.11(dd, 1H, 5-Hb);13C NMR(CDCl3)δ: 166.1, 165.9, 165.7, 133.5, 133.4, 133.2, 129.9, 129.8, 129.7, 129.6, 129.2, 128.9, 128.6, 128.5, 128.4, 128.3, 91.3(C1), 70.2( C5), 69.7(C2), 67.7( C4), 60.6( C3)。
(2)5的制备(以5a为例)
在反应瓶中加入3a2.1 g(3.2 mmol), 4 0.73 g(1.77 mmol)和无水二氯甲烷45 mL,搅拌至澄清。加入活化4Å分子筛7 g,氮气保护下于-10 ℃慢慢加入AgSO3CF30.82 g(3.19 mmol)的无水甲苯(8 mL)溶液,于室温反应2 h。加入二氯甲烷40 mL,抽滤,旋干滤液得黄色糖浆状粗品,经硅胶柱层析[洗脱剂:A=V(二氯甲烷) ∶V(甲醇)=45 ∶1]分离得3β-O-(2,3,4,6-四-O-苯甲酰-β-D-葡萄糖)-solasodine(A)0.88 g。
在反应瓶中加入A 1.2 g(1.71 mmol),甲醇15 mL和1 mol·L-1NaOH的甲醇(6.8 mL, 6.8 mmol)溶液,搅拌下于室温反应3 h。旋干溶剂后经硅胶柱层析(洗脱剂:A=10 ∶1)分离得白色固体3β-O-β-D-葡萄糖-solasodine(5a)0.53 g。
用类似的方法合成白色固体5b~5e。
5a: 收率52.4%(以3a计,下同),m.p.153 ℃~154 ℃;1H NMRδ: 5.34(d, 1H, 6-H), 4.89(d,J=4.8 Hz, 1H, 1′-H), 4.86(dd, 1H, 2′-H), 4.43(t, 1H, 3′-H), 4.22(d, 1H, 4′-H), 3.65(dd, 1H, 6′-Ha), 3.48(m, 1H, 3-H), 3.42(dd, 1H, 6′-Hb), 3.15(m, 1H, 5′-H), 1.23(d, 3H, 21-CH3), 0.98(s, 3H, 19-CH3), 0.87(d, 3H, 27-CH3), 0.76(s, 3H, 18-CH3);13C NMR(CD3OH)δ: 140.6(C5), 120.9(C6), 101.1(C1′), 98.9(C22), 83.3(C16), 78.3(C2′), 76.6(C3′), 76.4(C4′), 73.3(C3), 70.2(C5′), 61.5(C17), 61.3(C6′), 56.2(C14), 50.1(C9), 45.3(C26), 41.4(C13), 40.7(C12), 38.9(C4), 38.2(C10), 37.1(C1), 36.6(C20), 31.8(C8), 31.6(C15), 31.7(C7), 31.3(C25), 29.2(C23), 28.0(C24), 27.4(C2), 20.4(C11), 18.4(C19), 17.2(C27), 15.1(C18), 13.3(C21); EI-MSm/z: 575.4(M+)。
5b: 收率77.7%, m.p.185 ℃~187 ℃;1H NMRδ: 5.40(t, 1H, 6-H), 4.73(d,J=4.0 Hz, 1H, 1′-H), 4.67(d, 1H, 2′-H), 4.53(m, 1H, 5′-H), 4.32(d, 1H, 3′-H), 4.17(d, 1H, 4′-H), 3.60(m, 1H, 6′-Ha), 3.50(m, 1H, 3-H), 3.43(m, 1H, 6′-Hb), 1.16(d, 3H, 21-H), 1.08 (s, 3H, 19-H), 1.01(d, 3H, 27-H), 0.86(s, 3H, 18-H);13C NMR(CD3OH)δ: 140.7(C5), 120.9(C6), 101.7(C1′), 98.9(C22), 83.2(C16), 78.3(C2′), 75.1(C3′), 73.6(C3), 71.2(C4′), 68.9(C5′), 61.5(C17), 61.1(C6′), 56.2(C14), 50.1(C9), 45.3(C26), 41.4(C13), 40.7(C12), 38.9(C4), 38.3(C10), 37.1(C1), 36.6(C20), 31.8(C8), 31.6(C15), 31.7(C7), 31.3(C25), 29.3(C23), 28.1(C24), 27.5(C2), 20.4(C11), 18.4(C19), 17.2(C27), 15.1(C18), 13.3(C21); EI-MSm/z: 576.0(M++1)。
5c: 收率78.7%, m.p.176 ℃~178 ℃(180 ℃~181 ℃[11]);1H NMR(CD3OH)δ: 5.40(d, 1H, 6-H), 4.86(d, 1H, 1′-H), 3.67(dd, 1H, 2′-H), 3.66(dd, 1H, 3′-H), 3.45(m, 1H, 3-H), 3.38(t, 1H, 4′-H), 3.33(m, 1H, 5′-H), 1.26(d, 3H, 6′-CH3), 1.06(d, 3H, 21-CH3), 0.97(s, 3H, 19-CH3), 0.89(d, 3H, 27-CH3), 0.76(s, 3H, 18-CH3);13C NMR(CD3OH)δ: 140.4(C5), 121.1(C6), 98.8(C1′), 98.3(C22), 82.9(C16), 72.7(C3), 71.3(C2′), 76.5(C4′), 71.0(C3′), 68.5(C5′), 61.6(C17), 56.2(C14), 50.1(C9), 45.5(C26), 41.4(C13), 40.7(C12), 38.9(C4), 38.2(C10), 37.1(C1), 36.6(C20), 32.0(C8), 31.7(C7), 31.6(C15), 31.2(C25), 29.2(C23), 28.2(C24), 27.7(C2), 20.5(C11), 18.4(C19), 17.3(C27), 16.6(C6′), 15.2(C18), 13.4(C21); EI-MSm/z: 560.0(M++1)。
5d: 收率66.1%, m.p.184 ℃~185 ℃;1H NMRδ: 8.16~7.48(m, 5H, PhH), 8.57(s, 1H, NH), 5.96(t,J=10.0 Hz, 1H, 4′-H), 5.58(t,J=9.6 Hz, 1H, 3′-H), 5.23(s, 1H, 6-H), 5.10(d,J=8.4 Hz, 1H, 1′-H), 4.22(t,J=8.4 Hz, 1H, 2′-H), 4.22(t, 1H, 5′-H), 4.53(dd, 1H, 6′-Ha), 4.46(dd, 1H, 6′-Hb), 3.47(m, 1H, 3-H), 1.13(d, 3H, 21-CH3), 0.86(s, 3H, 19-CH3), 0.79(d, 3H, 27-CH3), 0.72(s, 3H, 18-CH3);13C NMR(CD3OH)δ: 169.5(PhCO), 140.5(C5), 121.1(C6), 134.9, 131.2, 128.2, 121.0, 100.0(C1′), 98.4(C22), 81.2(C16), 79.1(C2′), 76.5(C3), 74.4(C3′), 70.9(C4′), 62.1(C6′), 61.5(C5′), 56.9(C17), 56.2(C14), 50.1(C20), 46.3(C9), 46.1(C26), 41.4(C4), 40.5(C12), 39.2(C13), 38.8(C1), 37.0(C8), 36.5(C15), 32.7(C7), 31.7(C2), 31.3(C23), 29.3(C25), 29.0(C24), 20.5(C11), 18.5(C19), 17.9(C18), 15.4(C21), 13.8(C27); HR-MS: Calcd for C40H58N2O7(M+) 678.424 4, found 678.424 3。
5e: 收率65.9%, m.p.136 ℃~138 ℃;1H NMR(CD3OH)δ: 5.51(s, 1H, 1′-H), 5.39(d, 1H, 6-H), 4.32(m, 1H, 4′-H), 3.86(dd, 1H, 3′-H), 3.82(s, 1H, 2′-H), 3.38(s, 1H, 3-H), 3.53(m, 2H, 5′-Hb, Ha), 1.07(s, 3H, 19-H), 1.06(d, 3H, 21-CH3), 0.92(d, 3H, 27-CH3), 0.86(s, 3H, 18-CH3);13C NMR(CD3OH)δ: 140.6(C6), 121.0(C5), 101.7(C1′), 98.4(C22), 78.3(C16), 72.9(C3), 71.0(C2′), 68.3(C3′), 65.5(C4′), 62.1(C17), 56.5(C14), 52.2(C5′), 50.2(C9), 46.4(C26), 41.4(C13′), 40.4(C4), 39.3(C12), 38.3(C10), 37.1(C20), 36.6(C15), 31.7(C25), 31.6(C8), 31.3(C7), 29.3(C23), 28.1(C24), 20.5(C11), 18.4(C19), 17.8(C27), 15.3(C18), 13.7(C21); HR-MS: Calcd for C32H51NO6: 545.371 6(M+), found 545.371 9。
2 结果与讨论
2.1 合成
甾体皂甙的合成方法较多[12],其中Koenigs-Knorr和Schmidt法最常用。卤代酰化糖和三氯乙酰亚胺酯酰化糖是两个重要中间体,卤代酰化糖制备较成熟容易,为此研究选择Koenigs-Knorr的甙化方法。以苯甲酰氯[n(1) ∶n(酰氯)=1.0 ∶6.1或1.0 ∶5.1]在吡啶或三乙胺作用下制备全苯甲酰化糖2a~2e,反应跟踪及纯化容易;2a~2e与30%溴化氢醋酸溴化剂[n(2) ∶n(溴化剂)=1.0 ∶2.0]反应制备中间体溴代酰化糖3a~3e;在-10 ℃~-5 ℃,无氧无水条件下,无水二氯甲烷和无水甲苯为溶剂,分子筛除水,以等摩尔量的AgSO3CF3催化,3a~3e与4缩合反应2 h~3h,然后在甲醇/甲醇钠作用下脱保护基合成了5a~5e,两步收率约70%。在等摩尔量硝酸银催化下,反应无需氮气保护, 在0 ℃~室温反应4 d~10 d,3a~3e与4缩合反应亦可得到5a~5e,收率52%~73%,反应操作简便容易。
根据1H NMR端位氢的判断规则[13],对3a~3e和5a~5e的甙键构型进行初步分析,1a,1b和1d适合该规则,3a,3b和3d的端位氢3J1,2分别为4.0 Hz, 4.0 Hz和7.2 Hz,因此3a,3b的甙键可确定为α-D构型,而3d为β-D构型。3a,3b和3d与4甙化缩合物端位氢3J1,2分别为8.0 Hz, 7.6 Hz和8.4 Hz,因此它们以及5a, 5b和5d糖甙键确定为β-D构型。5c试验数据与文献[11]相符,糖甙键为α-L构型。另推测5e为β-L构型。
2.2 体外抗肿瘤活性
MTT法: 5a~5e用DMSO溶解后,加入PBS(-)配成1000 μg·mL-1的溶液或均匀的混悬液,然后用含DMSO的PBS(-)稀释。
在96孔板每孔加入4~5×104个/mL的细胞悬液100 μL,置37 ℃, 5%CO2培养箱内。24 h后加入样品液,10 μL/孔,设双复孔,37 ℃, 5%CO2作用72 h。每孔加入5 mg·mL-1的MTT溶液20 μL,作用4 h后加入溶解液,100 μL/孔,置培养箱内,溶解后用MK-2全自动酶标仪测570 nm处的OD值,计算IC50,结果见表1。从表1可见,5a~5e具有温和的体外抑制活性,其中5d具有广谱优势的活性。从表1还可见,5a~5e对MAD-MD-435,231, QGY7703和HL-60三种肿瘤细胞有较好的选择性抑制活性;solasodine 3-位羟基上引入非天然的苯甲酰氨基葡萄糖可有效增强solasodine的抗肿瘤活性,对5d的进一步修饰以发现广谱更有效的抗肿瘤化合物的工作正在进行,待后续报道。
表15a~5e的体外抗肿瘤活性*
Table1In vitro antitumor activities of 5a~5e

CompIC50/μg·mL-1ABCDE5a>20>2012.3811.2513.395b>20>20>20>20>205c12.27>207.6911.2211.655d9.9411.555.60(231)13.355.035e>20>2016.19>20>20阿霉素0.1330.0610.0460.0160.001
*4的IC50>20 μg·mL-1; A: A549; B: QGY7703; C: HL-60; D: Colo205; E: MDA-MD-435,231
[1] 周宜强. 实用中医肿瘤学[M].中医古籍出版社,2005:191-192.
[2] Daunter B, Cham B E. Solasodine glycosides,in vitro preferential cytotoxicity for human cancer cells[J].Cancer Letter,1990,55(3):209-220.
[3] Cham B E, Daunter B. Solasodine glycosides,selective cytotoxicity for cancer cells and inhibition of cytotoxicity by rhamnose in mice with sarcoma 180[J].Cancer Letter,1990,55(3):221-225.
[4] Nakamura T, Komori C, Lee Y Y,etal. Cytotoxic activities of solanum sterosidal glycosides[J].Bio Pharm Bull,1996,19(4):564-566.
[5] Ikeda T, Tsumagari H, Honbu T,etal. Cytotoxic activities of sterosidal glycosides from solanum plants[J].Bio Pharm Bull,2003,26(8):1198-1201.
[6] 刘良,刘芯辰,崔淑华. 澳洲茄胺的制备方法及其澳洲茄胺在医药上的应用[P].CN 1 552 724,2004.
[7] 陈磊,查晓明,江振洲,等. 甾体生物碱澳洲茄胺的研究进展[J].药学进展,2011,25(6):257-265.
[8] Shahid, Mohammed. Synthesis of solanum glycosides[P].WO 03 018 604,2003.
[9] Wei G H, Wang J, Du Y G. Total synthesis of solamargine[J].Bioorg & Medicine Chemistry Letter,2011,21:2930-2933.
[10] Zhang G P, Shen S D, Lei M,etal. A facile and efficient method for he synthesis of solasodine from diosgenin[J].Tetrahedron,2011,67:5894-5896.
[11] Lou H X, Gao J, Wang Y Y,etal. Solasodine-3-o-α-L-rhamnosides,its preparation and application[P].CN 101 974 007,2010.
[12] Pellissier H. The glycosylation of steroids[J].Tetrahedron,2004,60:5123-5162.
[13] 裴月湖,华会明,李占林,等. 核磁共振法在苷键构型确定中的应用[J].药学学报,2011,46(2):127-131.

