类风湿性关节炎患者血清GM-CSF、IL-6、IL-17和TNF-α的水平测定及临床意义
汤荣华, 黄建军
(皖南医学院弋矶山医院检验科,安徽芜湖 241001)
类风湿性关节炎(RA)是一种以累及周围关节为主的多系统性炎症性自身免疫性疾病,其典型症状为对称性、多个周围性关节的慢性炎症病变,病变呈持续、反复发作的过程,其病理为滑膜炎,侵袭下层关节软骨及骨,造成关节破坏。RA的病因和病理机制尚未完全阐明,多种源自免疫系统和滑膜组织的细胞及其分泌的细胞因子参与了疾病的发展。近来有文献报道,炎症因子网络持续的激活/调节异常与自身抗原刺激的免疫反应一起,成为RA患者关节慢性炎症持续存在的主要因素[1-4]。鉴于细胞因子网络在RA患者关节慢性炎症反应中的关键作用,外周循环血或关节液中的细胞因子可能成为监控病情发展和判断预后的良好指标。本研究立足于RA慢性炎症的最新报道,检测中性粒细胞巨噬细胞集落刺激因子(GM-CSF)、白细胞介素6(IL-6)、白细胞介素17(IL-17)和肿瘤坏死因子α(TNF-α)在RA患者外周血中的水平,评价这些细胞因子与RA病情发展的相关性。
材料和方法
一、研究对象
活动期RA患者45例,其中男14例,女31例,年龄(51.5±5.62)岁;稳定期 RA 患者36例,其中男9 例,女27 例,年龄(49.6±7.52)岁;健康对照组50名,为正常体检健康者,性别、年龄与患者组相匹配。RA患者活动判断标准:(1)关节肿胀≥6个;(2)关节压痛≥6个;(3)晨僵≥45 min;(4)红细胞沉降率(ESR)≥40 mm/h;(5)C反应蛋白(CRP)>15 mg/L。RA患者存在(1)+(2)同时伴有(3)、(4)、(5)3项的任何2项被认为活动;不同时满足(1)+(2)或(3)、(4)、(5)仅1项被认为不活动或活动度低。
二、方法
GM-CSF、IL-6、IL-17 和TNF-α的检测采用酶联免疫吸附试验(ELISA),GM-CSF、IL-6、IL-17 和TNF-α试剂盒均由美国RB公司提供,操作步骤严格按照说明书进行。应用Bio-RAD酶标仪测量450 nm处吸光度(A)值,并将其在标准曲线下换算成浓度值。CRP采用免疫比浊法检测。
RA患者病情活动度的评估采用ESR式疾病活性分数 28(DAS28),DAS28=[0.56×sqrt(T28)+0.28×sqrt(SW28)+0.7×Ln(ESR)]×1.08+0.16,数值范围为0~10。其中,T28 表示双侧近端指间关节、掌指关节、腕关节、肘关节、肩关节及膝关节共计28个关节触痛或被动活动时的触痛数;SW28表示上述28个关节的肿胀数。
三、统计学方法
采用SPSS 13.0统计软件包进行数据处理,由于原始数据呈轻度偏态分布,计量资料用中位数(四分位数间距)表示,对每个值进行换,转换后按正态分布数据处理,采用±s表示。各组间均数比较采用单因素方差分析(one-way ANOVA)或 t检验,多重比较采用Bonforroni检验,相关性分析采用Spearman相关分析,以P<0.05为差异有统计学意义。
结 果
一、CRP、ESR水平及DAS28比较
CRP、ESR水平和DAS28在研究对象间的比较见表1,活动期RA患者组3项指标均显著高于静止期RA患者及健康对照组(P<0.05)。
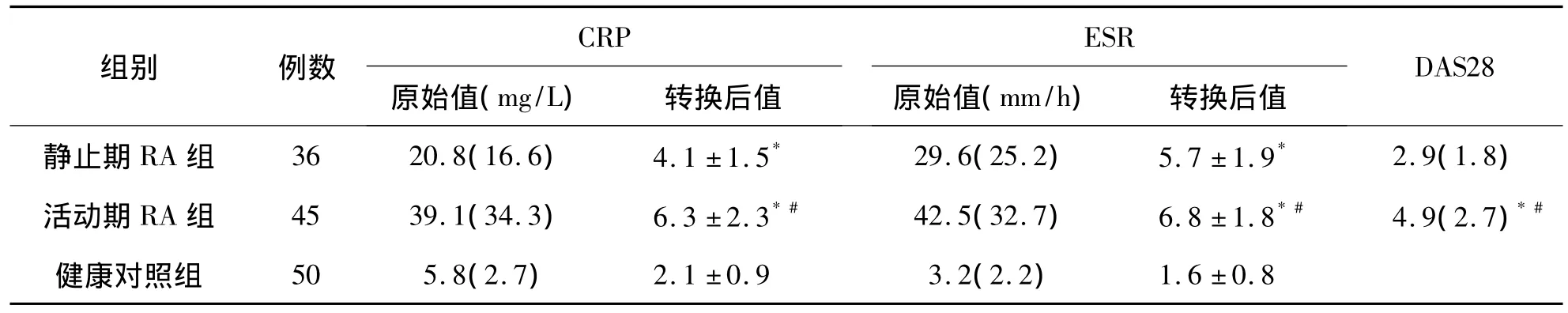
表1 CRP、ESR和DAS28在研究对象间的比较
二、研究对象血清GM-CSF、IL-6、IL-17 和TNF-α水平的比较
活动期 RA患者血清中GM-CSF、IL-6和TNF-α的水平显著高于静止期RA患者和健康对照组(P<0.01);静止期 RA患者血清中GMCSF、IL-6和TNF-α的水平显著高于健康对照组(P<0.05),IL-17在3组间差异无统计学意义(P>0.05)。见表2。
三、4种细胞因子及DAS28的相关性分析
4种细胞因子均有显著的正相关性,其中GMCSF与TNF-α和IL-6的相关系数较高,与IL-17的相关系数较低,DAS28与TNF-α、IL-6和GM-CSF均有显著的相关性。见表3。

表2 3组血清GM-CSF、IL-6、IL-17和TNF-α水平的比较 (pg/mL)

表3 4种细胞因子及DAS28在研究对象间的相关性分析 [r值(P值)]
讨 论
本研究比较巨噬细胞源性细胞因子(GMCSF、IL-6和TNF-α)和Th17细胞源性细胞因子(IL-17)在静止期和活动期RA患者体内的水平,分析4种细胞因子之间的相互关系及其与RA患者疾病活动度之间的关系。GM-CSF、IL-6和TNF-α在活动期RA患者外周血中的浓度均显著高于静止期RA患者和健康对照者,而IL-17在3组间差异无统计学意义,表明单核-巨噬细胞系统在RA患者慢性关节炎的持续发作中发挥重要作用,而 Th17细胞在病情的维持中可能无明显作用。
GM-CSF是由内皮细胞、成纤维细胞、巨噬细胞和活化的T细胞在细菌脂多糖(LPS)、白细胞介素1(IL-1)和TNF-α等炎症因子的刺激下分泌的一种细胞因子,最初认为GM-CSF促进骨髓前体细胞增殖分化为巨噬细胞、粒细胞和树突状细胞(DC)[5-7]。近来的研究表明,GM-CSF 调节巨噬细胞的多种功能,包括细胞黏附、病原模式识别受体的表达、促进炎症因子[白细胞介素12(IL-12)、白细胞介素 18(IL-18)、IL-6 和TNF-α)]的分泌以及吞噬和杀灭病原体。GM-CSF对于自身免疫性疾病的产生具有重要的作用,GM-CSF基因敲除的骨髓细胞发育分化良好,不易发展成为实验性变应性脑炎、胶原诱导的关节炎以及实验性自身免疫性心肌炎,GM-CSF抗体能够避免或缓解动物自身免疫性炎症的发生[8-11]。RA患者关节滑膜液和血浆中GM-CSF及其受体浓度升高,滑膜组织细胞、软骨细胞、外周血单个核细胞胞内GM-CSF受体过度表达[12],表明 GM-CSF在RA慢性关节炎中具有重要作用。有文献报道,GM-CSF能够缓解Felty's综合征以及化疗引起的粒细胞减少,同时却促进了关节炎的复发。本研究发现,GM-CSF在活动期RA患者外周血中的水平为27.4(34.8)pg/mL,显著高于静止期 RA 患者[12.7(9.7)pg/mL]和健康对照者[6.2(5.2)pg/mL];静止期RA患者的GM-CSF浓度也高于健康对照者,表明GM-CSF可能是促进并维持RA关节滑膜炎的重要细胞因子,随着GM-CSM浓度的增加,RA患者关节炎呈现活跃状态。我们同时发现IL-6和TNF-α在RA患者外周血中的水平显著高于健康对照组,活动期RA患者显著高于静止期RA患者,表明细胞因子网络在RA关节炎活动期处于激活状态,巨噬细胞活化并分泌相关细胞因子,促进关节炎症的反复发作。联合检测血清中GM-CSF、IL-6和TNF-α的水平有助于RA患者病情活动度的监测。
IL-17是Th17细胞分泌的主要细胞因子,IL-17可通过诱导其他细胞因子、蛋白酶和黏附分子的产生发挥其在RA中的作用。IL-17通过核转录因子κB(NF-κB)和磷脂酰肌醇3-激酶/蛋白激酶B(PI3K/AKT)等细胞通路来促进多种细胞因子分泌,包括IL-6、IL-8 及 TNF-α等[13-14];同时IL-17能够诱导中性粒细胞产生和成熟。IL-17单独或与IL-1β/TNF-α等协同刺激关节滑膜细胞表达IL-6,这些细胞因子募集炎性细胞,使巨噬细胞、中性粒细胞、幼稚DC细胞和T细胞等在关节滑膜处聚集,增强炎症反应,加快滑膜细胞增殖[15-16];而且IL-17能诱导巨噬细胞分泌基质金属蛋白酶(MMP)-2、MMP-3、MMP-9 及MMP-13[17],促进软骨蛋白多糖及胶原降解,增强单核巨噬细胞对软骨基质的破坏[18-19]。IL-17可以通过上述多种途径诱导关节的破坏,然而本研究表明,IL-17在活动期和静止期RA患者外周血中的浓度分别为23.4(19.5)和19.3(16.4)pg/mL,差异无统计学意义,与健康对照组的浓度20.8(16.1)pg/mL相比差异亦无统计学意义,提示IL-17在RA诱导期和发病期作用是不同的,IL-17可能仅参与RA诱发,与RA关节滑膜炎的反复发作可能无明显关联。IL-17在慢性关节滑膜炎症维持中的作用还有待阐明[20]。
我们同时对RA患者血清中4种细胞因子间以及与DAS28分数的相关性进行分析,发现4种因子间均呈正相关关系,其中GM-CSF与TNF-α和IL-6的相关系数最高(r=0.738、0.637),与IL-17的相关系数较低(r=0.171);GM-CSF与DAS28也具有较强的相关性(r=0.583),表明GM-CSF与RA疾病活动度有密切关联。这种相关性提示GM-CSF可能是炎症因子网络中的核心调控者。T细胞识别关节组织特异性抗原,诱发炎症,分泌 GM-CSF等细胞因子[21],在关节滑膜炎中,GM-CSF募集骨髓中的单核细胞和粒细胞,在关节处发育分化,分泌大量 TNF-α和IL-6,促进关节炎症的发展;而在静止期,RA患者GMCSF的浓度降低,募集的单核细胞和粒细胞减少,分泌的TNF-α和IL-6也随之降低,关节炎症呈现恢复趋势。
总之我们的研究表明,细胞因子网络是维持和促进RA关节滑膜炎的重要因素,GM-CSF、IL-6及TNF-α的水平有助于判断RA的活动度;GMCSF与疾病活动度及血清中IL-6和TNF-α的水平均呈正相关,可能是RA患者细胞因子网络的重要调控者,GM-CSF在RA发病过程中的作用有待深入研究。
[1]Smolen JS,Steiner G.Rheumatoid arthritis is more than cytokines:autoimmunity and rheumatoid arthritis[J].Arthritis Rheum,2001,44(10):2218-2220.
[2]Steiner G,Smolen J.Autoantibodies in rheumatoid arthritis and their clinical significance[J].Arthritis Res,2002,4(Suppl 2):S1-S5.
[3]Firestein GS,Zvaifler NJ.How important are T cells in chronic rheumatoid synovitis?:Ⅱ.T cellindependent mechanisms from beginning to end[J].Arthritis Rheum,2002,46(2):298-308.
[4]Feldmann M.Development of anti-TNF therapy for rheumatoid arthritis[J].Nat Rev Immunol,2002,2(5):364-371.
[5]Kunisada T,Miyazaki M,Mihara K,etal.A new human chondrosarcoma cell line(OUMS-27)that maintains chondrocytic differentiation[J].Int J Cancer,1998,77(6):854-859.
[6]Altman R,Asch E,Bloch D,etal.Development of criteria for the classification and reporting of osteoarthritis.Classification of osteoarthritis of the knee.Diagnostic and Therapeutic Criteria Committee of the American Rheumatism Association[J].Arthritis Rheum,1986,29(8):1039-1049.
[7]Arnett FC,Edworthy SM,Bloch DA,etal.The American Rheumatism Association 1987 revised criteria for the classification of rheumatoid arthritis[J].Arthritis Rheum,1988,31(3):315-324.
[8]Shimada S,Nakamura M,Tanaka Y.Crosslinking of the CD69 molecule enhances S100A9 production in activated neutrophils[J].Microbiol Immunol,2007,51(1):87-98.
[9]Tschesche H,Zölzer V,Triebel S,etal.The human neutrophil lipocalin supports the allosteric activation of matrix metalloproteinases[J].Eur J Biochem,2001,268(7):1918-1928.
[10]Yan L,Borregaard N,Kjeldsen L,etal.The high molecular weight urinary matrix metalloproteinase(MMP)activity is a complex of gelatinase B/MMP-9 and neutrophil gelatinase-associated lipocalin(NGAL).Modulation of MMP-9 activity by NGAL[J].JBiol Chem,2001,276(40):37258-37265.
[11]Koch G,Wagner T,Plater-Zyberk C,etal.Multiresponse model for rheumatoid arthritis based on delay differential equations in collagen-induced arthritic mice treated with an anti-GM-CSF antibody[J].JPharmacokinet Pharmacodyn,2012,39(1):55-65.
[12]Nakano K,Okada Y,Saito K,etal.Rheumatoid synovial endothelial cells produce macrophage colonystimulating factor leading to osteoclastogenesis in rheumatoid arthritis[J].Rheumatology(Oxford),2007,46(4):597-603.
[13]Granet C,Miossec P.Combination of the proinflammatory cytokines IL-1,TNF-alpha and IL-17 leads to enhanced expression and additional recruitment of AP-1 family members,Egr-1 and NF-kappaB in osteoblast-like cells [J].Cytokine,2004,26(4):169-177.
[14]Bush KA,Farmer KM,Walker JS,etal.Reduction of joint inflammation and bone erosion in rat adjuvant arthritis by treatment with interleukin-17 receptor IgG1 Fc fusion protein[J].Arthritis Rheum,2002,46(3):802-805.
[15]Agarwal S,Misra R,Aggarwal A.Interleukin 17 levels are increased in juvenile idiopathic arthritis synovial fluid and induce synovial fibroblasts to produce proinflammatory cytokines and matrix metalloproteinases[J].J Rheumatol,2008,35(3):515-519.
[16]Sheibanie AF,Khayrullina T,Safadi FF,etal.Prostaglandin E2 exacerbates collagen-induced arthritis in mice through the inflammatory interleukin-23/interleukin-17 axis[J].Arthritis Rheum,2007,56(8):2608-2619.
[17]周兴辉,林连兵.类风湿关节炎患者关节液血红素氧合酶-1水平的变化及临床意义[J].检验医学,2011,26(10):672-674.
[18]Sylvester J,Liacini A,Li WQ,etal.Interleukin-17 signal transduction pathways implicated in inducing matrix metalloproteinase-3,-13 and aggrecanase-1 genes in articular chondrocytes[J].Cell Signal,2004,16(4):469-476.
[19]Burrage PS,Mix KS,Brinckerhoff CE.Matrix metalloproteinases:role in arthritis[J].Front Biosci,2006,11:529-543.
[20]Kokkonen H,Söderström I,Rocklöv J,etal.Upregulation of cytokines and chemokines predates the onset of rheumatoid arthritis[J].Arthritis Rheum,2010,62(2):383-391.
[21]Papatriantafyllou M.Cytokines:GM-CSF in focus[J].Nat Rev Immunol,2011,11(6):370-371.