运动对去卵巢骨质疏松大鼠O PG、RA NK L表达的影响
李丽辉 杨杰 董洁琼 秦淑娟 董苗淼 张玲莉 邹军
1 上海体育学院运动科学学院(上海200438)
2 上海体育学院科研处
绝经后骨质疏松症是中老年女性多发病,运动防治骨质疏松症的作用越来越受到关注。运动一定程度上可以防治骨质疏松症,作为非药物疗法,运动有疗效可靠、副作用小、开销节省等优点。而运动强度、运动方式等对骨量有不同影响,运动防治骨质疏松的机理及临床疗效仍有待研究。本研究以切除卵巢的大鼠作为骨质疏松模型,实施运动干预后,采用骨组织形态计量学的方法,观察运动对骨质疏松症的防治作用;并从破骨细胞分化通路OPG-RANKL-RANK中OPG、RANKL蛋白及基因表达的角度,探讨运动防治骨质疏松的机理。
1 材料和方法
1.1 实验动物
实验用清洁级Wistar雌性大鼠,体重200~220 g,由中国人民解放军军事医学科学院实验动物中心提供,实验动物合格证号为SCXK-(军)2002-001。本实验在中国中医科学院中医基础理论研究所进行,大鼠动物室许可证号为SYXK11-00-0039,为清洁级实验动物室。
1.2 实验药物及试剂
己烯雌酚购自北京益民药业有限公司(批号:国药准字H11020899),配成0.0045 mg/ml的浓度。大鼠OPG和RANKL免疫组化一抗和原位杂交试剂盒购自武汉博士德生物工程有限公司,二抗二步法免疫组化检测试剂购自北京中杉金桥生物技术有限公司。
1.3 实验方法
1.3.1 分组及处理
65只实验大鼠随机平均分为5组,每组13只,造模使个别大鼠死亡,有效实验大鼠分别是正常对照组12只,假手术组12只,模型组12只,阳性对照组13只,运动组11只。
摘除模型组、阳性对照组和运动组大鼠双侧卵巢。假手术组只切除小块脂肪组织,但不摘除卵巢。术后1个月,参照文献[1],运动组大鼠在电动跑台上进行中等强度运动,具体运动方案见表1。阳性对照组大鼠灌服已烯雌酚(0.045 mg/kg,给药浓度为0.0045 mg/ml),正常对照组、假手术组、模型组和运动组大鼠同时灌服等容积蒸馏水。运动与灌胃均是每周5天,休息2天,持续3个月。

表1 大鼠运动方案
在处死大鼠前16天和前3天,对各组大鼠腹腔注射盐酸四环素(30 mg/kg体重),目的是对骨进行荧光标记。将大鼠断头处死并剥离胫骨,用中性多聚甲醛固定,左侧胫骨制成脱钙骨冰冻切片,右侧胫骨制成不脱钙骨切片,以检测各项指标。
1.3.2 指标检测和方法
1.3.2.1 骨组织形态计量学指标检测
骨组织形态检测指标包括骨小梁体积百分比(TBV%)、骨小梁吸收表面百分比(TRS%)、骨小梁形成表面百分比(TFS%)、活性生成表面百分比(AFS%)、骨小梁矿化率(MAR)、骨小梁骨生成率(BFR)、类骨质平均宽度(OSW)和骨皮质矿化率(mAR)。
不脱钙骨切片的制作及染色:取大鼠右侧胫骨近端1/3,去除软组织,磨去左右两侧部分皮质,乙醇逐级脱水,二甲苯透明,每级各两次,每次24小时。配制浸透液:Ⅰ液(甲基丙烯酸甲酯75 ml、邻苯二甲酸二丁酯25 ml);Ⅱ液(在Ⅰ液的基础上加过氧化苯甲酰1g);Ⅲ液(在Ⅰ液的基础上加过氧化苯甲酰2.5 g)。以上三液均用磁力搅拌器充分搅匀,标本在Ⅰ、Ⅱ、Ⅲ液中各浸透36小时。在青霉素小瓶中注入约5 ml的Ⅲ液(包埋液)后,将标本按同一方向放入瓶中,塞紧瓶盖,置于40℃烘箱中聚合3~4天,变为无色透明坚硬包埋块。砸碎小瓶,取出包埋块,用锉刀修块。在Reicheit-Jung2040切片机上,用钨钢刀分别切出5µm和10µm的纵向不脱钙骨切片。其中,5µm切片先置于甲基丙烯酸甲酯中2小时和二甲苯中两次各1小时,溶掉树脂,梯度乙醇至水,甲苯胺蓝染色,采用Leica Qwin图像分析系统计量分析。10µm切片则直接用于荧光观察。
1.3.2.2 成骨细胞和骨髓基质细胞OPG和RANKL蛋白表达检测
采用免疫组织化学染色方法检测胫骨OPG和RANKL蛋白表达。结果判断:成骨细胞(OB)和间充质干细胞(Mesenchymal Stem Cells,MSC)阳性反应细胞胞浆着色呈棕黄色。采用Leica Qwin图像分析系统,随机检测骺板以下髓腔内5个以上高倍视野(×400),计算每个视野的阳性面积比,取其平均值。OB阳性面积比为每个视野内胞浆着色呈棕黄色的OB面积占视野内骨小梁面积的百分比,以其作为阳性反应细胞密度(简称阳性密度);MSC阳性面积比为每个视野内阳性细胞面积占视野内去除骨小梁的骨髓腔面积的百分比,以其作为阳性反应细胞密度(简称阳性密度)。
1.3.2.3 成骨细胞和骨髓基质细胞OPG和RANKLmRNA表达检测
采用原位杂交方法检测胫骨OPG和RANKL mRNA表达。结果判断:成骨细胞、骨髓基质细胞阳性反应,细胞胞浆着色呈棕黄色。
1.4 统计学分析
采用SPSS17.0软件包,运用单因素方差分析处理数据,组间两两比较进行q检验。结果以均数±标准差(± s)表示。
2 结果
2.1 骨组织形态计量学指标
表2显示:模型组和运动组大鼠TBV%显著低于假手术组,阳性对照组和运动组显著高于模型组,且阳性对照组显著高于运动组;模型组大鼠TRS%、TFS%、AFS%显著高于假手术组,阳性对照组和运动组显著低于模型组。
表3显示:模型组大鼠MAR、BFR、mAR、OSW显著高于假手术组,阳性对照组和运动组显著低于模型组;且运动组BFR、mAR显著高于阳性对照组。
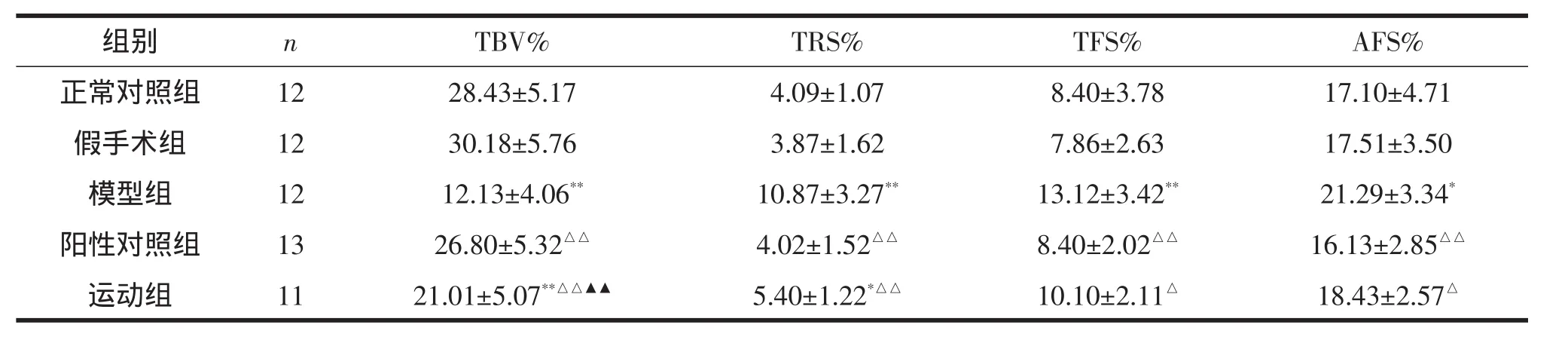
表2 各组大鼠胫骨TBV%、TRS%、TFS%和AFS%比较
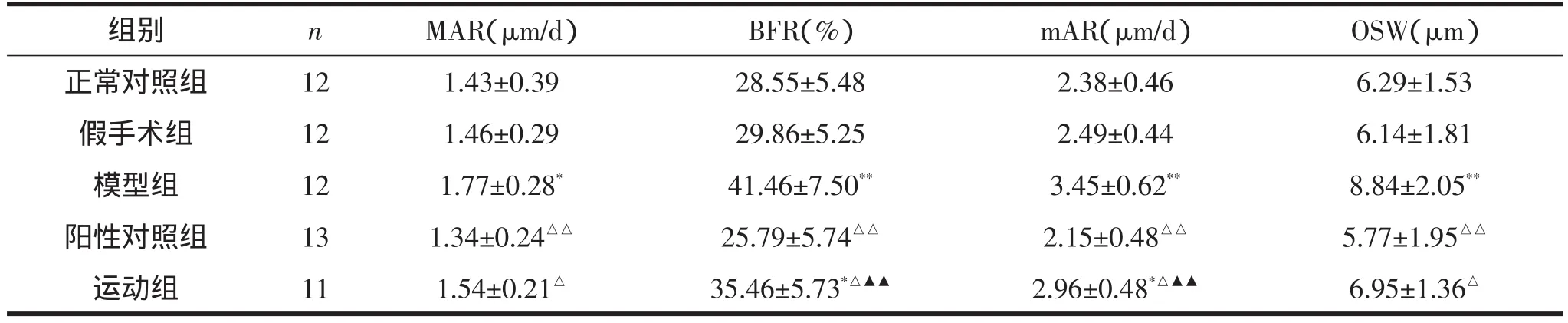
表3 各组大鼠胫骨MAR、BFR、mAR和OSW比较
2.2 OPG蛋白和mRNA表达
表4显示:模型组大鼠成骨细胞、骨髓基质细胞OPG蛋白和mRNA表达显著低于假手术组,阳性对照组和运动组显著高于模型组;阳性对照组OB OPG蛋白、OB OPG mRNA和MSC OPG mRNA显著高于运动组。
2.3 RANKL蛋白和mRNA表达
表5显示:模型组大鼠成骨细胞、骨髓基质细胞RANKL蛋白及mRNA的表达显著高于假手术组,阳性对照组和运动组显著低于模型组。

表4 各组大鼠成骨细胞和骨髓基质细胞OPG蛋白和mRNA表达比较
3 讨论
3.1 运动对去卵巢大鼠骨质疏松的影响
人体及动物实验均表明[2,3],即使方式不一,只要强度适宜,运动对骨组织形态学指标都有显著促进作用。有研究表明[4],适宜强度运动增加血雌二醇和睾酮分泌,促进成骨细胞增殖,加快新骨形成,最终增加骨量和骨密度。运动对骨质疏松的影响受很多因素制约,如运动方式、强度和频率以及运动者的体成分等。有研究[5]发现,跑步、负重锻炼对持重骨骨密度的影响比游泳或骑自行车等非负重运动大些,而非负重运动不会显著提高持重骨骨密度。王红升等[6]研究表明,长时间适宜强度运动后,老龄鼠股骨生物力学性能得到很大改善,长时间高强度运动则会降低老龄鼠骨组织生物力学性能,而低强度运动对骨组织生物力学性能无明显影响。本实验结果表明,长时间适宜强度运动能延缓骨细胞衰老和骨组织功能衰减。
TBV%是骨小梁体积占被测骨髓腔总体积的百分比,是衡量骨量水平的主要标志;TRS%是不规则、凹凸不平的骨小梁表面占骨小梁表面的百分比,即有成骨细胞被覆的类骨质表面占骨小梁表面的百分比。它们可以分别评价破骨细胞和成骨细胞活性。在一定程度上,MAR、OSW和mAR也能反映成骨细胞的活动状况,因此常常同TFS%一起反映骨形成情况。本实验结果显示,大鼠切除卵巢后胫骨TBV%显著降低,表明大鼠骨量减少,而TRS%、TFS%、MAR、OSW和mAR均显著升高,则表明大鼠切除卵巢后成骨细胞和破骨细胞活性均显著增强。运动干预后,胫骨TBV%显著升高,TRS%及TFS%、MAR、OSW和mAR均显著降低,表明运动增加骨量,降低破骨细胞活性,对防治骨质疏松有积极作用。
3.2 运动对破骨细胞分化传导通路OPG-RANKL-RANK的影响
OPG对骨组织有特异性作用,是影响破骨细胞分化、成熟,调节骨代谢的关键决定性因子。RANKL是破骨细胞前体细胞分化为成熟破骨细胞的必需因子,可促进破骨细胞分化,增强成熟破骨细胞活力,阻止破骨细胞凋亡。OPG-RANKL-RANK系统在破骨细胞激活、生成、分化和成熟的过程中起着决定性作用,是非常重要的破骨细胞分化调节通路。高丽等[7]观察了2月龄雌性SD大鼠进行10周大强度跑台运动后出现的运动性动情周期抑制,结果发现,与对照组相比,运动性动情周期抑制雌性大鼠显微结构显示皮质骨变薄,破骨细胞数目增多,松质骨骨小梁数目减少、纤细、排列稀疏,超微结构显示衰老骨细胞数目增多,少数细胞呈现凋亡早期特征,同时骨组织OPG mRNA表达降低,OPGL mRNA表达增加。长期大强度跑台运动导致运动性动情周期抑制的机理可能由于雌激素水平降低,改变了骨组织局部因子水平,这些因子调节骨组织OPG/OPGL相对表达水平,影响成骨细胞和破骨细胞数目或活性,导致骨结构改变。实验研究表明[8],250 km超长距离跑后第3天,血清破骨细胞分化因子(RANKL)和OPG水平较运动前有所上升。另一项研究也显示[9],超过42.195 km的长距离跑才能引起OPG上升。West等[10]的实验结果显示,绝经运动组妇女血清OPG水平较正常月经运动组存在显著性差异,正常月经安静组妇女血清OPG水平最低。有研究报道[11],超负荷运动导致心肌细胞分泌OPG量下降,其与破骨细胞分化因子的比例也下降,导致破骨细胞活性增强,骨吸收增加。Tang等[12]研究表明,施加机械力刺激后,成骨细胞OPG mRNA和蛋白表达均上升,而RANKL mRNA和蛋白表达均下降。刘丽等[13]的体外细胞培养实验结果显示,机械力作用下骨髓基质细胞RANKL mRNA表达减少,OPG mRNA表达增加,提示生理性应力显著影响大鼠骨髓基质细胞OPG/RANKL mRNA表达变化。研究表明[14],小鼠去卵巢后骨髓细胞过度表达RANKL而OPG表达降低,导致骨吸收过度活跃。本实验结果也证明了这一点。雌激素对人成骨细胞OPG表达有升调节作用,对RANKL表达有降调节作用。同时,适量运动一方面促进血液循环,促进神经体液调节,改善激素调控过程,而雌激素直接作用于成骨细胞和破骨细胞上的雌激素受体,调节骨代谢;另一方面,雌激素等主要影响骨代谢的激素通过OPG-RANKL-RANK系统实现对骨代谢的调节[15]。
我们的前期研究[16,17]结果表明,运动对骨形成有明显刺激作用,其可能通过提高去卵巢大鼠血清CT、E2含量,降低BGP含量,使雌激素、IL-1、IL-6和PGE2等细胞因子达到动态平衡,维持骨吸收和形成的正常转换速率。体内诸多激素和因子,如性激素、降钙素(CT)、骨钙素(BGP)、甲状旁腺激素(PTH)、1,25-二羟基维生素D3[1,25(OH)2D3]等;白细胞介素 1(IL-1)、白细胞介素4(IL-4)、白细胞介素6(IL-6)、肿瘤坏死因子(TNF)等几乎均通过影响OPG-RANKLRANK系统影响骨代谢[18]。本次实验采用中等强度运动,观察其对OPG和RANKL蛋白及基因的表达,且运动干预从大鼠去卵巢造模后1个月开始(去卵巢后到骨质疏松形成需要的时间为2~3个月),持续3个月,从预防与治疗两个方面探讨运动对骨质疏松的作用效果与机理。结果表明,运动显著升高切除卵巢大鼠成骨细胞和骨髓基质细胞OPG蛋白和mRNA表达,降低RANKL蛋白和mRNA表达,而OPG与RANKL结合,竞争性减少RANKL与RANK的结合,抑制破骨细胞分化成熟,防止骨过度吸收,起到一定的骨保护作用。本研究从破骨细胞分化调节通路OPG-RANKL-RANK的角度,初步揭示了运动防治骨质疏松的机理。
4 总结
本实验结果表明,运动对去卵巢大鼠骨组织形态计量相关指标有一定的改善作用,对破骨细胞分化传导通路OPG-RANKL-RANK中的OPG和RANKL蛋白及基因表达有一定调节作用,对去卵巢所致的大鼠骨质疏松症有一定的防治作用。
[1]Bedford TG.Maximum oxygen consumption of rats and its changes with various experimental procedures.J Appl Physiol,1979,47(6):1278-1283.
[2]梁鸿,郑陆,阎守扶,等.运动对骨形态结构、骨密度和骨生物力学特征的影响.首都体育学院学报,2009,21(2):202-204.
[3]房冬梅,张林.不同模式跑台运动对生长期大鼠长骨形态计量学参数的影响.中国运动医学杂志,2009,28(6):654-656.
[4]王沛,刘春,黄欣加.骨质疏松的运动防治研究.南京体育学院学报(自然科学版),2003,2(4):30-33.
[5]Evans EM,Racette SB,Van Pelt RE,et al.Effects of soyprote in isolate and moderate exercise on bone turnover and bone mineral density in postmenopausal women.Menopause,2007,14(3 Pt1):481-488.
[6]王红升,段涛,杜瑞卿,等.不同强度的跑跳运动对老龄大鼠股骨生物力学特性影响的动态实验研究.中国康复医学杂志,2009,24(7):600-603.
[7]高丽,郑陆,李晓霞,等.运动性动情周期抑制雌性大鼠的骨结构与骨组织OPG mRNA、OPGL mRNA的表达.天津体育学报,2005,20(6):22-25.
[8]Kerschan-Schindl K,Thalmann M,Sodeck GH,et al.A 246-km continuous running race causes significant changes in bone metabolism.Bone,2009,45(6):1079-1083.
[9]Ziegler S,Niessner A,Richter B,et al.Endurance running acutely raises plasma osteoprotegerin and lowers plasma receptor activator of nuclear factor kappa B ligand.Metabolism,2005,54(7):935-938.
[10]West SL,Scheid JL,De Souza MJ.The effect of exercise and estrogen on osteoprotegerin in premenopausal women.Bone,2009,44(1):137-144.
[11]Lieberman IH,Dudeney S,Reinhardt MK,et al.Initial outcome and efficacy of kyphoplasty in the treatment of painful osteoparotic vertebral compression fractures.Spine,2001,26(14):1631-1638.
[12]Tang L,Lin Z,Li YM.Effects of different magnitudes of mechanical strain on osteobalsts in vitro.Biochem Biophys Res Commun,2006,344(3):122-128.
[13]刘丽,张晓聪,郑茜聪,等.机械应力影响鼠骨髓基质细胞骨保护素/NF-kB受体活化剂配体mRNA表达变化.细胞生物学杂志,2006,28:747-751.
[14]葛月宾,王丽君.小鼠去卵巢骨质疏松模型的建立及OPG/RANKL的表达.中国中医骨伤科杂志,2008,16(12):33-35.
[15]候颖,郑陆,朱一力.运动中雌激素通过OPG-RANKLRANK系统对骨代谢的影响.吉林体育学院学报,2010,26(3):73-75.
[16]邹军,董苗淼,张丽,等.运动配合左归丸对去卵巢大鼠骨质疏松的偶联信号IL-1、IL-6及COX-2传递的影响.中国骨质疏松杂志,2010,16(6):407-411.
[17]邹军,吕爽,屠嘉衡,等.有氧运动配合左归丸对去卵巢所致大鼠骨质疏松的影响.中国中医基础医学杂志,2009,15(4):272-276.
[18]Gori F,Hofbauer LC,Dunstan CR,et al.The expression of osteoprotegerin and RANK ligand and the support of osteoclast by stromalosteoblast lineage cells are developmentally regulated.Endocrinology,2000,141(12):4768-4776.

