烟雾染毒下血管平滑肌细胞和内皮细胞中p-c-jun与细胞周期蛋白D1的表达
李天佳,刘昌伟,黄泽彬,倪 冷,来志超,吴立飞,刘 暴
1中国医学科学院 北京协和医学院 北京协和医院血管外科,北京100032
2中国医学科学院 北京协和医学院 基础医学研究所医学分子生物学国家重点实验室,北京100005
动脉粥样硬化是一种严重危害人类生命健康的疾病,随着生活水平提高和高脂肪饮食习惯,现已成为主要的致病和致死原因。粥样硬化的形成是多因素共同作用的结果,其主要的病理变化是内皮细胞损伤和平滑肌细胞增生。流行病学分析表明吸烟是血管粥样硬化发生的一个主要因素。香烟烟雾可引起血管内皮功能紊乱、炎症反应、脂质代谢紊乱、血管平滑肌细胞增生以及血栓形成,从而导致动脉粥样硬化的形成。通过已有的资料分析香烟烟雾可能是通过影响内皮细胞和平滑肌细胞的增殖活力而诱发粥样硬化[1-2]。c-jun是细胞核内重要的转录因子,外界刺激从上游信号通路传递至c-jun并激活其功能,进而与DNA区域结合并参与基因转录调控,影响细胞的生理状态。细胞周期蛋白D1(cyclinD1)是一种细胞周期调节蛋白,在G1-S转换中发挥正调控作用。c-jun对 cyclinD1的启动子具有激活作用,调节其表达[3]。本研究以c-jun和cyclinD1为切入点,探讨吸烟诱发粥样硬化的机制。
材料和方法
材料DMEM高糖细胞基础培养液购自Hyclone公司,新生小牛血清购自Gibco公司,内皮细胞培养基、内皮细胞生长添加物、平滑肌细胞生长添加物、人脐静脉内皮细胞 (human umbilical vein endothelial cells,HUVEC)购自Sciencell公司,兔主动脉平滑肌细胞 (smooth muscle cells,SMC)购自北京协和医学院细胞中心,CCK-8(cell counting kit-8)试剂盒购自日本东仁化学研究所,抗c-jun抗体、抗p-c-jun(Ser 63)抗体、抗cyclinD1抗体、抗微管蛋白抗体购自Cell Signaling Technology公司,山羊抗鼠二抗、山羊抗兔二抗、抗GAPDH抗体购自北京中杉金桥公司,Lipofectamine 2000转染试剂购自Invitrogen公司,Flag-cjun、V5-c-jun过表达质粒由中国医学科学院北京协和医学院基础医学研究所分子生物学实验室惠赠。
烟雾染毒剂的制备香烟 (焦油含量10 mg、烟气烟碱量0.9 mg、烟气CO量12mg)经完全燃烧通入到1×磷酸盐缓冲液 (phosphate buffer saline,PBS)中,6只香烟燃烧烟雾共通入到500 ml PBS中,调pH至7.4,0.22 μl滤膜过滤,制备烟雾萃取剂 (cigarette smoke extract,CSE)。此液定为初始原液,-80℃保存待用[4]。
CCK-8测定细胞活力取处于对数生长期的细胞消化离心后计数,以每孔3000个细胞接种至96孔板,5%二氧化碳、37℃孵育箱培养24 h。吸弃旧培养基并加入含有CSE的新鲜培养基,并以相应浓度加入磷酸盐缓冲液作为对照,每组设3个复孔。5%二氧化碳、37℃孵育箱培养48 h后,吸弃培养基后加入含有10%CCK-8的培养基,并设置加入培养基和CCK-8溶液但无细胞的孔为调零孔。5%二氧化碳、37℃孵育箱培养2 h后,测定450nm处吸光度值 (absorbance,A)。细胞活力表示为:细胞活力=[A(CSE孔)-A(调零孔)]/[A(磷酸盐缓冲液孔)-A(调零孔)],实验重复3次。
细胞培养及染毒细胞复苏后,加入适宜培养基置于5%二氧化碳、37℃孵育箱培养至细胞融合率达到80%。随机分为染毒组和PBS对照组,依据上述测定细胞活力时的浓度分组如下:40%T、20%T、10%T、5%T、2.5%T、1.25%T、0.625%T、40%P、20%P、10%P、5%P、2.5%P(T表示烟雾染毒,P表示PBS对照),染毒处理48 h。
质粒转染细胞置于6 cm培养皿中至细胞融合率达到80%。3 μg质粒加入到180 μl DMEM高糖细胞基础培养 液,5 μl Lipofectamine 2000 加 入 到 180 μl DMEM高糖细胞基础培养液,上述两种液体混合后室温静置15 min。待转染细胞用DMEM高糖细胞基础培养液冲洗2次后,加入DMEM高糖细胞基础培养液2 ml,再加入上述质粒和Lipofectamine 2000的混合液,置于5%二氧化碳、37℃孵育箱培养6 h后换为完全培养基。
Western blot蛋白检测收集细胞裂解蛋白,BCA法测定蛋白浓度,加入上样缓冲液制成上样样品。采用30%聚丙烯酰胺凝胶电泳分离,以湿法转PVDF膜。5%BSA室温封闭1 h,依据抗体工作浓度加入一抗,4℃过夜孵育,Tris-Tween 20缓冲液洗涤3次,每次5 min。加入辣根过氧化物酶标记的二抗,室温孵育1 h,Tris-Tween 20缓冲液洗涤3次,每次5 min。增强化学发光法底物发光,X光片曝光显影。实验重复3次。
统计学处理应用SPSS 17.0统计软件,组间比较采用方差分析,数据以均数±标准差表示,P<0.05为差异具有统计学意义。
结 果
细胞增殖活力平滑肌增殖活力在CSE浓度0.625%~10%时呈现波峰,CSE浓度太高表现毒性作用,染毒浓度太低则不起作用。血管内皮细胞增殖活力随烟雾染毒浓度增加而逐渐降低,在≤5%染毒浓度时,由于染毒浓度较低,内皮细胞活力维持在一个平台上 (图1)。
血管平滑肌细胞的c-jun、p-c-jun与cyclinD1表达血管平滑肌烟雾染毒或PBS处理48 h后,染毒组和PBS对照组相比,c-jun的表达差异无统计学意义(P>0.05)。p-c-jun在各PBS对照组间差异无统计学意义 (P>0.05)。p-c-jun染毒组相对于PBS处理组明显增高 (P<0.05),其中10%T至0.625%T染毒浓度组p-c-jun水平呈现波峰,与SMC的CCK-8检测的细胞增殖活力趋势吻合。平滑肌细胞的各PBS对照组内cyclinD1差异无统计学意义 (P>0.05)。平滑肌细胞的染毒组和PBS对照组相比,cyclinD1明显增高(P<0.05)(图2)。

图1 烟雾染毒时血管平滑肌细胞和内皮细胞的增殖活力Fig 1 Viabilities of vascular smooth muscle cells and endothelial cells exposured to cigarette smoke extract
血管内皮细胞的c-jun、p-c-jun与cyclinD1表达在48 h后,HUVEC的染毒组和PBS对照组相比,c-jun差异无统计学意义 (P>0.05)。p-c-jun在各PBS对照组间差异无统计学意义 (P>0.05)。染毒组的p-c-jun相对于PBS对照组明显降低 (P<0.05),而CCK-8测定的内皮细胞活力在5%~40%时才显著降低,在≤5%染毒浓度时细胞活力处于平台状态。HUVEC染毒组和PBS对照组相比,cyclinD1明显降低(P<0.05)(图3)。
质粒转染后c-jun、p-c-jun与cyclinD1的表达转染过表达c-jun的平滑肌细胞较空白对照组 c-jun、p-c-jun和cyclinD1表达明显增高 (P<0.05)。V5-cjun和Flag-c-jun两种标签分别标记c-jun过表达组的c-jun、p-c-jun和cyclinD1均比空白对照组明显增高(P<0.05)(图4)。

图2 Western blot检测烟雾萃取剂对平滑肌细胞的影响Fig 2 Effects of cigarette smoke extract on smooth muscle cells by Western blot

图3 Western blot检测烟雾萃取剂对内皮细胞的影响Fig 3 Effects of cigarette smoke extract on endothelial cells by Western blot
讨 论
血管内皮细胞受损、平滑肌细胞异常增殖是动脉粥样硬化发生发展的主要过程。流行病研究表明吸烟是粥样硬化的一个主要诱因。因此,笔者推测吸烟与动脉粥样硬化中的内皮细胞损伤和平滑肌细胞增殖具有密切联系。研究表明在上述两种细胞的增殖过程中,c-jun和cyclinD1发挥了重要作用[5]。
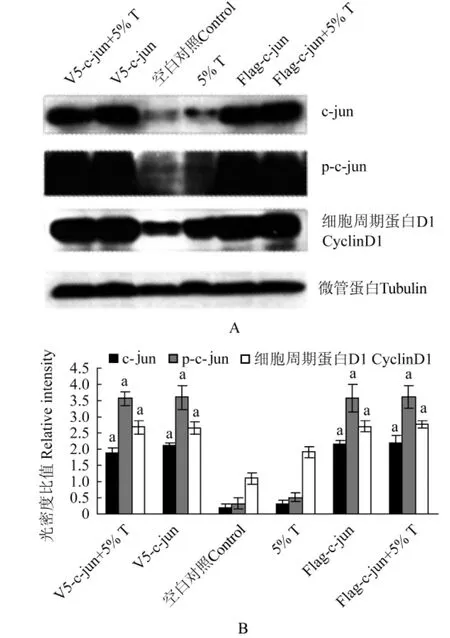
图4 过表达c-jun质粒对p-c-jun和细胞周期蛋白D1表达的影响Fig 4 Effect of over-expression c-jun on p-c-jun and cyclinD1
c-jun蛋白属于激活蛋白-1(activator protein-1,AP-1)家庭成员之一,与AP-1家族转录因子结合形成二聚体,并调控下游基因的转录活性[6]。c-jun的调控范围十分广泛,能接受多种外界物质的影响并被激活,使细胞对外界刺激作出适应性反应。研究指出c-jun是细胞增殖的正调节物,可以促进肺动脉内皮细胞增殖和血管生成[7]。c-jun蛋白在大多数静息态细胞中表达,以便于快速诱导激活。本研究SMC和HUVEC的c-jun蛋白水平在染毒组和PBS对照组差异无统计学意义,表明烟雾染毒对c-jun的基础表达量无明显作用。c-jun需要磷酸化N端第63和73位丝氨酸的磷酸化位点以发挥转录激活作用[8]。本研究显示PBS对SMC和HUVEC的p-c-jun表达均无影响,而烟雾染毒却可以影响c-jun的磷酸化,并且烟雾染毒组的血管平滑肌细胞p-c-jun较对照组明显增高,而烟雾染毒后内皮细胞p-c-jun表达显著降低。这与两种细胞CCK-8细胞增殖活力检测结果相符,表明烟雾染毒促进平滑肌增殖与p-c-jun有密切联系。p-c-jun在很多研究中都表明可促进平滑肌细胞的增殖[9]。此外,在SMC中,p-c-jun在染毒浓度1.25%时即达到峰值,而其CCK-8检测显示的细胞活力峰值在2.5%浓度处才达到峰值。在HUVEC中,染毒组的p-c-jun在低染毒浓度时即出现明显降低,而CCK-8测定的内皮细胞活力在5%~40%时才显著降低,表明p-c-jun的变化早于细胞活力的变化,推测在p-c-jun变化致细胞活力改变的过程中有其他分子的参与。
cyclinDl是一种细胞周期蛋白,保证细胞顺利由Gl期进入S期,促进细胞分裂增殖[10]。c-jun可以调节cyclinD1的表达,其对 cyclinD1的启动子具有激活作用,c-jun与cyclinD1是细胞周期的正调节因子[11]。本研究显示PBS不影响两种细胞的cyclinD1表达,而经香烟烟雾染毒后,平滑肌细胞cyclinD1明显增加,而内皮细胞cyclinD1表达降低,此结果与CCK-8检测的细胞增殖活力结果相符,表明烟雾在促进平滑肌细胞增殖和抑制内皮细胞增殖的过程中,周期蛋白cyclinD1发挥了重要作用。推测烟雾染毒可能是通过上调血管平滑肌细胞cyclinD1表达来促进其增殖,这可能是吸烟诱发粥样硬化的一个重要因素。因此,推论烟雾通过作用于不同细胞c-jun的磷酸化,进而影响周期蛋白cyclinD1的表达,最终调节细胞的增殖活力。本研究过表达c-jun后,cyclinD1表达明显增高,并且cyclinD1的启动子上也有AP-1的结合位点[12]。已知c-jun的磷酸化上游激酶是c-jun N末端激酶,香烟烟雾是否影响JNK磷酸化c-jun的进程需要进一步研究。
综上,目前认为内皮细胞损伤和SMC过度增殖是动脉粥样硬化启动和发展的关键环节。因此,保护内皮细胞并抑制SMC过度增殖,对于抑制动脉粥样病变的发展具有重要作用。本研究烟雾染毒可抑制血管内皮细胞增殖而促进平滑肌细胞增殖,并且发现在此过程中转录因子c-jun磷酸化水平和周期蛋白cyclinD1表达有明显的变化,表明二者在吸烟导致的血管粥样硬化中可能发挥重要作用。因此针对p-c-jun和cyclinD1在吸烟诱导的血管内皮细胞和平滑肌细胞活力改变上,对血管粥样硬化的预防和治疗有重要意义。
(志谢:感谢中国医学科学院北京协和医学院基础医学研究所医学分子生物学国家重点实验室的老师和工作人员提供的指导和帮助)
[1]Villablanca AC.Nicotine stimulates DNA synthesis and proliferation in vascular endothelial cells in vitro[J].J Appl Physiol,1998,84(6):2089-2098.
[2]Wright JL,Tai H,Churg A.Vasoactive mediators and pulmonary hypertension after cigarette smoke exposure in the guinea pig [J].J Appl Physiol,2006,100(2):672-678.
[3]Davies CC,Chakraborty A,Cipriani F,et al.Identification of a co-activator that links growth factor signalling to c-Jun/AP-1 activation [J].Nat Cell Biol,2010,12(10):963-972.
[4]Damico R,Simms T,Kim BS,et al.p53 mediates cigarette smoke-induced apoptosis of pulmonary endothelial cells:inhibitory effects of macrophage migration inhibitor factor [J].Am J Respir Cell Mol Biol,2011,44(3):323-332.
[5]Vikhanskaya F,Toh WH,Dulloo I,et al.p73 supports cellular growth through c-Jun-dependent AP-1 transactivation[J].Nat Cell Biol,2007,9(6):698-705.
[6]Carrillo RJ,Dragan AI,Privalov PL.Stability and DNA-binding ability of the bZIP dimers formed by the ATF-2 and c-Jun transcription factors [J].J Mol Biol,2010,396(2):431-440.
[7]Ma J,Zhang L,Han W,et al.Activation of JNK/c-Jun is required for the proliferation,survival,and angiogenesis induced by EET in pulmonary artery endothelial cells[J].J Lipid Res,2012,53(6):1093-1105.
[8]Brandt B,Abou-Eladab EF,Tiedge M,et al.Role of the JNK/c-Jun/AP-1 signaling pathway in galectin-1-induced T-cell death [J].Cell Death Dis,2010,1(2):e23.
[9]白莉,余祖滨,钱频,等.SOCS 3基因对缺氧肺动脉平滑肌细胞增殖及原癌基因mRNA表达的影响[J].中华内科杂志,2005,44(1):42-45.
[10]Li X,Hao Z,Fan R,et al.CIAPIN1 inhibits gastric cancer cell proliferation and cell cycle progression by downregulating Cyclin D1 and upregulating P27 [J].Cancer Biol T-her,2007,6(10):1539-1545.
[11]Qing H,Gong W,Che Y,et al.PAK1-dependent MAPK pathway activation is required for colorectal cancer cell proliferation [J].Tumour Biol,2012,33(4):985-994.
[12]Herber B,Truss M,Beato M,et al.Inducible regulatory elements in the human cyclin D1 promoter[J].Oncogene,1994,9(4):1295-1304.

