结核亚单位疫苗AEC/BC-C02诱导小鼠长期的抗原特异性细胞应答
卢锦标 杨蕾 付丽丽 陈保文 都伟欣 王国治 徐苗
近几年,结核新疫苗的发展非常迅速,国外进入临床Ⅰ期的已达13个,其中7个已进入或通过临床Ⅱ期[1]。这些新疫苗中,有5个属于重组蛋白亚单位疫苗,由多种重组结核分枝杆菌特异性抗原和佐剂构成,其设计者都选用各自研发的新型佐剂系统,通过增强疫苗的细胞免疫应答,提高疫苗的免疫保护力。目前,国外已报告的结核疫苗用新型佐剂的有葛兰素史克公司研发的AS01和AS02系列,丹麦国立血清研究院研发的IC31和CAF01,以及美国传染病研究中心研发的GLA-SE[2]等。鉴于佐剂在结核重组蛋白亚单位疫苗的设计中发挥的关键作用,对促进抗原细胞免疫至关重要,我室研发了以BCG为基础的新型复合佐剂系统BC-C02[3]。前期研究中发现,该佐剂系统能提高抗原特异性IFN-γ分泌的脾淋巴细胞频数,促进小鼠腹腔巨噬细胞特异性分泌IL-12[4],毒理实验也证明该复合佐剂对动物无不良反应[3]。
除了佐剂,结核新疫苗的抗原选择也很关键。结核分枝杆菌中已被证实具有免疫原性,可作为疫苗组分的蛋白有几十种,其中最主要的一类是分泌型蛋白,如 Ag85A、Ag85B、ESAT-6、CFP-10、MPT64等。Ag85A和Ag85B同源,免疫原性强,是目前已进入临床期候选疫苗中使用最频繁的蛋白[1]。因在BCG中表达量低,无论作为替代现用BCG的初免用重组BCG,还是作为BCG加免用的病毒载体疫苗和重组蛋白亚单位疫苗,多选用此蛋白以提高保护力。另外,在BCG中缺失,而结核分枝杆菌独有的RD-1区,对结核分枝杆菌的毒力维持起着重要作用,因此,该区域蛋白也成为结核新疫苗研究的热点,其中代表性蛋白ESAT-6和CFP-10,常作为新疫苗的候选抗原,如已进入临床研究阶段的重组蛋白亚单位疫苗 H1/IC31、H1/CAF01和 H56/IC31[5],均含有ESAT-6抗原。
因此,本研究利用复合佐剂系统BC-C02,配伍重组蛋白Ag85B和ESAT6-CFP10融合蛋白(简称EC),构建出新型结核亚单位疫苗AEC/BC-C02,并利用小鼠模型追踪该疫苗诱导的长期抗原特异性细胞免疫应答水平。
材料和方法
一、材料
1.材料和试剂:AEC/BC-C02 疫 苗 [(10μg Ag85B+10μg EC)/0.2ml BC-C02]由安徽龙科马生物制药有限责任公司提供。Ag85B和EC多肽库(均15个氨基酸/条,重叠10个氨基酸)由上海强耀生物科技有限公司合成。小鼠脾淋巴细胞分离液和小鼠IFN-γ预包被ELISA试剂盒购自北京达科为生物技术有限公司。1640培养基,胎牛血清(FBS)和双抗(青霉素和链霉素)购自Thermo公司(美国)。小鼠IFN-γ酶联免疫斑点法(ELISPOT)试剂盒购自Mabtech公司(瑞典)。Cell Counting Kit-8(CCK-8)试剂盒购自日本同仁化学研究所。
2.实验动物:无特定病原体(specific pathogen free,SPF)级BALB/c雌鼠,6~8周龄,由中国食品药品检定研究院实验动物中心提供。实验动物使用许可证号:scxk(京)2009-0017。实验过程中饲养于中国食品药品检定研究院清洁级动物房。均达到二级动物房标准。
二、方法
1.小鼠免疫:6~8周龄SPF级BALB/c雌鼠48只,按数字表法随机分成两组,一组免疫结核亚单位疫苗AEC/BC-C02,为疫苗组;另一组免疫PBS,为PBS组。两组均大腿内侧肌内注射,0.2ml/只,共3针,间隔10d。末次免疫后第1、2、4、8周分别取两组小鼠(6只/组)分离脾淋巴细胞,进行抗原特异性的IFN-γELISPOT检测,同时在末次免疫后第2、4、8周进行IFN-γELISA检测,第4、8周进行抗原特异性的淋巴细胞增殖检测。
2.IFN-γ的ELISPOT检测:检测当日,摘眼球放血处死小鼠后,无菌取脾,分离淋巴细胞,调整细胞浓度为2.5×106/ml。在已包被抗体的ELISPOT 96孔板中加入细胞,100μl/孔,分别添加50μl Ag85B多肽库或EC多肽库作刺激源,或50μl 1640完全培养基作阴性对照,或50μl ConA作阳性对照。Ag85B多肽库的终浓度为2μg·ml-1·条-1,EC多肽库终浓度为3.5μg·ml-1·条-1。ConA阳性对照为单孔,终浓度0.5μg/ml,其他刺激源和阴性对照均做复孔。37℃、5%CO2全湿润培养约48h后,按照ELISPOT试剂盒说明书操作,检测细胞因子IFN-γ斑点形成细胞(spot forming cells,SFC)。
3.IFN-γ的ELISA检测:利用制备的脾淋巴细胞(浓度2.5×106/ml)。在24孔细胞培养板中加入400μl/孔,再分别添加50μl Ag85B多肽库或EC多肽库作刺激源,或50μl 1640完全培养基作阴性对照。同时另取部分组细胞加入50μl/孔ConA作阳性对照。Ag85B多肽库的终浓度为2μg·ml-1·条-1,EC多肽库终浓度为3.5μg·ml-1·条-1,ConA终浓度1μg/ml。37℃、5%CO2全湿润培养约66h后,按照IFN-γELISA检测试剂盒说明书操作,检测细胞培养上清中IFN-γ的浓度。
4.脾淋巴细胞增殖检测:利用制备的脾淋巴细胞(浓度2.5×106/ml)。在96孔细胞培养板中加入细胞,50μl/孔,分别添加50μl Ag85B多肽库或EC多肽库作刺激源,或50μl 1640完全培养基作阴性对照。同时另取部分组细胞加入50μl ConA作阳性对照。取一孔,加入100μl不含细胞的1640培养基,作为空白对照。Ag85B多肽库的终浓度为3μg·ml-1·条-1,EC多肽库终浓度为5.25μg·ml-1·条-1,ConA终浓度0.5μg/ml。阴性对照做复孔,其他刺激源均做3孔。37℃、5%CO2全湿润培养约66h后,用CCK-8试剂盒检测:WST-8[2-(2-甲氧基-4-硝苯基)-3-(4-硝苯基)-5-(2,4-二磺基苯)-2H-四唑单钠盐]用1640培养基稀释一倍后,20μl/孔加入,继续培养2~8h,450/630nm检测吸光度值A。刺激指数(stimulation index,SI)=刺激孔A450/A630nm/阴性对照孔 A450/A630nm。A 值均为扣除空白对照孔读数后的平均值。
5.数据分析:实验结果作图和统计学分析在GraphPad Prism 5(美国,GraphPad Software公司)软件中进行,均采用成组或配对的双侧t检验。以P<0.05为差异有统计学意义。
结 果
一、抗原特异性IFN-γ的ELISPOT检测
末次免疫后的第1、2、4、8周,Ag85B多肽刺激后SFC 为 168.8±103.5、205.2±51.0、206.8±65.3和160.0±67.9,均分别高于 PBS对照组的8.9±6.0、16.1±18.8、9.3±4.9和7.7±6.6,差异均有统计学意义(成组t检验,t值分别为3.779、8.525、7.424、5.473,P 值均<0.01);EC多肽刺激的SFC为45.1±18.6、75.6±39.3、86.2±50.4和54.3±26.3,均分别高于PBS对照组的4.5±3.5、11.7±10.5、3.8±5.8和5.2±4.3,差异均有统计学意义 (成组t检验,t值分别为 5.258、3.850、3.977、4.521,P 值均<0.01),具体见图1。
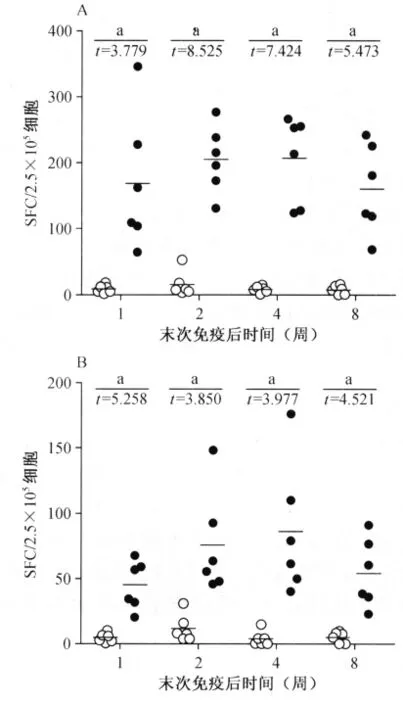
图1 末次免疫后第1、2、4、8周检测脾淋巴细胞在刺激下特异性IFN-γ的ELISPOT检测情况
末次免疫后的第1、2、4、8周,Ag85B多肽刺激的SFC均分别高于EC多肽刺激的SFC,差异有统计学意义(配对t检验,分别为:t=3.475,P<0.05;t=7.111,P<0.01;t=4.344,P<0.01;t=4.543,P<0.01),具体见图2。
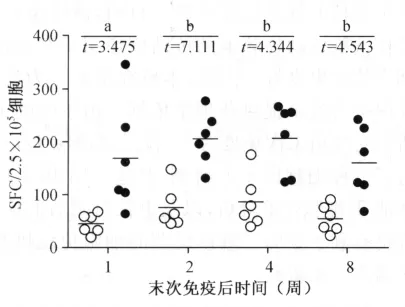
图2 末次免疫后的第1、2、4、8周,Ag85B多肽刺激与EC多肽刺激SFC的比较
二、抗原特异性IFN-γ的ELISA检测
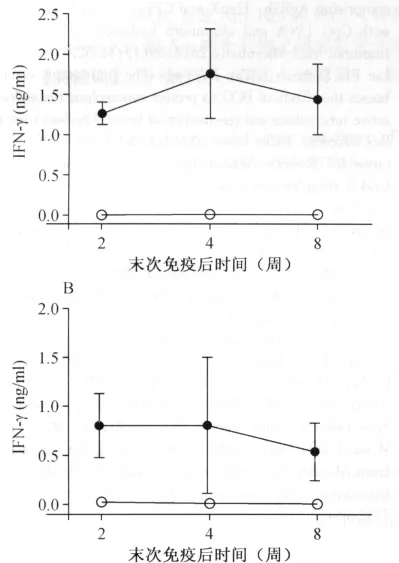
图3 末次免疫后第2、4和8周脾淋巴细胞在不同刺激源刺激下特异性IFN-γ的ELISA检测结果
免疫3针后第2、4和8周时,检测疫苗组小鼠脾淋巴细胞体外刺激的抗原特异性IFN-γ释放。如图3,PBS组小鼠几乎检测不到抗原特异性的IFN-γ分泌,均在试剂盒检测下限以下。而对疫苗组,Ag85B和EC多肽均能诱导较强的IFN-γ释放,其中Ag85B多肽刺激的IFN-γ分泌量分别是(1.27±0.13)ng/ml,(1.76±0.55)ng/ml和(1.44±0.44)ng/ml;EC多肽刺激的IFN-γ分泌量分别是(0.81±0.33)ng/ml,(0.81±0.69)ng/ml和(0.54±0.29)ng/ml。同时,Ag85B多肽比EC多肽能刺激更高的IFN-γ分泌量,两者间差异有统计学意义(配对t检验,分别为:t=3.008,P<0.05;t=2.631,P<0.05;t=10.02,P<0.01)。
三、脾淋巴细胞增殖检测
免疫3针后,于第4、8周,检测疫苗组小鼠脾淋巴细胞在Ag85B多肽和EC多肽刺激下的增殖。末次免疫后的第4、8周,Ag85B多肽对疫苗组小鼠脾淋巴细胞的刺激指数(SI)分别为1.756±0.339和1.936±0.287,均分别高于 PBS组的1.287±0.0581和1.382±0.114,差异有统计学意义(成组t检验,分别为:t=3.030,P<0.05;t=4.387,P<0.01);EC多肽对疫苗组的 SI值分别为1.599±0.154和 1.581±0.156,均分别高于 PBS 组的1.380±0.126和1.314±0.170,差异有统计学意义(成组t检验,t值分别为2.540、2.844,P 值均<0.05)。同一检测时间点,Ag85B多肽刺激的SI平均值均高于EC多肽刺激的SI平均值,但这两者之间的差异无统计学意义(配对t检验,第4周:t=1.705,P>0.05;第8周:t=2.346,P>0.05),具体见图4。
讨 论
结核病的免疫机制主要由T细胞介导的细胞免疫发挥作用,结核抗原的体液免疫应答对抗结核基本无保护作用。在结核新疫苗的研究中,一般认为,疫苗接种后诱导的抗原特异性多功能T细胞能有效控制结核分枝杆菌的感染或延迟结核病的发作,其中Th1类细胞因子,如IFN-γ,TNF-α等,发挥着关键作用[6]。因此,在结核新疫苗的临床前或临床研究中,多偏重于考察疫苗的细胞免疫应答[7-10]。
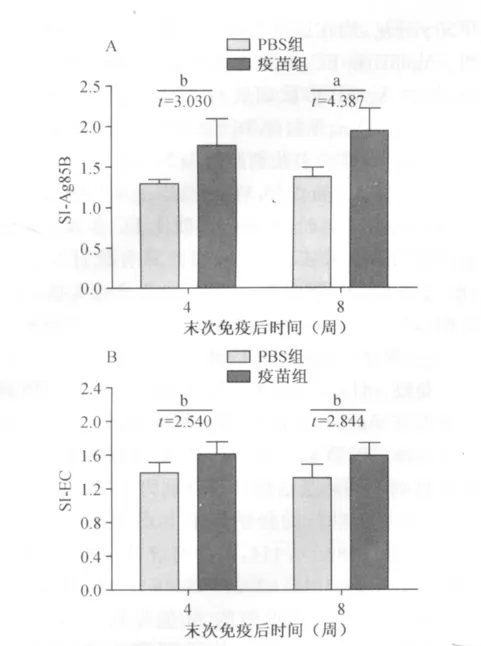
图4 末次免疫后第4周和8周脾淋巴细胞不同刺激源刺激下的脾淋巴细胞增殖指数
鉴于此,笔者对结核亚单位疫苗AEC/BC-C02在小鼠模型中进行了以IFN-γ为代表的细胞免疫应答评价。BALB/c小鼠免疫3针后,第1周ELISPOT法即可检测到抗原特异性的IFN-γ表达,第2周和第4周SFC呈上升趋势,至第8周下降,但抗原特异性SFC,仍维持在较高水平。这表明,结核亚单位疫苗AEC/BC-C02免疫3针后,可诱导产生特异性记忆T细胞,至第8周,仍能检测到Ag85B和EC特异性的IFN-γ分泌T细胞,这些持续存在的特异性记忆T细胞对机体控制结核分枝杆菌的感染有重要意义。同时4次的检测结果均显示Ag85B多肽诱导的SFC数多于EC多肽诱导的,这表明Ag85B免疫原性好于EC,可诱导更强的细胞免疫应答。此外,IFN-γ的ELISA检测结果和脾淋巴细胞增殖实验结果均显示,至末次免疫后第8周,疫苗组小鼠脾淋巴细胞的特异性IFN-γ分泌量和刺激指数都高于同一检测时间点的PBS组,这也印证了抗原特异性记忆T细胞持续存在的结论,与ELISPOT结果一致。需要指出,在IFN-γ的体外检测中,笔者运用了ELSPOT和ELISA两种检测方法。作为ELISA的改良技术,ELISPOT更灵敏,结果更直观,后续操作较简单,已成为许多研究者的首选,但ELISPOT需要配套专门的且价格昂贵的读板仪器,一定程度上限制了在基层的应用。而ELISA技术成熟,相应的酶标仪非常普遍。从笔者使用这两种方法的检测结果来看,ELSPOT和ELISA检测结果都能很好地反映抗原特异性T细胞应答的走势和Ag85B和EC两种抗原的免疫原性差异,因此,在评价该疫苗的细胞免疫应答时,如果不必检测分泌抗原特异性细胞因子的细胞频率,仅定量检测细胞因子分泌量,选择ELISA即可。
总之,本研究中的结核亚单位新疫苗在小鼠模型中可诱导稳定的抗原特异性记忆T细胞,产生有利于抗结核的细胞免疫应答。目前,该疫苗对结核分枝杆菌敏感动物豚鼠的抗结核作用正在验证中,初期实验效果良好。因此,本研究结果可为疫苗的免疫保护力效果提供药理学依据。由于时间关系,本研究对疫苗末次免疫后8周内的细胞免疫应答仅进行了一种细胞因子的检测,其他Th1因子应答,多功能T细胞亚群分析,以及更长时间后的应答水平等将有利于全面了解该疫苗的细胞免疫机制,这些还需进一步研究。
[1]Ottenhoff TH,Kaufmann SH.Vaccines against tuberculosis:where are we and where do we need to go?PLoS Pathog,2012,8(5):e1002607.
[2]Bertholet S,Ireton GC,Ordway DJ,et al.A defined tuberculosis vaccine candidate boosts BCG and protects against multidrug-resistant Mycobacterium tuberculosis.Sci Transl Med,2010,2(53):53-74.
[3]赵爱华,李凤祥,寇丽杰,等.卡介菌CpG DNA复合佐剂-02系统 (BC-C02)有效性与安全性评价.中国防痨杂志,2012,34(3):161-167.
[4]Chen L,Xu M,Wang ZY,et al.The development and preliminary evaluation of a new Mycobacterium tuberculosis vaccine comprising Ag85b,HspX and CFP-10:ESAT-6fusion protein with CpG DNA and aluminum hydroxide adjuvants.FEMS Immunol Med Microbiol,2010,59(1):42-52.
[5]Lin PL,Dietrich J,Tan E,et al.The multistage vaccine H56 boosts the effects of BCG to protect cynomolgus macaques against active tuberculosis and reactivation of latent Mycobacterium tuberculosis infection.J Clin Invest,2012,122(1):303-314.
[6]Orme IM,Roberts AD,Griffin JP,et al.Cytokine secretion by CD4Tlymphocytes acquired in response to Mycobacterium tuberculosis infection.J Immunol,1993,151(1):518-525.
[7]Aagaard C,Hoang T,Dietrich J,et al.A multistage tuberculosis vaccine that confers efficient protection before and after exposure.Nat Med,2011,17(2):189-194.
[8]Scriba TJ,Tameris M,Mansoor N,et al.Modified vaccinia Ankara-expressing Ag85A,a novel tuberculosis vaccine,is safe in adolescents and children,and induces polyfunctional CD4+T cells.Eur J Immunol,2010,40(1):279-290.
[9]Eschen KV,Morrison R,Braun M,et al.The candidate tuberculosis vaccine Mtb72FAS02A-Tolerability and immunogenicity in humans.Hum Vaccin,2009,5(7):475-482.
[10]Windish HP,Duthie MS,Ireton G,et al.Protection of mice from Mycobacterium tuberculosis by ID87/GLA-SE,a novel tuberculosis subunit vaccine candidate.Vaccine,2011,29(44):7842-7848.

