深圳市汉族人群转化生长因子β1基因位点多态性与结核病的相关性研究
宋英健 王正 张国良 李巍 张明霞 陈心春 杨林
结核病是由结核分枝杆菌引起的一种世界性的传染病,感染范围波及全球1/3的人群,但感染者中只有10%发展为有症状的活动性结核病,这说明活动性结核病患者对结核病的易感因素有别于健康人。而在活动性结核病患者中临床表现的差异也在一定程度上表明结核病患者之间的易感因素存在差别[1]。结核病在不同人种之间的差异性和双胞胎之间关联性都说明除环境和暴露因素外,宿主遗传因素对结核病发生发展也起到了不可忽视的作用,因此针对结核病易感基因的研究已成为近年研究的热点[2-3]。众所周知,细胞免疫在结核病免疫反应中起着重要作用。而转化生长因子β1(transforming growth factorβ1,TGFβ1)作为一个多功能的细胞因子,可以干扰细胞免疫对于结核病的应答[4]。而且由于TGFβ1可以促进细胞外基质合成,导致组织纤维化[5],其与结核性胸膜炎也有密切的关系,其中宿主遗传学因素可能起着重要的作用。
国外研究也表明,在伊朗人群中TGFβ1单核苷酸多态性 (single nucleotide polymorphisms,SNP)位点rs1800470与结核病的发生具有相关性[6]。但是有关TGFβ1位点与深圳市汉族人群结核病相关性研究未见报道。本研究选取的位点rs4803455,其作为标签SNP(tag SNP,tSNP),不仅携带大量SNP信息,而且与动脉粥样硬化有密切的关系[7]。国外报道称,动脉粥样硬化和结核病发病机制和表现具有相似性,其均为慢性起病,并影响巨噬细胞作用,逃避免疫反应,均形成坏死灶(粥样硬化斑块和干酪样坏死)[8]。所以,笔者利用TaqMan-PCR技术分析探讨广东省深圳市汉族人群中TGFβ1基因tSNP(rs4803455)位点与结核病的关系,寻找TGFβ1(rs4803455)位点基因多态性与结核病、特别是结核性胸膜炎的相关性。
资料和方法
一、研究对象
选取深圳市人民医院和深圳市第三人民医院2008年12月至2010年11月收治的深圳市汉族结核病患者。结核病组总共373例。所有结核病患者的诊断均通过其临床表现、影像学诊断、病原学诊断的结果(根据中华医学会结核病学分会制定的《肺结核诊断和治疗指南》)[9]确诊。肺结核组111例,均根据痰、肺部手术、肺活检组织经细菌学或病理学结果确诊(痰培养阳性26例,痰涂片阳性56例,肺部手术或肺活检组织病理学检测为结核29例)。结核性胸膜炎患者组57例,根据引流后的胸腔积液、胸膜活检组织经细菌学或病理学诊断结果确诊(胸腔积液确诊13例,胸膜活检组织确诊44例)。其他205例结核病患者临床确诊。对照组为健康体检和义务献血者,共350名。排除标准:合并支气管哮喘、肺炎、尘肺、糖尿病、肿瘤、动脉硬化等慢性疾病,合并HIV感染、器官移植、使用肾上腺皮质激素及其他免疫抑制剂等。所有入选对象均为HIV阴性。其中结核组中男251例,女122例,年龄(35.9±33.6)岁。对照组中男138名,女212名,年龄(34.8±30.3)岁。肺结核组中男78例,女33例,年龄(38.0±29.3)岁。结核性胸膜炎组中男39例,女18例,年龄范围(34.9±32.4)岁。
二、检测方法
(一)血液标本的采集和DNA的提取、纯化及保存
采集研究对象外周静脉血1.5ml。采用肝素锂抗凝后利用血液DNA提取试剂盒(Qiagen,德国)从外周血中提取DNA并纯化,取DNA样本1μl,用分光光度计NanoDrop(Thermo Fisher Scientific,美国)测定DNA纯度和浓度。若A260/A280>1.8,A260/A230>2.0,则 DNA 纯度合格,纯化的DNA经琼脂糖水平电泳仪(上海领成生物科技有限公司)电泳验证其质量,并标化浓度值为5ng/μl,-20℃保存。
(二)DNA等位基因检测分析
1.位点SNP分型:选取上述研究对象所提取的合格DNA样本,利用TaqMan-PCR技术检测rs4803455位点基因类型。其TaqMan探针和引物来自于美国AB公司成品的TaqMan试剂盒(Assay ID:C_30031638_10)。TaqMan探针实验反应体系为10μl,其中通用PCR混合液(2×TaqMan Genotyping Master Mix)5.0μl,引物与探针混合液(40×TaqMan SNP Genotyping Assay Mix)0.25μl,DNA(50ng/μl)1.0μl,然后加入重蒸水(ddH2O)至10μl。实验过程为读取扩增前荧光信号、生成扩增数据、读取扩增后的荧光信号。扩增的反应条件为95℃10min;95℃15s,60℃1min,共40个循环[10]。
2.结果判定:此SNP位点的等位基因A与等位基因C的探针分别采用绿色荧光素(greenfluorescent protein,VIC)和羧基荧光素(carboxyfluorescein,FAM)进行标记。样本为等位基因A的纯合子时,PCR扩增过程中仅能检测到VIC荧光;样本为等位基因C的纯合子时,PCR扩增过程中仅能检测到FAM荧光;样本为杂合子时,PCR扩增过程中可同时检测到FAM和VIC两种荧光。
3.结果分析及处理:计算各组等位基因频率,确定是否符合Hardy-Weinberg平衡定律。各组等位基因频率差异采用χ2检验,以P<0.05为差异有统计学意义。结核病与TGF-β1等位基因的相关性通过计算比值比 (odds ratio,OR)和95%可信区间(95%confidence intervals,95%CI)来表示。统计学分析由SPSS 13.0统计学分析软件处理。
结 果
一、等位基因分型结果
采用TaqMan探针技术检测DNA样本rs4803455等位基因类型,等位基因频率和基因型分布符合Hardy-Weinberg平衡定律,说明检测结果有代表性。
其位点等位基因频率结核组和对照组相比差异有统计学意义,结核组等位基因C的基因频率(68.2%)高于对照组(59.4%)(表1)。
二、分层分析
1.性别分层:由于结核组中男性比例较对照组高,采用性别分层分析rs4803455位点等位基因频率,结果显示:两组男性和女性之间差异均有统计学意义。结核组等位基因C的基因频率均高于对照组(表2)。
2.年龄分层:根据既往研究[11]按照年龄分层发现,rs4803455位点等位基因频率在年龄≤25岁中差异无统计学意义,然而在年龄>25岁中差异有统计学意义。等位基因C在结核组中均高表达(表3)。
3.临床类型分层:由于TGFβ1与结核性胸膜炎具有相关性,根据临床类型从结核病患者中挑选出有病理学或者细菌学证据的肺结核组和结核性胸膜炎组。分别与对照组进行统计学分析,发现该位点等位基因频率在对比分析中肺结核组、结核性胸膜炎与对照组之间差异均有统计学意义(表4)。两组等位基因C的基因频率均高于对照组,在结核性胸膜炎组更加明显。
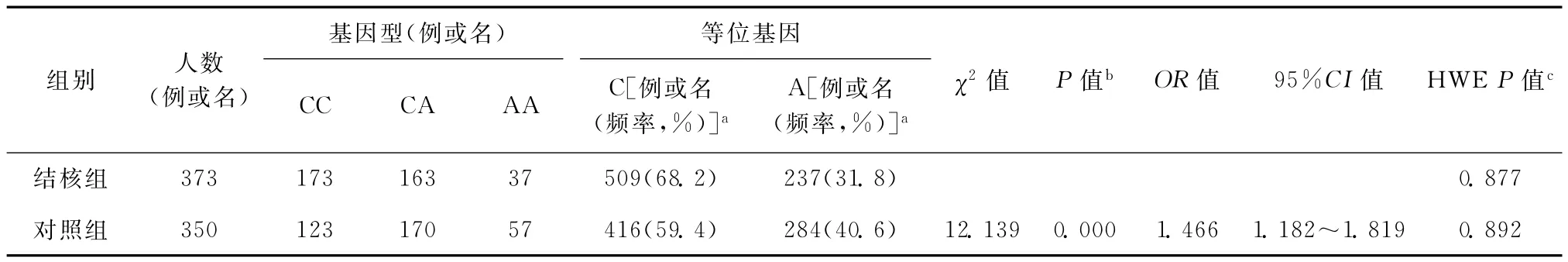
表1 结核组和对照组rs4803455等位基因频率的对比
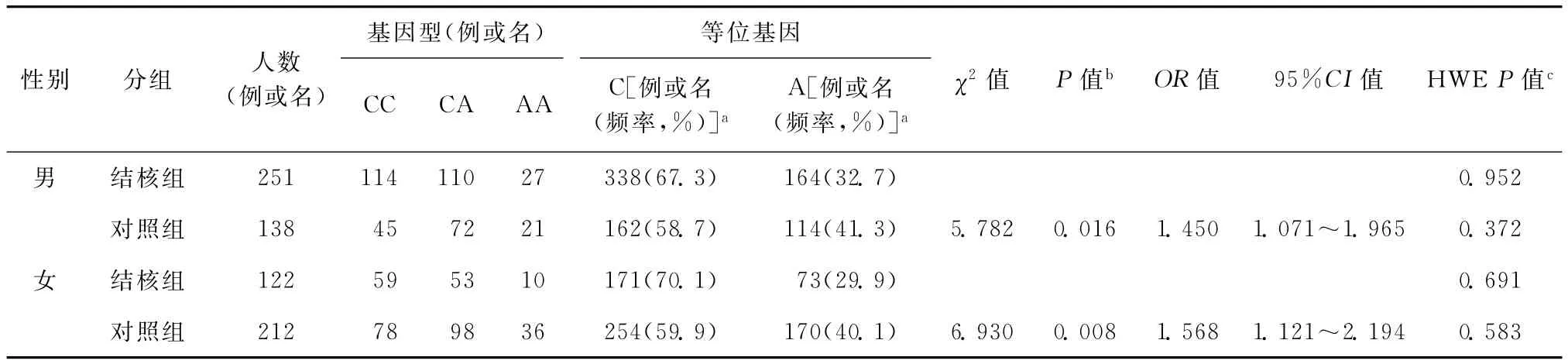
表2 结核组和对照组中不同性别等位基因频率的对比
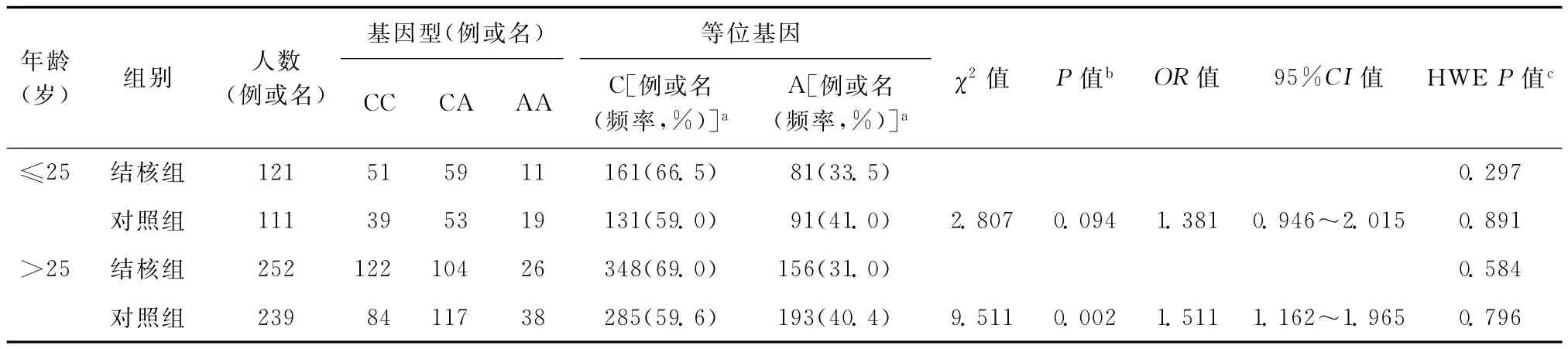
表3 结核组和对照组不同年龄组等位基因频率的对比
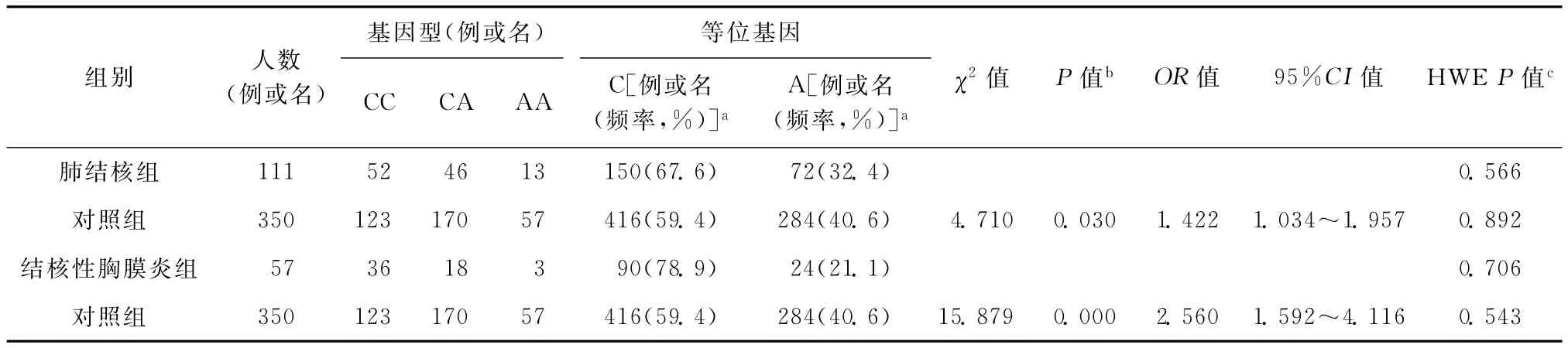
表4 肺结核组和结核性胸膜炎组与对照组等位基因频率的对比
讨 论
众所周知,结核分枝杆菌侵入机体后,结核病的发生、发展和转归不仅取决于结核分枝杆菌的数量和毒力,很大程度上还取决于机体的免疫状态。抗结核免疫主要是通过细胞免疫,而大多数结核病患者都存在免疫功能紊乱、免疫力低下的现象[12]。TGFβ1是一类多功能细胞因子,在细胞免疫调节方面主要发挥免疫抑制作用[13]。文献报道,能够抑制T细胞特别是Th1的增殖,促进其凋亡[14]。其主要通过下调白细胞介素2(IL-2)介导的增殖信号来抑制有丝分裂,从而抑制T细胞增殖;对于已激活的T细胞,通过促进T细胞生长停滞、G1期细胞的积累,增加其对凋亡的敏感度。除此之外TGFβ1能够下调干扰素-γ(IFN-γ)、肿瘤坏死因子-α(TNF-α)的产生和活性,降低中间产物活性氧的释放,从而导致单核巨噬细胞失活[15]。而且国外研究也表明,免疫调节因子TGFβ1在结核病患者血清、巨噬细胞和肺泡灌洗液中表达升高,升高的TGFβ1与结核病复燃有密切的关系[2,16]。综上所述,TGFβ1通过干扰Th1细胞应答和巨噬细胞活化,抑制了炎症反应,降低了机体的抗菌能力,从而降低了结核病患者的免疫功能,导致结核病的发生与发展。本实验利用TaqMan-PCR检测技术,对广东省深圳市汉族结核病患者和健康人TGFβ1基因rs4803455位点基因型进行检测,寻找其与结核病的相关性。
结果表明,rs4803455位点在结核组和对照组中差异有统计学意义,其中等位基因C在结核组频率较对照组高,也明显高于国外文献报道,而对照组中等位基因C基因频率与国外文献报道相近[17]。提示其可能作为危险因素在结核病的发生发展中起着重要作用。在性别分层分析中,男性、女性之间差异有统计学意义。而在年龄分层中rs4803455位点等位基因频率在年龄≤25岁组中差异无统计学意义,然而在年龄>25岁组差异有统计学意义。提示rs4803455位点基因型在年龄>25岁组预测作用更大,而年龄本身与基因类型无关。其差别可能是由于年龄作为一个独立因素,可以影响机体免疫功能,从而影响TGFβ1免疫应答造成。具体原因需要更多的实验研究证实。
Li等[18]的研究发现,在结核性胸膜炎患者胸腔积液中TGF-β1和IL-10抑制结核保护性免疫细胞Th1细胞的活性,降低IFN-γ的分泌,导致机体免疫力下降。所以,本研究依据位点rs4803455检测结果分别比较已通过细菌学或者病理学明确诊断的肺结核组、结核性胸膜炎组与对照组之间等位基因频率的差异,寻找之间的差异。根据统计学分析,两组之间差异均存在统计学意义,而且在结核性胸膜炎组中等位基因C为危险因素,其等位频率明显高于肺结核组。
由于SNP位点间存在连锁不平衡现象,相关联SNP位点包含的遗传信息相互重叠,具有冗余性,单个普通SNP位点又缺乏疾病代表性。而International HapMap Consortium[19]运用单体型分型的方法找出了约50万个tSNP来代表整个人类基因图谱之中的SNP集合,这些tSNP与表型间的关联性更大。基因位点rs4803455作为tSNP位点代表大量的SNP信息,增加了SNP分型的有效性,对多基因疾病研究极其重要。国外文献报道该位点位于TGF-β1内含子区域,其与动脉粥样硬化、近视眼发病均有密切的关系[7,20],其中等位基因C作为危险因素在患者组中均高表达,而且其与已报道跟结核病具有相关性的rs1800470位点存在连锁不平衡现象,其中rs4803455等位基因C与rs1800470等位基因C具有明显的正相关性[20]。而研究者已发现在rs1800470位点含有等位基因C的人群血浆中TGF-β1浓度明显升高[21],从而也可以判断在rs4803455位点含有等位基因C的人群中血浆中TGF-β1浓度也存在升高现象。这可能是rs4803455位点等位基因C携带者更易引起结核病患者临床症状的主要原因。具体原因有待更多的研究来寻找其与TGF-β1表达和结核病的关系。但是作为tSNP的rs4803455位点对于结核的预测作用较rs1800470更大。
综上所述,TGF-β1中tSNP(rs4803455)位点的基因多态性可能与深圳地区中国汉族人群结核病的发生具有一定的相关性,其在结核性胸膜炎患者的相关性更加明显,而在年龄>25岁的患者中这种预测作用更大。通过对结核病遗传易感性的进一步研究将有助于对结核病特别是结核性胸膜炎的高危人群进行预测,并寻找可能的干预措施以降低结核病的发病率,为最终控制结核病疫情提供科学依据和理论基础。
[1]Chen XC,Zhang MX,Liao MF,et al.Reduced Th17response in patients with tuberculosis correlates with IL-6Rexpression on CD4+T cells.Am J Respir Crit Care Med,2010,181(7):734-742.
[2]Taype CA,Shamsuzzaman S,Accinelli RA,et al.Genetic susceptibility to different clinical forms of tuberculosis in the Peruvian population.Infect Genet Evol,2010,10(4):495-504.
[3]Law WS,Yew WW,Chiu Leung C,et al.Risk factors for multidrug-resistant tuberculosis in Hong Kong.Int J Tuberc Lung Dis,2008,12(9):1065-1070.
[4]Fiorenza G,Rateni L,Farroni MA,et al.TNF-alpha,TGF-beta and NO relationship in sera from tuberculosis(TB)patients of different severity.Immunol Lett,2005,98(1):45-48.
[5]Broekelmann TJ,Limper AH,Colby TV,et al.Transforming growth factor beta 1is present at sites of extracellular matrix gene expression in human pulmonary fibrosis.Proc Natl Acad Sci U S A,1991,88(15):6642-6646.
[6]Amirzargar AA,Rezaei N,Jabbari H,et al.Cytokine single nucleotide polymorphisms in Iranian patients with pulmonary tuberculosis.Eur Cytokine Netw,2006,17(2):84-89.
[7]Deng HB,Jiang CQ,Tomlinson B,et al.A polymorphism in transforming growth factor-β1is associated with carotid plaques and increased carotid intima-media thickness in older Chinese men:the Guangzhou Biobank Cohort Study-Cardiovascular Disease Subcohort.Atherosclerosis,2011,214(2):391-396.
[8]Anestad G,Hoel T,Scheel O,et al.Atherosclerosis and tuberculosis:are they both chronic infectious diseases?Scand J Infect Dis,2001,33(10):797.
[9]中华医学会结核病学分会.肺结核诊断和治疗指南.中华结核和呼吸杂志,2001,24(2):70-74.
[10]李成涛,林源,柳燕,等.实时DNA定量技术的应用研究.中国司法鉴定,2007,(3):28-30.
[11]Zhang G,Zhou B,Wang W,et al.A functional single-nucleotide polymorphism in the promoter of the gene encoding interleukin 6is associated with susceptibility to tuberculosis.J Infect Dis,2012,205(11):1697-1704.
[12]Flynn JL,Chan J.Immunology of tuberculosis.Annu Rev Immunol,2001,19:93-129.
[13]Chamberlain J.Transforming growth factor-beta:apromising target for anti-stenosis therapy.Cardiovasc Drug Rev,2001,19(4):329-344.
[14]沈永泉,李在连.转化生长因子β:参与结核病致病的免疫分子.中华结核和呼吸杂志,2000,23(3):181-182.
[15]Hirsch CS,Yoneda T,Averill L,et al.Enhancement of intracellular growth of Mycobacterium tuberculosis in human monocytes by transforming growth factor-beta 1.J Infect Dis,1994,170(5):1229-1237.
[16]Rosas-Taraco AG,Higgins DM,Sánchez-Campillo J,et al.Local pulmonary immunotherapy with siRNA targeting TGF β1enhances antimicrobial capacity in Mycobacterium tuberculosis infected mice.Tuberculosis(Edinb),2011,91(1):98-106.
[17]Ito M,Hanaoka M,Droma Y,et al.The association of transforming growth factor beta 1gene polymorphisms with the emphysema phenotype of COPD in Japanese.Intern Med,2008,47(15):1387-1394.
[18]Li Q,Li L,Liu Y,et al.Biological functions of Mycobacterium tuberculosis-specific CD4+T cells were impaired by tuberculosis pleural fluid.Immunol Lett,2011,138(2):113-121.
[19]International HapMap Consortium.The International HapMap Project.Nature,2003,426(6968):789-796.
[20]Zha Y,Leung KH,Lo KK,et al.TGFβ1as a susceptibility gene for high myopia:a replication study with new findings.Arch Ophthalmol,2009,127(4):541-548.
[21]Fuku N,Mori S,Murakami H,et al.Association of 29C>T polymorphism in the transforming growth factor-β1gene with lean body mass in community-dwelling Japanese population.Geriatr Gerontol Int,2012,12(2):292-297.

