拟南芥GA2ox基因家族启动子分析
段秋红,赵小英,贺热情,郭 明,刘德荣,唐冬英,刘选明
(湖南大学生物学院,湖南长沙410082)
赤霉素(Gibberellin,GA)是一类双萜物质,是常见植物激素之一。目前已发现赤霉素类物质136种[1-3]。其中少数 GA 具有生物活性,如 GA1、GA4等,其他生物形态的GA只是在赤霉素的合成过程中起着中间产物的作用,其本身并没有太大功能[4-5]。具有生物活性的 GAs影响植物的整个生命周期,如影响种子的萌发、茎的生长、花的发育和果实的成熟[6]。GA2-氧化酶(GA2-oxidase),作用于有生物活性的GA1和GA4,使两者在C-2位羟基化转变成无活性的GA8和GA34,通过减少GAs的水平来调节植物的生长,如使植物矮化、节间缩短[7-8]。拟南芥GA2ox是由8个(GA2ox1-8)成员编码的双加氧酶,每个基因所参与的调控不同。一些GA2ox编码的蛋白参与植物光形态建成,光通过诱导GA2ox基因的表达降低植物体内有生物活性的GA4而促进光形态建成[9-11];部分编码的蛋白具有催化植物激素(如吲哚乙酸、水杨酸等)与氨基酸联结的功能[12-13],可能参与植物体内的激素代谢和逆境胁迫响应过程。
真核基因的表达与调控是涉及多个基因、多条信号途径及多基因产物的复杂过程。从转录及转录后水平、翻译及翻译后水平、蛋白质加工水平对基因的表达进行精细调控[14],首先是由启动子与转录因子在转录水平上的表达调控,因此启动子的作用十分关键。本研究提取了拟南芥GA2ox基因家族的启动子以及蛋白质序列,利用生物信息学分析软件构建进化树,对蛋白模体和顺式元件进行分析,探讨基因定位、进化关系、蛋白模体同源性以及顺式元件的保守性,了解高保守顺式元件与GA2ox基因表达调控的相关性,详细分析了各类激素如何调控GA2ox基因的表达,为后续GA2ox基因表达调控的研究提供了依据。
1 材料与方法
1.1 蛋白质与启动子序列的确定
从TAIR网站获得GA2ox基因家族的全基因组序列、CDS序列和蛋白质序列,并取得染色体、外显子、内含子信息,同时获取翻译起始密码子上游1 500 bp序列,用于对GA2ox基因家族的启动子分析。
1.2 蛋白模体获取与进化树构建
利用MEME在线分析GA2ox蛋白模体,设置模体长度最大为300、最小为6,模体最多设为10。将获得的GA2ox氨基酸序列构建进化树,其聚类结果利用 MEGA5绘制进化树[15]。
1.3 顺式元件分析
从PLACE在线分析GA2ox基因上游1 500 bp启动子序列,获取GA2ox基因高同源性以及特异性的顺式元件。利用DMB序列局部比对分析软件,设置上游元件长度最大为12 nt、最小为5 nt,每个长度寻找元件最多设为15,分析选择EM2模式,对105个模体进行分析[16]。利用 Plant CARE分析与PLACE以及DMB共同的保守元件。
1.4 基因芯片分析
利用 BAR HeatMapper tool、AtGenExpress Visual-ization Tool、PLEXdb以及 NCBI网站,获取 GA2ox基因家族的各个组织器官的表达量以及不同激素处理下GA2ox表达量的变化。
2 结果和分析
2.1 AtGA2ox基因家族染色体定位、内含子和外显子分布
在拟南芥中有 8个完整的 GA2ox基因,因GA2ox5为假基因,所以只对7个GA2ox基因进行染色体定位分析,结果表明,该家族五个基因定位在1号染色体上,GA2ox3分布在4号染色体上,GA2ox8分布在2号染色体上(见图1c)。外显子和内含子分析显示GA2ox基因具有相似的内含子和外显子结构,均为2个内含子和3个外显子,且外显子的长度变化较小(见图1a、b)。GA2ox基因染色体定位与外显子、内含子结构分布的保守性,可能存在某些功能的相似性。
2.2 AtGA2ox基因家族进化关系
根据拟南芥GA2ox基因氨基酸序列构建进化树,并对蛋白模体进行比对分析(见图2)。拟南芥GA2ox基因家族可以分为两亚类:一类作用于C19-GAs的 AtGA2ox1-6,AtGA2ox1-3的亲缘关系较近,而AtGA2ox4,6与前3条序列亲缘关系较远;另一类作用于C20-GAs的AtGA2ox7-8[8],说明拟南芥中同时存在2种具有不同特异性的GA2-氧化酶。蛋白模体分析表明,GA2ox基因家族10个蛋白模体结构基本类似,预示该家族在进化上可能具有一定的保守性,同时进化关系越相近的亚类,其模体同源性越高,且模体结构位置分布更接近,这些差异也说明为什么GA2ox基因家族两个亚类具有不同功能。
2.3 AtGA2ox基因家族启动子顺式元件特性
2.3.1 保守顺式元件
利用DMB分析GA2ox基因家族得到105个保守序列,出现频率大于70%(在5条以上序列中出现)的保守序列共有38个,约占36%。有21个保守序列可在PLACE数据库中找到相应的顺式元件(见表1),诸多保守元件是与组织或器官特异性表达相关,调控基因在根、茎、叶、花、种及胚中的表达。其中NODCON1GM是与根瘤菌有关的特异性保守序列,在植物细胞被感染后对基因转录起调节作用;ARRlAT和CPBCSPOR与细胞分裂素有关,参与细胞分裂素的应答调节[17-18];DOFCOREZM 能与 Dof蛋白结合,参与碳代谢途径[19];GT1CONSENSUS具有能与GT-1结合的保守序列,是典型的植物光调控元件;IBOXCORE元件可能参与光信号调控途径;ANAER-O1CONSENSUS位于厌氧应答基因上游调控区,可 能 参 与 厌 氧 基 因 的 表 达 调 控[20];MYB1CORE能被植物抗旱元件MYB识别,且参与植物的苯丙素代谢以及植物生长发育的调控[21-24];WBOXATNPR1是与伤害防御相关的元件;而BIHD1OS、CCAATBOX1 是与胁迫响应相关的元件[25]。
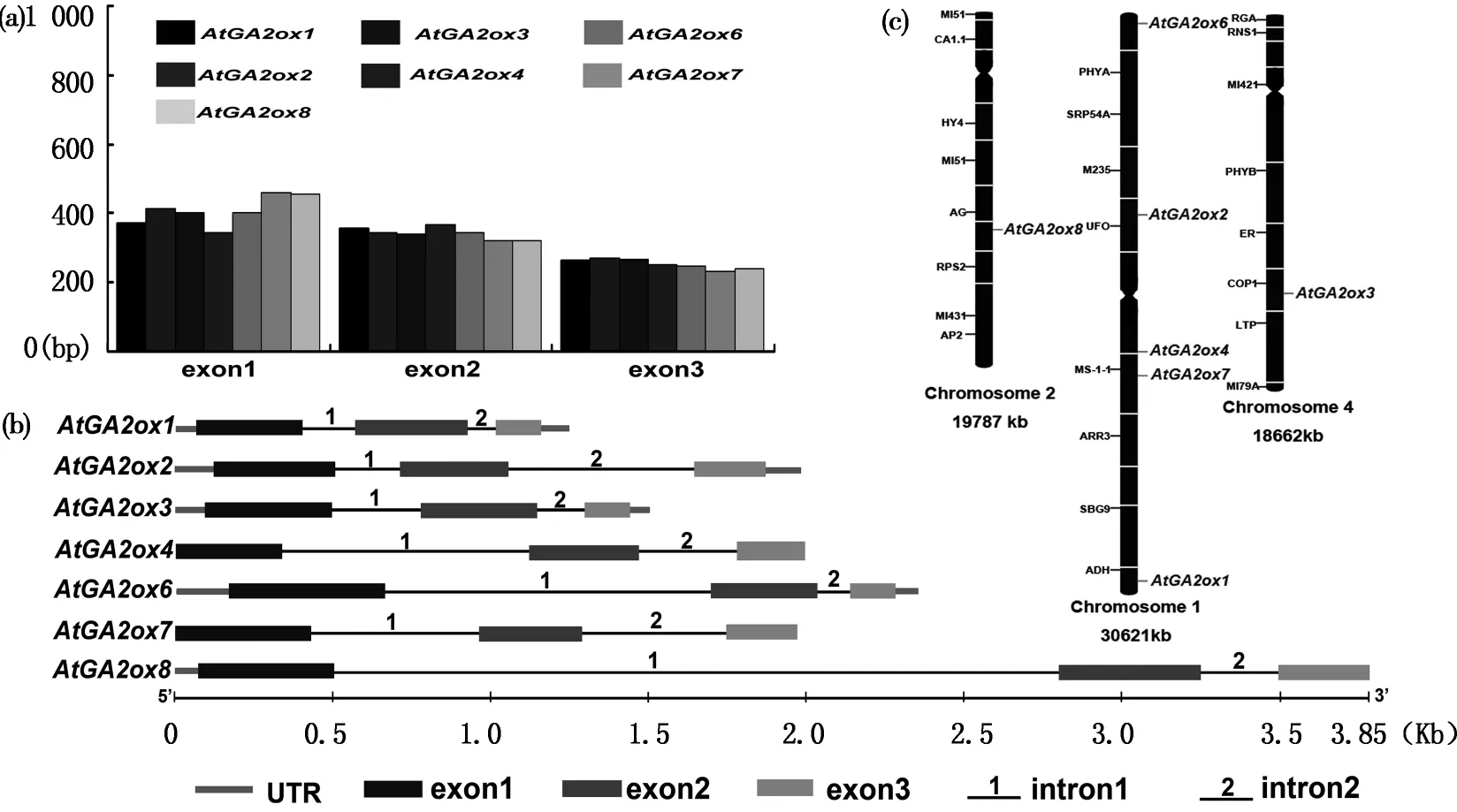
图1 拟南芥AtGA2ox基因家族的染色体定位以及外显子、内含子分布图Fig.1 The chromosome and exon-intron location of AtGA2ox gene family

图2 拟南芥AtGA2ox基因家族的进化树以及蛋白模体分布Fig.2 Phylogenetic tree and protein motifs location of AtGA2ox gene family
Plant CARE分析结果表明GA2ox基因上游启动子除TATA-box、CAAT-box等真核生物启动子结构元件外,还存在诸多保守元件(见图3),与DMB和PLACE软件分析一致。综上所述,GA2ox基因启动子存在光、耐旱、耐低温、防御元件以及增强基因的转录活性相关元件;还存在脱落酸(Abscisic acid,ABA)、水杨酸(Salicylic acid,SA)、茉莉酸(Jasmonate,JA)、乙烯(Ethyl-ene,ET)、生长素(Auxin,IAA)、赤霉素等激素以及生物钟响应元件等。
2.3.2 与光相关的顺式元件
由图3可知,GA2ox家族每个基因中至少存在8个光顺式作用元件,且均匀分布在上游1 500bp启动子调控区。所有基因中都存在着一些典型的光元件,如:G-box与GT1,此类元件对于维持启动子功能与调控GA2ox基因转录是起非常重要的作用。一部分光元件仅存在于进化关系相近的GA2ox基因家族中,如:分布在 C19-GAs亚类的 SP1,仅存在于GA2ox1-3启动子中的 ATCT-motif、LS7、chs-CMA1a 以及BoxⅡ。部分光元件(如G-box)必须和其它的光元件组合才能使启动子具有光调节特性,且类型和数量不同的光元件具有不同光调控特性[26],因此GA2ox基因家族光元件种类、数量及与彼此之间的距离,可能影响各个基因的转录造成不同光调控 特性。
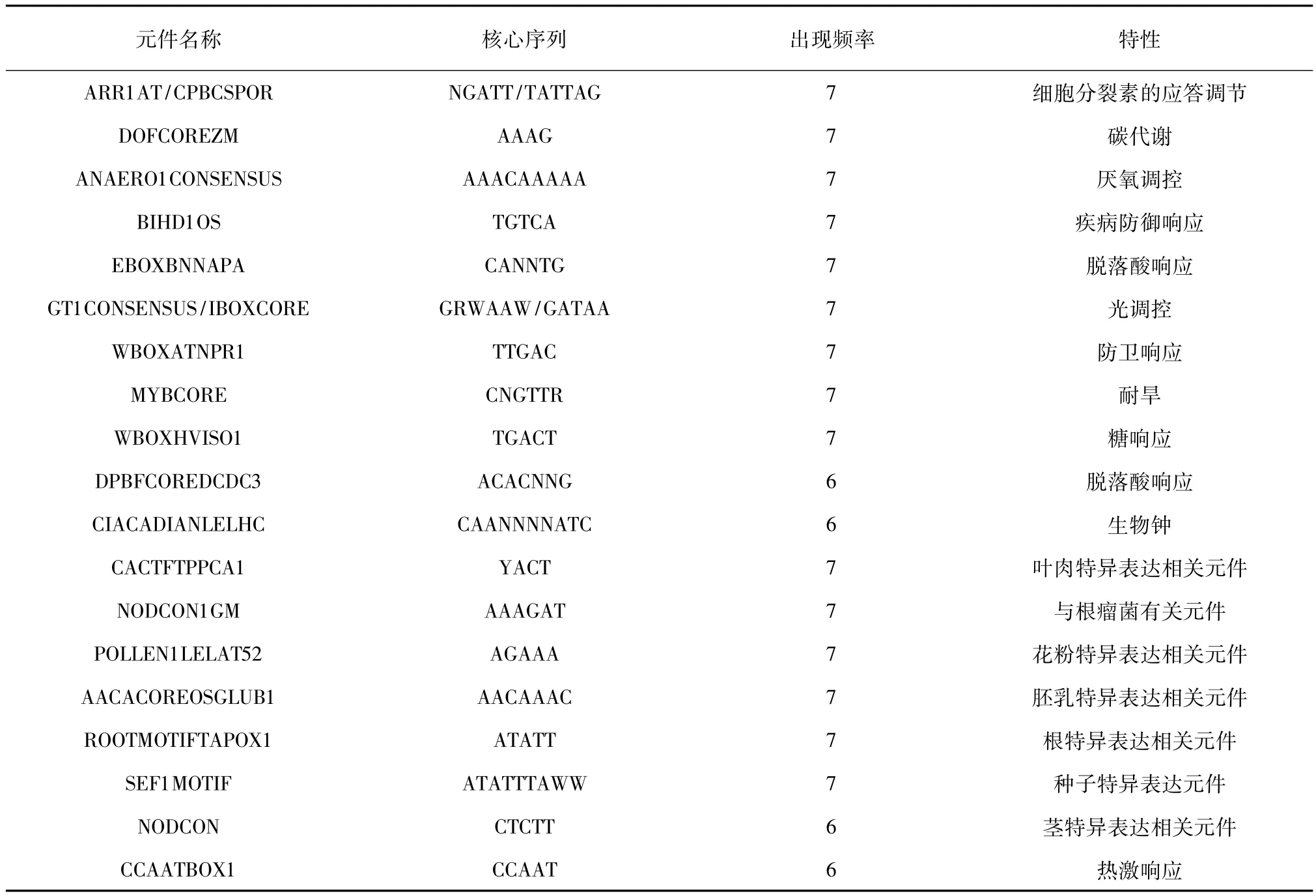
表1 AtGA2ox基因家族启动子保守顺式元件统计Table 1 Conservative cis-elements statistics of AtGA2ox gene family

图3 AtGA2ox基因家族启动子保守顺式元件分布Fig.3 Conservative cis-elements location of AtGA2ox gene family
2.3.3 与植物激素和胁迫相关的顺式元件
除诸多光保守元件外,在GA2ox基因启动子序列中还发现许多与激素和胁迫相关的元件,如表2和图3所示。现从中选取较为典型的顺式元件进行分析。由表2可知分布较广的为ABA、IAA和ET响应元件,所有基因均存在ET和IAA响应元件,共分布 11个 ERELEE4,而 GA2ox3则含有 4个ERELEE4;6个GA2ox基因家族中存在11个ABA元件ABRELATE-RD1,其中GA2ox2和GA2ox7含有3个此元件;GA2ox基因家族有5个成员含GA和JA响应元件,且JA元件达到14个。同时胁迫响应元件MYB、Wbox等存在于所有基因中。有研究发现植物体内激素可以作为“逆境激素”[27],在植物抗盐、抗旱和抗寒的生理过程中起作用,因此,当植物处于高盐、干旱和低温胁迫下,诱导启动子胁迫响应元件的表达,同时也可能诱导激素响应元件,共同调控GA2ox的表达。
2.3.4 其他顺式元件
在研究GA2ox基因顺式元件与该家族的进化关系时,发现除光元件以外,其它顺式元件在进化关系选择上也具有一定规律性。如:与温度调控相关的元件LTR仅存在于GA2ox1-2以及GA2ox8启动子中;CTAG-motif元件仅分布在 GA2ox1和 GA2ox3中;真菌诱导响应元件Box-W1仅出现在GA2ox4和GA2ox6中。同时,GA20x基因各自存在一些独特的功能元件,如:GA2ox1的 ACE元件;GA2ox6的MRE、HD-Zip1以及HD-Zip2元件;GA2ox3的P-box元件等。因此,GA2ox启动子既存在诸多保守元件,又具有自身特异性元件,说明启动子部分区域序列呈现多态性,在基因进化选择时也可能因特异启动子调控基因的表达模式不同而出现差异。
2.4 AtGA2ox基因家族表达谱
利用基因芯片对AtGA2ox基因家族的分析表明(见图4),GA2ox各个基因在种子、根、叶、花以及果荚中都有表达,其中GA2ox1、GA2ox3和GA2ox4在花和果荚中表达量高,GA2ox2在老叶中表达量较高,GA2ox6、GA2ox8在根、叶中表达量较高,而GA2ox7在下胚轴中表达量高。数据表明,GA2ox基因在不同发育阶段以及不同组织部位的表达均可能受到严格的控制,且与GA2ox存在大量的组织器官顺式元件分析结果保持一致(见表1)。

图4 拟南芥AtGA2ox基因家族组织器官相对表达量Fig.4 Tissue and organ-specific expression of AtGA2ox genefamily
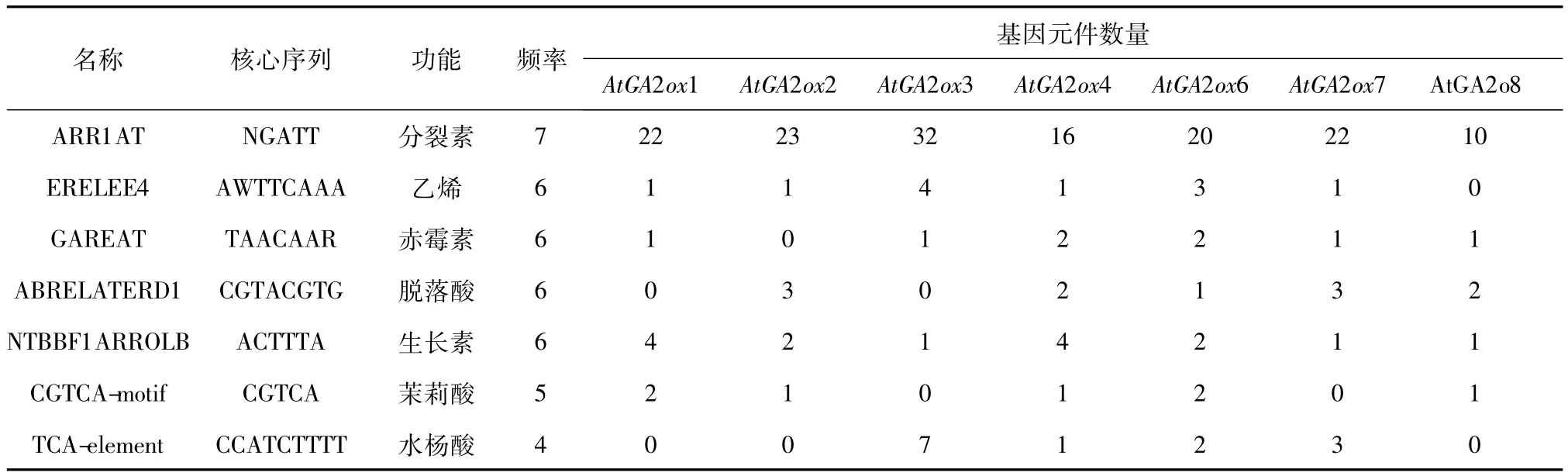
表2 AtGA2ox基因家族启动子中与激素相关的元件Table 2 The phytohormone cis-elments of AtGA2ox gene family promoter
为研究GA2ox大量的激素响应元件是如何调控基因的表达,我们选取了芯片数据库10 μM ABA、ACC以及1 μM GA、MJ、IAA分别处理拟南芥野生型0 h、0.5 h、1 h、3 h 的 GA2ox表达数据(见图5),结果显示,GA2ox8和GA2ox6在IAA处理后上调表达,而其他基因在处理后均下调,其中对IAA最敏感的是含有2个生长素响应元件的GA2ox6,而不含生长素响应元件的GA2ox3其表达也下调,这说明IAA诱导生长素响应元件的表达对植物生长的重要性,同时也可能存在其他未被鉴定的生长素响应元件。
ABA上调GA2ox6和GA2ox7基因的表达,而下调其他基因。除GA2ox3,茉莉酸合成前体茉莉酸甲酯(MJ)和乙烯合成前体 1-氨基环丙烷-1-羧酸(ACC)均能降低GA2ox基因的表达。在GA处理下,所有GA2ox表达降低,但随着处理时间延长,其表达微升。在外源赤霉素的处理下,会促进有生物活性的GA1和GA4积累,而使GA失活的GA2ox基因表达会降低,但持续处理下,植物体内复杂的负反馈调控机制可能会起作用,因此致使大部分GA2ox在3 h出现一定的上调。
在各类激素处理后,GA2ox基因家族表达量均受到不同程度的影响,这与启动子中含有ABA、GA、IAA、JA和ET响应元件的分布结果基本相吻合。
3 讨论
拟南芥GA2ox基因家族集中分布在1号染色体上,内含子和外显子的结构分布具有高相似性,蛋白序列具有高保守性,其进化关系较近的模体结构分布位置基本相同。GA2ox基因上游启动子区域内存在大量光响应元件,但一部分光元件仅分布在进化关系相近的基因中,同时各个基因都具有自身特异性的顺式元件。这说明GA2ox无论是蛋白还是启动子都具有高保守性,预示基因功能可能具有相似性;同时特异顺式元件调控不同基因的表达对揭示其进化关系也将提供有价值的线索。

图5 AtGA2ox基因表达对吲哚乙酸、脱落酸、ACC、茉莉酸甲酯和赤霉素处理的响应Fig.5 Expression of AtGA2ox in response to IAA,ABA,ACC,MJ and GA treatments
由GA2ox基因家族表达谱可知,在各类激素条件处理后,GA2ox表达量均受到不同的程度的影响。这些影响说明GA2ox不仅仅是赤霉素代谢途径中的关键酶[11],同时涉及激活水杨酸、吲哚乙酸和脱落酸信号途径,并响应茉莉酸以及乙烯元件的调控。在相同激素处理下,GA2ox基因家族成员所受调控不同,如在ABA、IAA处理后,GA2ox6基因的表达上调,但下调GA2ox1-4,这说明GA2ox的顺式元件不但可以作为正调控元件,在环境胁迫下,诱导GA2ox家族部分基因的表达,而且还能作为负调控元件,抑制其他基因的表达[27]。
除各类激素元件外,GA2ox启动子区还存在各种响应生物及非生物胁迫的顺式元件,如光、耐盐、耐旱、温度、伤害防御等相关元件。当植物抵抗生物胁迫和非生物胁迫时,会涉及多个信号途径,并且会形成一套完整的防御机制,而这套完整的机制可能因生物和非生物胁迫响应元件的不同调控起作用[26-30]。有研究者发现 IAA 元件需要 G-box和TGA-box等协同作用[31];ABA元件两侧都存在影响其活性的G-box[32];而光元件G-box必须和其他元件相互作用才能发挥其特性[26];与植物抗逆反应相关的ABA、SA 元件[33],需要在 MYB、BIHD1OS 等元件的协调下,才能作为“逆境激素”起作用[27,34-35]。因此,在环境信号刺激下,各类顺式元件协同起作用,特异性地调控GA2ox基因在植物体内的表达,提高植物对环境胁迫的适应能力,同时各类顺式元件的互作也说明GA2ox基因表达调控的复杂性。
此外,部分拟南芥GA2ox基因家族成员,在启动子区并未预测到含有某类激素应答元件,但在相应激素处理后其表达也受到调控。如不含IAA和ABA元件的GA2ox3,在这两类激素处理下,其表达量均下调,这可能由于GA2ox3上游启动子存在其他未被鉴定的激素元件,或是由于GA2ox3启动子元件的种类、数量及彼此之间的距离对GA2ox3转录影响的结果[14],同时也可能是GA2ox基因家族各成员的启动子存在相互调控或是结合多个转录因子的结果[26],具体弄清GA2ox基因启动子的调控机制,还需大量的实验证据。
保守顺式元件调控基因的表达和启动子元件的多元化,以及与启动子结合的转录因子的多样性,决定了启动子的作用机制是一个十分复杂的过程[26]。而GA2ox基因启动子中的生物胁迫和非生物胁迫响应元件具体是如何行使其功能的?是独立还是互作?若是互作,与其互作的转录因子是什么?GA2ox基因启动子序列的保守性与特异性在进化选择上具体起什么作用?这些问题都是目前研究的关键,有关GA2ox基因启动子响应逆境胁迫的许多问题还需要继续探索。
References)
[1] Phinney B O,West C A,Ritzel M,Neely P M.Evidence for“gibberellin - like”substances from flowering plants[J].PNAS,1957,43:398 -404.
[2] Kawaide H.Biochemical and molecular analyses of gibberellin bynthesis in fungi[J].Biosci.Biotechnol.Biochem,2006,70(3):583-590.
[3] 常丽,赵小英,郭明,林建中,李秀山,刘选明.GA2ox1氧化酶基因的克隆及原核表达[J].西北植物学报,2010,30(6):1099 -1104.
[4] Hedden P,Phillips A L.Gibberellin metabolism:new insights revealed by the genes[J].Trends in Plant Science,2003,5:523 -530.
[5] MacMillan J.Occurrence of gibberellins in vascular plants,fungi and bacteria[J].Plant Growth Regulation,2001,20:387 -442.
[6] FleetC M,Yamaguchi S,Hanada A,Kawaide H,David C J,Kamiya Y,Sun T P.Overexpression of AtCPS and AtKS in Arabidopsisconfersincreased ent-kaureneproduction butno increase in bioactive gibberellins[J].Plant Physiology,2003,132:830-839.
[7] Ross J J,Reid J B,Swain S M,Hasan O,Poole A T,Hedden P,Willis C L.Genetic regulation of gibberellin deactivation in Pisum[J].The Plant Journal,1995,7:513 - 523.
[8] Schomburg F M,Bizzell C M,Lee D J,Zeevaart J A,Amasino R M..Overexpression of a Novel class of Gibberellin 2 - oxidases Decreases Gibberellin levels and Creates Dwarf Plants[J].The Plant Cell,2003,15:151 -163.
[9] Zhao X Y,YU X H,Foo E,Gregory M,Symons,Javier L,Krishnaprasad T.Bendehakkalu,Xiang J,Lin C T.A study of gibberellin homeostasis and cryptochrome-mediated blue light inhibition of hypocotyl elongation[J].Plant Physiology,2007.145:106 -118.
[10]李研,赵小英,郭明,李旭,黄绿红,唐冬英,郭新红,刘选明.GA2ox8基因过量表达诱导蓝光下拟南芥光形态建成[J].植物生理学通讯,2008,44(3):421-425.
[11]赵小英.蓝光抑制拟南芥下胚轴伸长和诱导种子萌发的生化分析[D].长沙:湖南大学,2006.
[12] Staswick P E,Tiryaki I.The oxylipin signal jasmonic acid is activated by an enzymethatconjugatesitto isoleucine in Arabidopsis[J].The Plant Cell,2004,16(8):2117 - 2127.
[13] Staswick P E,Serban B,Rowe M,Tiryaki I,Maldonado M T,Maldonado M C,Suza W.Characterization of an Arabidopsis enzyme family that conjugates amino acids to indole-3-acetic acid[J].The Plant Cell,2005,17:616 -627.
[14]郭晋艳,郑晓瑜,邹翠霞,李秋莉.植物非生物胁迫诱导启动子顺式元件及转录因子研究进展[J].生物技术通报,2011,(4):16-20.
[15] Tamura K,Dudley j,Nei M,Kumar S.MEGA4:Molecular Evolutionary Genetics Analysis(MEGA)Software Version 4.0[J].Molecular Biology and Evolution,2007,24:1596 -1599.
[16]孙涛,柴团耀,张玉秀.拟南芥GH3基因家族启动子序列分析[J].中国科学院研究生院学报,2010,27(6):847 -852.
[17] SakaiH,Honma T,Aoyama T,Sato S,Kato T,Tabata S,Oka A.ARRl,a transcription factor for genes immediately responsive to cytokinins[J].Science,2001,294:1519 -1521.
[18] SakaiH,Aoyama T,Oka A.Arabidopsis ARR1 and ARR2 response regulators operate as transcriptional activators[J].The Plant Journal,2000,24:703 -711.
[19]郭晓芳,严海燕.植物中的Dof蛋白和Dof转录因子家族[J].植物生理学通讯,2005,41:419-423.
[20] Riou C,Herve C,Pacquit V,Dabos P,Lescure B.Expression of an Arabidopsis lectin kinase receptor gene,lecRK - a1,is induced during senescence,wounding and in response to oligogalacturonic acids[J].Plant Physiol Biochem,2002,40:431 -438.
[21] RomeroI,Fuertes A,Benito M J,Malpica J M,Levva A,Paz-Ares J.More than 80R2R3-MYB regulatory genes in the genome of Arabidopsis thaliana[J].The Plant Journal,1998,14:273 -284.
[22] Braun EL,Grotewold E.Newly Discovered Plant c-myb-Like Genes Rewrite the Evolution of the Plant myb gene family[J].Plant Physiology,1999,121:21 -24.
[23] Meissner R C,Jin H,Comineli E,Denekamp M,Fuertes A,Greco R,et a1.Function Search in a Large Transcription Factor Gene Family in Arabidopsis:Assessing the Potential of Reverse Genetics to Identify Insertional Mutations in R2R3 MYB Genes[J].Plant Cell,1999,11:1827 -1840.
[24]刘蕾,杜海,唐晓风,吴燕民,黄玉碧,唐益雄.MYB转录因子在植物抗逆胁迫中的作用及其分子机理[J].遗传,2008,30(10):1265-l271.
[25]罗红丽.水稻抗病性相关 homeodomain型转录因子基因OsBIHD1的克隆鉴定与功能分析[D].杭州:浙江大学,2004.
[26]张毅,尹辉,李丹,朱巍巍,李秋莉.植物环境响应启动子的诱导元件及转录因子[J].中国生物工程杂志,2007,27(7):122-128.
[27]张计育,王庆菊,郭忠仁.植物AP2/ERF类转录因子研究进展[J].遗传,2012,34(7):835-847.
[28] Kunkel B N,Brooks D M.Cross talk between signaling pathways in pathogen defense[J].Curr Opin Plant Biol,2002,5:325 - 331.
[29] Chinnusamy V,Schumaker K,Zhu J K.Molecular genetic perspectives on cross-talk and specificity in abiotic stress signalling in plants[J].J Exp Bot,2004,55(395):225 - 236.
[30] FujitaM,Fujita Y,Noutoshi Y,Takahashi F,Narusaka Y,Shinozaki K.Crosstalk between abiotic and biotic stress responses:a current view from the points of convergence in the stress signaling networks[J].Curr Opin Plant Biol,2006,9(4):436 -442.
[31] Liu ZB,Hagen G,Guilfoyle T J.A G - Box- Binding protein from soybean binds to the E1 auxin-response element in the soybean GH3 promoter and contains a proline - rich repression domain[J].Plant Physiology,1997,115(2):397 -407.
[32] Shen Q J,Casaretto J A,Zhang P,Ho T H .Functional definition of ABA-response complexes:the promoter units necessary and sufficient for ABA induction of gene expression in barley(Hordeum vulgare L.)[J].Plant Mol Biol,2004,54(1):111 - 124.
[33] UnoY,Fufihata T,Abe Yoshida R,Shinozaki K,Yamaguchi-Shinozaki K.Arabidopsis basic leucine zipper transcription factors involved in an abscisic acid-dependent signal transduction pathway under drought and high - salinity conditions.[J].PNAS,2000,97(21):11632 -11637.
[34] Yamaguchi-ShinozakiK,Shinozaki K.A novel cis-acting element in an Arabidopsis gene is involved in responsiveness to drought,low temperature,or high - salt stress[J].The Plant Cell,1994,6(2):251 -264.
[35] Aqarwal M,Hao Y ,Kapoor A,Dong C H,Fujii H,Zheng X W,Zhu J K.A R2R3 type MYB transcription factor is involved in the cold regulation of CBF genes and in acquired freezing tolerance.[J].Journal of Biological Chemistry,2006,281(49):37636 -37645.

