运动对高脂饮食性肥胖大鼠棕色脂肪组织线粒体形态和动力学的影响及可能机制的研究
欧秀伶,于宝明,孙 剑
近年来,随着经济的发展,人们的生活水平不断的提高,饮食结构生活习惯发生了很大的改变,肥胖症呈现增多的趋势,肥胖及其发病机制的研究也受到广泛关注[1-2]。棕色脂肪与能量平衡有关,棕色脂肪具有产热功能,对维持能量平衡具有重要作用。研究发现,肥胖大鼠棕色脂肪组织明显减少,且棕色脂肪组织细胞存在线粒体损伤、能量代谢异常[3]。研究表明,有氧运动能够有效地控制脂肪的合成,增加脂肪的供能,促进脂肪的消耗[4]。本研究通过观察有氧运动干预前后肥胖大鼠棕色脂肪组织线粒体形态变化,探讨导致肥胖大鼠棕色脂肪组织线粒体形态以及动力学变化的可能机制。
1 材料与方法
1.1 实验动物与分组 将34 只3周龄SD 健康雄性大鼠随机分为2 组:正常组8 只,断乳后给予普通饲料喂养,在第8周时选取体重超出正常对照组平均体重为20%的大鼠16 只,再随机分为肥胖对照组、运动干预组,其中肥胖对照组继续给予高脂饲料喂养,运动干预组给以普通饲料喂养的同时,每天采用无负重游泳运动1 h,每周5 天。所有大鼠均在实验第16周时处死。
普通饲料构成为常规配方。高脂肪饲料配方如下:每100 克普通饲料中加入全脂奶粉15 g,猪油5 g,黄肚豆15 g,鸡蛋黄50 g,鱼肝油10 滴,牛胆酸纳0.5 g[3]。大鼠自由饮食摄食,自然昼夜采光。
1.2 样本的采集 隔夜禁食后将大鼠称重(BW),麻醉,断头处死,迅速取肩胛间区棕色脂肪组织(BAT),睾周白色脂肪组织(WAT),称重后,用锐利眼科剪将棕色脂肪组织标本剪成2 mm ×2 mm ×2 mm 左右的脂肪组织方块,依次用40℃的2.5%的戊二醛专用电镜固定液固定,0.1 mol/LPBS 缓冲液洗涤2 次,1%锇酸后固定30~60 min,常规电镜样品制备程序脱水、渗透、包埋、超薄切片、铀铅染色,电镜观察线粒体形态及超微结构;留取部分脂肪组织于-80℃冰箱保存,进行NYGGF4 mRNA 和M fn1、M fn2 及Drp1 蛋白表达的测定。
1.3 NYGGF4mRNA 的表达 采用Trizol 一步法提取细胞总RNA,经凝胶电泳显示28 S、18S 清晰条带2条,测定OD260/OD280比值>1.8。经反转录反应后采用荧光定量RT-PCR 法检测棕色脂肪细胞中NYGGF4mRNA 表达水平。从NCBI 的nucleotide 中查得目的基因和内参照基因,联系上海博亚生物技术有限公司设计上下游引物。引物序列如下:NGGF4 上游序列:5’CCTGTCAGACCCCACTTTC 3’,NGGF4 下游序列:5’CAGCCCACTGTTTTCCAAAT3;β- actin 上游序列:5’TCACCCACACTGTGGCCATGT AGGA 3’,β-actin 下游序列:5’CAGGGGAACCGGTCATTGCCAATGG3’。退火温度均为55.4 摄氏度。采用CT 法计算NYGGF4mRNA 相对表达量。目的基因mRNA 相对表达量=2CT(参考基因)- CT(目的基因)。
1.4 Western blot 检测蛋白表达 应用Western blot技术测M fn1、M fn2 及Drp1 蛋白的表达。各取100 mg 棕色脂肪组织剪碎并于玻璃匀浆器充分匀浆,加3~5 倍体积的组织裂解液于冰盒中吹打30 min,4℃下12 000rpm 离心10 min,取上清液。BCA 蛋白定量试剂盒检测蛋白浓度。取30 微克总蛋白加上样缓冲液煮沸5 min 后行聚丙烯酰胺凝胶电泳,然后转移至硝酸纤维素膜。将转移后的硝酸纤维素膜放入50 g/L脱脂奶粉中,室温下封闭1 h,将稀释好的一抗加入大小合适的塑料袋中,加入膜、去除气泡40℃封好袋口,室温反应4 h 后40℃过夜,HRP 标记的二抗室温作用1 h,化学发光后显影、定影。扫描显影条带,记录其灰度值。以β- actin 为内源性参照,计算Mfn1 蛋白、Mfn2 蛋白、Drp1 蛋白相对表达量,并进行统计分析。取对照组均数为1,将数据进行标准化。
1.5 统计学方法采用SPSS 10.0 软件分析,全部数据均以均数±标准差()表示,各组间均数比较采用单因素方差分析(one-way ANOVA),选择Homogeneity-of-variance 显示方差齐性,选择Turkey 比较各组间差异,P <0.05 表示组间差异具有显著性。
2 结果
2.1 体重、棕色脂肪组织(BAT)、白色脂肪组织(WAT)的比较 与正常对照组比较,肥胖组大鼠体重显著高于对照组,BAT 显著低于对照组,WAT 与对照组相比差异无统计学意义;与肥胖组相比,有氧运动干预组大鼠体重、WAT 显著下降,BAT 与肥胖组相比无统计学意义(表1)。

表1 大鼠体重、褐色脂肪组织、白色脂肪组织的比较
2.2 棕色脂肪组织线粒体形态变化 透射电镜发现,肥胖组大鼠线粒体体积变小、数量明显减少,线粒体嵴断裂、减少、消失,部分线粒体肿胀,甚至呈空泡状(1A);有氧运动干预后,肥胖组大鼠(1B)线粒体形态接近于正常对照组(1C),表现为线粒体形态基本正常,无明显肿胀、皱缩,膜结构完整,清晰可见(图1)。

图1 棕色脂肪组织线粒体形态变化
2.3 脂肪细胞NYGGF4 基因的表达 与正常对照组相比,肥胖组大鼠NYGF4mRNA 表达显著增高,灰度值明显高于正常对照组,差异具有非常显著性;与肥胖组相比,有氧运动干预组大鼠NGGF4mRNA 表达显著降低,灰度值明显低于肥胖组,差异具有非常显著性;与正常对照组相比,差异无统计学意义(图2、表2)。

图2 NYGF4mRNA 在大鼠脂肪组织中的表达

表2 大鼠NYGGF4mRNA、Mfn1 蛋白、Mfn2蛋白、Drp1 蛋白表达的比较
2.4 脂肪细胞中Mfn1、Mfn2、Drp1 蛋白的表达 与正常对照组相比,肥胖组大鼠脂肪细胞中Mfn1 蛋白表达水平明显上调(P <0.05),Mfn2 和Drp1 蛋白表达水平无显著变化;有氧运动干预组大鼠脂肪细胞中Mfn1 蛋白表达水平较肥胖组大鼠显著降低,差异具有非常显著性;与正常对照组相比,差异无统计学意义(图3、表3)。
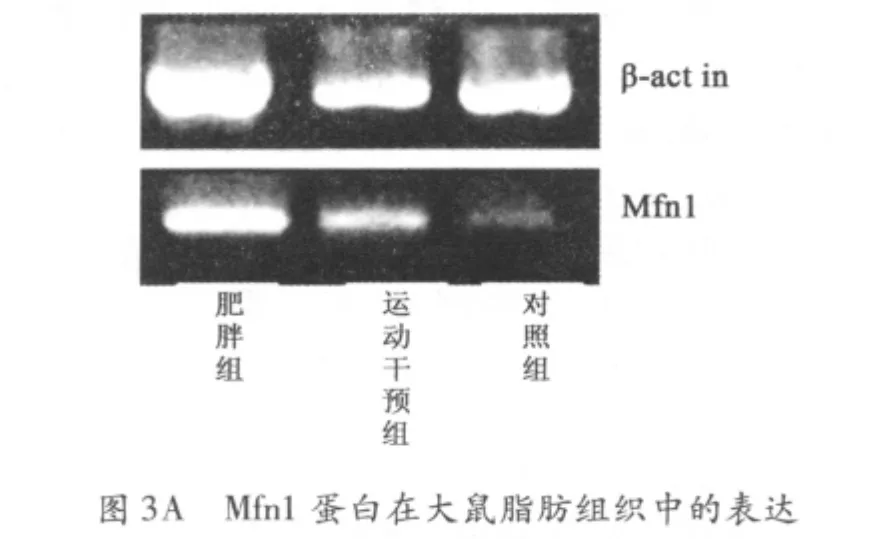
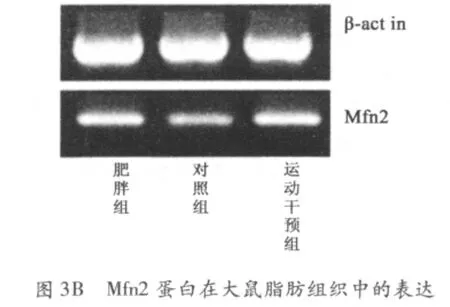
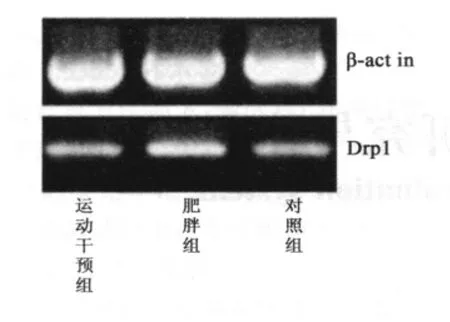
图3 C Drp1 蛋白在大鼠脂肪组织中的表达
3 讨论
人体内存在棕色和白色两种脂肪,白色脂肪堆积在皮下,负责储存多余热量;棕色脂肪负责分解引发肥胖的白色脂肪,将后者转化成二氧化碳、水和热量,它可以加快人体新陈代谢,促进白色脂肪消耗[5]。
NYGGF4 基因是最近发现的在肥胖儿童脂肪组织中高表达的基因,其在脂肪细胞中过表达,显著降低了胰岛素刺激的葡萄糖摄取,表明NYGGF4 基因可以降低脂肪细胞对胰岛素的敏感性,导致脂肪细胞产生胰岛素抵抗(IR)[6]。目前,关于IR 的发生机制存在许多学说,线粒体功能障碍学说是近年来提出的新理论[7],主要是指线粒体损伤和线粒体密度下降引发脂肪酸代谢障碍或功能低下,导致线粒体氧化磷酸化功能受损、线粒体膜电位降低,不仅产能物质(ATP)减少,而且活性氧(ROS)产生增多,从而影响胰岛素受体后信号转导通路,最终导致胰岛素抵抗。已知线粒体形态与其功能、代谢活动密切相关[8]。大量研究表明,有氧运动能调节代谢功能,增加热能消耗,促进脂肪分解[9]。
本研究对肥胖大鼠棕色脂肪组织中线粒体的形态和数量进行观察,结果发现,肥胖大鼠脂肪细胞的线粒体体积变小,数量明显减少,线粒体嵴断裂、减少、消失,部分线粒体肿胀,甚至呈空泡状等形态学异常,提示肥胖大鼠线粒体形态结构和功能存在损伤;有氧运动干预后,肥胖组大鼠肥线粒体形态接近于正常对照组,表现为线粒体形态基本正常,无明显肿胀、皱缩,膜结构完整,清晰可见;并且白色脂肪组织显著减少,与正常对照组相比差异无统计学意义。
线粒体是高度动态结构的细胞器,其形态不断发着融合与分裂变化。线粒体形态可以呈椭圆形、长管状、网络状,并且数量在各种形态间保持动态平衡[10-11]。该现象与现已发现的一些线粒体形态及动态相关基因密切相关,如Mfn1、Mfn2、Drp1 基因。本研究通过荧光定量PCR 法,检测有氧运动干预前后肥胖大鼠脂肪细胞中NYGGF4 基因、Mfn1 蛋白、Mfn2蛋白、Drp1 蛋白的表达水平,其中NYGGF4 基因以及Mfn1 蛋白在肥胖大鼠脂肪组织中显著上调;Mfn2 蛋白、Drp1 蛋白表达水平与对照组相比差异无统计学意义;有氧运动干预后,NYGGF4 基因以及Mfn1 蛋白在肥胖大鼠脂肪组织中的表达水平显著下调;与正常对照组相比差异无统计学意义。
Mfn 蛋白在哺乳动物中存在2种分子,Mfn1 蛋白和Mfn2 蛋白。在线粒体融合过程中发挥着协同作用[12],其中Mfn1 蛋白主要在融合的前期促进线粒体间的彼此结合;Mfn2 主要在融合反应的后期起作用,如促进线粒体融合,利于线粒体内膜对接等。本结果显示,肥胖大鼠脂肪组织中NYGGF4mRNA 显著上调,Mfn1 蛋白的表达水平显著升高;有氧运动干预后,肥胖组大鼠脂肪组织中NYGGF4mRNA、Mfn1 蛋白的表达水平显著降低,说明了NYGGF4mRNA 可能通过上调Mfn1 蛋白的表达水平,从而部分影响线粒体形态及动力学。
[1]Daniels SR.Complications of obesity in children and adolescents[J].Int J Obes(Lond),2009,33(1):60-65.
[2]CaliA M G,Caprio S.Obesity in children and adolescents[J].JClin Endocrinol M,2008,93(1):32-36.
[3]Zhao YP,Zhang C M,Chen XH,et al.Overexpression of NYGGF4(PID1)induces mitochondrial impairment in 3T3- L1 adipocytes[J].Mol Cell Biochem,2010,340(1):41- 48.
[4]沈通彦,李军汉,黄雷.运动减肥的生物学机制[J].中国组织工程研究与临床康复,2007,11(17):3415-3418.
[5]严治涛,李南方.棕色脂肪的来源及形成研究进展[J].中国医学科学院学报,2009,31(6):778-781.
[6]Zhang CM,Chen XH,Wang B,et al.Overexpression of NYGGF4 inhabits glucose transport in 3T3- L1 adipocytes via attenuated phosphorylation of IRS- 1 and Ak t[J].Acta Pharm acol Sin,2009,30 (1):120-124.
[7]Kin JA,Wei Y,Sowers J R.Role of mitochondrial dysfuction in insulin resistance[J].Circ Res,2008,102 (4):401- 414.
[8]Sukhorukov VM,Bereiter- H ahn J.Anomalous diffusion induced by cristae geometry in the inner mitochondrial membrane[J].PLoS One,2009,4(2):46-54.
[9]毕业,李建设.有氧运动对单纯性肥胖儿童血中瘦素、神经肽、胰岛素和肿瘤坏死因子的影响研究[J].体育科学,2005,25(12):37-39.
[10]Legros F,Lombes A,Frachon P,et al.Mitochondrial fusion in human cells is efficient,requires the inner-membrane potetia,land is mediated by mitofusins[J].M olB iol Cel l,2002,13(12):4343-4354.
[11]Chen H,Detmer SA,Ewald A J,et al.Mitofusins Mfn1 and Mfn2 coordinately regulate mitochondrial fusion and are essential for embryonic development[J].J Cell Biol,2003,160(2):189-200.
[12]Detmer SA,Chen DC.Complementation between mouse Mfn1 and Mfn2 protects mitochondrial fusion defects caused by CMTZA disease mutations[J].J Cell Biol,2007,176(4):405- 414.

