外源激素对二龄圆斑星鲽卵巢发育诱导效果的初步研究
徐永江, 柳学周*, 王妍妍
(1. 中国水产科学研究院 黄海水产研究所 农业部海洋渔业可持续发展重点实验室, 山东 青岛, 266071;2. 中国水产科学研究院 黄海水产研究所 青岛市海水鱼类种子工程与生物技术重点实验室,山东 青岛, 266071)
圆斑星鲽(VeraspervariegatusT.&S.)属鲽形目(Pleuronectiformes),鲽科(Pleuronectidae),星鲽属(Verasper),主要分布于我国黄海、渤海、东海以及日本,朝鲜等海域,其肉质鲜嫩,营养价值和商业价值高,是一种极具人工养殖和资源增殖开发利用前景的优良鱼种。自上世纪90年代以来,研究者们一直在试图通过控制其繁殖周期来实现该鱼种的人工繁殖,并在资源调查[1-2]、亲鱼培育和激素诱导产卵[3]方面进行了积极尝试和研究,积累了较多有关繁殖生物学的基础资料。
资源调查资料表明,自然条件下圆斑星鲽雌性亲鱼性成熟的最低年龄为3龄[4]。目前,圆斑星鲽在人工养殖条件下,人工雌性亲鱼甚至4龄以上才能真正用于人工繁殖,且经人工调控后产卵的成功率也相对较低,人工采卵获得优质卵子的几率不高。近年来研究产卵使用的亲鱼都是自然海域捕获的野生亲鱼在人工条件下驯养后用于繁殖,子一代亲鱼的人工繁殖少有成功。由于自然资源的严重下降,自然海域的圆斑星鲽种群逐年缩小,因此从人工养殖群体选择具备优良性状的个体来补充亲鱼群体是保证养殖产业可持续发展的重要途径,对于可用于繁殖群体补充的后备亲鱼个体,其生殖特性和生殖潜力是评价其可否作为后备亲鱼的必要条件[5]。
外源激素可诱导人工养殖鱼类性腺发育成熟并排卵[6],还可加速鱼类性腺成熟[7]、克服人工养殖条件下的亲鱼发育不良不能正常排卵的情况[8-10]。因此,我们利用外源激素诱导2龄雌性圆斑星鲽后备,以卵巢发育特征和性类固醇激素表达水平变化为指标,以期认识圆斑星鲽2龄后备亲鱼的生殖内分泌特性,评价其在人工养殖条件下的生殖潜力,为人工亲鱼的优选和群体构建提供理论和技术支持。
1 材料与方法
1.1 实验条件及实验设计
于2010年在青岛忠海水产有限公司开展了3龄以上圆斑星鲽亲鱼(全长39~62 cm,体重1 200~2 800 g)的促熟调控产卵研究,使用2个容积为25 m3的圆形水泥池作为亲鱼培育池,培育亲鱼数量75尾。亲鱼饵料为活沙蚕、贝肉。日投喂2次,投喂量为鱼体重的2%~3%,及时清除残饵、排污。对亲鱼进行温度和光照调控,培育池以黑色不透光幕布围遮,水温由自然海水和地下井水混合调控。光照由白炽灯(60 W)提供,调节水面光照强度为280 lx。产卵期结束后,亲鱼重新置于自然光照和水温下。亲鱼培育条件:周年培育水温8~23 ℃,盐度29~32,pH 7.8~8.2,溶解氧6 mg/L以上,日换水率300%~500%。亲鱼周年培育水温和光周期变化见图1。
本实验使用2龄的圆斑星鲽子一代人工后备亲鱼45尾,实验鱼全长300~380 mm,体重565~780 g。本研究使用的F1代2龄圆斑星鲽后备亲鱼与达性成熟的亲鱼共同培育,于2009-10开始进行温光调控。

图1 亲鱼周年培育水温和光照时间变化Fig.1 Year round photothermal conditioning schedule used to mature captive broodstocks
本实验于2010-03进行,当性成熟亲鱼性腺隆起较为明显且发育达IV期以上时,将30尾2龄实验用亲鱼从培育池取出,用于激素诱导发育试验,剩余的15尾实验鱼留在亲鱼池继续进行培育。实验鱼自亲鱼培育池取出后,在4 m3的方形水泥池中开展实验,实验设置3个组,共使用水泥池3个,每个实验组放置实验鱼10尾。实验鱼培育条件和饵料投喂及管理同亲鱼培育池。实验共持续3周。实验用激素购自宁波第二激素厂(宁波,中国),实验组别、使用激素种类、注射剂量及使用亲鱼数量见表1。实验鱼在实验池中适应3 d后开始实验,实验开始时(0 h)每尾鱼按照设计剂量注射生理盐水及激素,在48 h时进行二次注射,剂量同第1次。激素注射前,先以160 mg/L的MS-222麻醉实验鱼,使用1 mL的无菌注射器在实验鱼背部肌肉部位进行激素诱导注射。
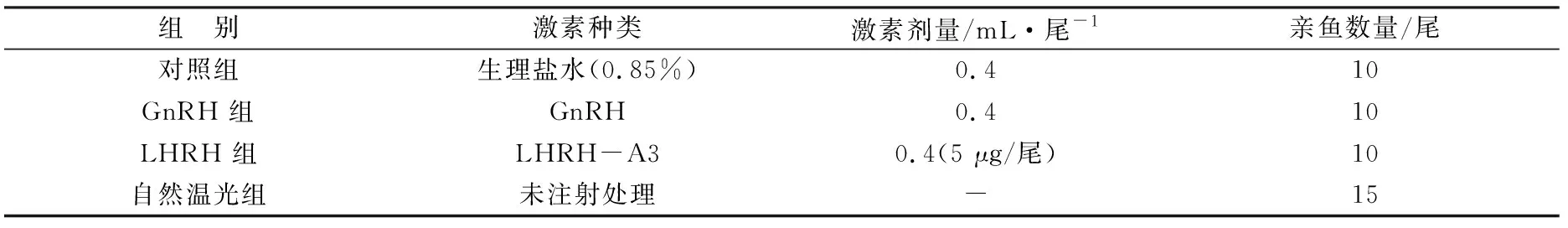
表1 实验使用激素种类、注射剂量及使用亲鱼数量Table 1 The hormones, dosage and number of fish used in the present study
注:“-”为进行任何激素和生理盐水处理
1.2 取样方法及样品处理
血液取样:对以生理盐水、GnRH和LHRH处理的实验鱼定时抽取血液。在第1次激素注射后的6 h、12 h、24 h、48 h、96 h、192 h和实验结束时分别抽取血液样品,每次取样实验鱼5尾。血液取样时,实验鱼以160 mg/L的MS-222麻醉后置于铺有干净湿润毛巾的泡沫板上进行。取血使用1 mL无菌注射器,采用背面尾静脉抽血方法,每尾鱼抽血1 mL,保存在1.5 mL eppendorf离心管中,15 000 r/min离心10 min后,分离上层血清,保存在-40 ℃备用。
组织样品取样:在实验开始前、192 h分别取样4个实验组的实验鱼各3尾,在实验结束时(480 h)将实验鱼全部取样。取样实验鱼时,首先将实验鱼使用MS-222(300 mg/L)麻醉致死,小心解剖取出性腺、肝脏在Davis固定液中固定24 h后转入70 %酒精保存。性腺样品经酒精梯度(70%~100%)脱水,石蜡包埋,切成7~9 μm厚的切片,苏木精伊红染色后,中性树胶封片,在显微镜下观察(NIKON),拍照。
在取样过程中,对实验鱼进行生物学测量,包括体重(BW)、体长(BL)、内脏重(VW)、性腺重(GW)、肝脏重(LW)。分别计算性腺指数(GSI)=[GW/(BW-VW)]×100%;肝脏指数(HSI)=[LW/(BW-VW)]×100%;肥满度(CF)=[BW/(BL)3]×100%。
1.3 性类固醇激素水平测定
采用放射免疫法(RIA)对雌二醇(E2)和睾酮(T)进行测定。使用125I标记的哺乳动物E2和T放射免疫测定试剂盒(天津九鼎医学生物工程有限公司)。T回收率95%~108%,灵敏度1.9 ng/dl,批内变异系数7.4%,批间变异系数9.8%,其特异性表达为与双羟睾酮交叉反应率≤1.6×10-4,雄烯二酮≤2.1×10-6,孕酮(PROG)≤5.0×10-6,雌三醇(E3)≤5.2×10-8,E2≤5.0×10-4。E2回收率95%~104%,灵敏度2.1 pg/mL,批内变异系数7.7%,批间变异系数8.9%,其特异性表达为与E3交叉反应率≤9.0×10-4,PROG≤1.0×10-4,T≤1.0×10-4,雌酮≤7.0×10-3,胆固醇≤1.0×10-5。试剂盒非特异性结合率≤3%,特异性结合率≥30%。
1.4 数据处理和统计分析
试验结果均表示为平均值±S.D.的形式,使用SPSS(16.0版本)软件进行差异显著性分析。利用单因素方差分析法(ANOVA)检测GSI、HSI、CF、血浆雌二醇、睾酮的表达水平变化以及肝脏细胞直径的变化,取差异显著性(P)为0.05,P≤0.05视为差异显著,反之不显著。
2 结 果
本研究表明,留在亲鱼培育池继续培育的实验鱼未能排卵,组织切片检查发现性腺仅发育至Ⅳ期后,而采用注射法进行外源激素诱导子一代2龄后备雌性亲鱼性腺中卵母细胞可发育至5时相早期,虽然最终也未能达到成熟排卵,但表明外源激素诱导对性腺发育起到了积极的促进作用。
2.1 卵巢数量特征变化
实验结束时,GnRH处理组圆斑星鲽雌鱼有40%可见卵巢部位的隆起,而Control组、LHRH组以及自然温光组未见亲鱼卵巢部位的隆起。实验结束时,GnRH组实验鱼的GSI值最大,达到11.51±2.64,而LHRH处理组实验鱼相对较小为8.36±1.82,最小的为对照组仅为3.76±1.15,自然温光组为4.23±1.55。GnRH处理组和LHRH处理组实验鱼的肝重指数(0.84~0.96)和肥满度(0.61~0.82)都大于对照组和自然温光组(0.65~0.79),但差异不显著(P>0.05)。
2.2 血浆性类固醇激素的表达水平变化
对照组亲鱼血浆性类固醇激素表达水平变化不显著,雌二醇表达水平在48 h达峰值,其后保持一定的表达水平的波动。LHRH组雌鱼血浆雌二醇水平在激素注射6 h后显著升高(P<0.05),随后又显著下降,虽在24 h又有升高,但在其后的时间表现相对稳定的变动,在48 h进行LHRH组二次注射后,激素水平仅在72 h稍微上升,在其后的实验过程中保持相对稳定的水平。GnRH组雌鱼血浆雌二醇水平表现出与LHRH组类似的表达变化规律,但144 h前雌二醇表达水平都高于LHRH组(除72 h),其后其表达水平低于LHRH组雌鱼。上述组雌二醇的表达水平在72 h后都低于对照组雌鱼血浆的雌二醇表达水平(图2)。
对照组亲鱼血浆睾酮表达水平在144 h达峰值,其后逐渐下降。各实验组雌鱼血浆睾酮表达水平也发生较为明显的波动。在LHRH组,第一次激素注射后,血浆睾酮表达水平显著下降至12 h时低于检测限,其后在48 h达峰值(P<0.05),在第二次注射后睾酮表达水平逐渐下降并保持相对较低。GnRH组呈现类似的表达规律,但在48 h后的血浆睾酮表达水平相对高于LHRH组。另外,除48 h、72 h和96 h外,对照组雌鱼血浆中睾酮表达水平都高于实验组(图3)。
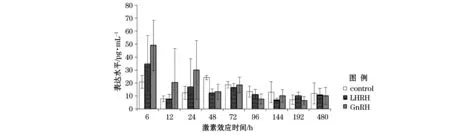
图2 激素诱导后血浆中雌二醇表达水平变化Fig. 2 Serum estradiol expression level after hormones treatment
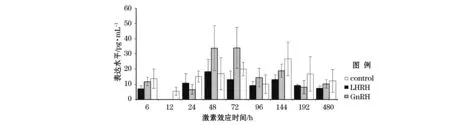
图3 激素诱导后血浆中睾酮表达水平变化Fig.3 Serum testosterone expression level after hormones treatment
2.3 卵巢中卵母细胞组成变化
圆斑星鲽卵巢发育和卵母细胞发育的特征及其划分参见徐永江等[11]的描述,本研究观察到的卵母细胞发育特征见图4。
对取样的实验鱼卵巢进行组织切片观察,发现对照组亲鱼卵巢中卵母细胞组成为4时相早期、3时相、2时相卵母细胞,以2时相卵母细胞占据优势,表明2龄雌性亲鱼卵巢发育可进入卵黄发生期,但在较长时间内保持不变,卵母细胞不能继续发育成熟。自然温光组亲鱼卵巢发育情况与对照组亲鱼基本相似。
使用外源激素诱导192 h后,LHRH处理组雌鱼卵巢内卵母细胞组成为4时相、3时相和2时相卵母细胞,只不过3时相和2时相卵母细胞比例相对减少,4时相卵母细胞比例增加,且4时相卵母细胞可发育到中后期。至实验结束时(480 h),性腺中可见少量发育至5时相的卵母细胞,其特点为核仁和核膜崩解, 4时相卵母细胞多数为发育至中后期的卵母细胞。
GnRH处理组雌鱼在192 h取样时,卵巢中可见3种类型的卵母细胞,分别为4时相、3时相、2时相,与LHRH处理组不同的是3时相卵母细胞较多。至实验结束时(480 h),卵巢中发育至4时相的卵母细胞数量急剧增加,并可见个别5时相卵母细胞。性腺中5时相卵母细胞比例增加明显达20%,但仅处于5时相发育早期,不能发生水合作用而成熟。
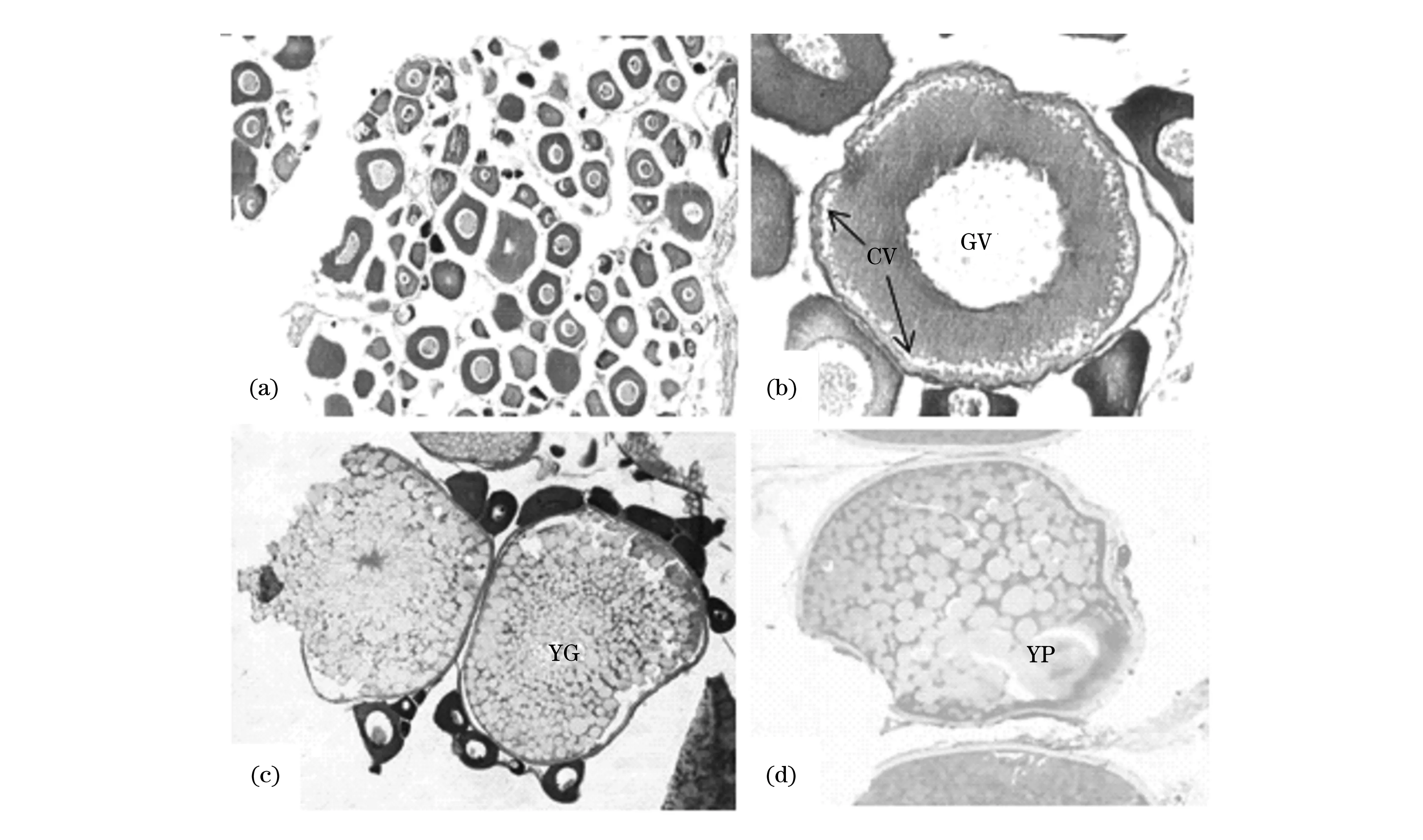
a.2时相卵母细胞;b. 3时相卵母细胞;c.4时相卵母细胞;d. 5时相早期卵母细胞
2.4 肝细胞直径变化
本研究发现,对照组和自然温光组实验鱼肝细胞直径在实验过程中未有较大变化,约为11.6~12.2 μm。LHRH处理组雌鱼的肝细胞在激素诱导48 h后直径增大为15.8~16.5 μm(P<0.05),但在192 h又有所降低,至480 h最低为13.2 μm,仍然高于对照组,但同对照组无显著差异(P>0.05)。GnRH处理组雌鱼肝细胞直径在192 h才开始增大,直径达16.4 μm,高于LHRH组的最大直径,其后在480 h略有降低,但仍保持在15 μm以上,远高于对照组实验鱼(P<0.05)。结果表明,外源GnRH诱导对肝脏细胞大小的影响较为明显。LHRH处理组和GnRH处理组实验鱼CF的增加与肝细胞直径增大相对应(图5)。
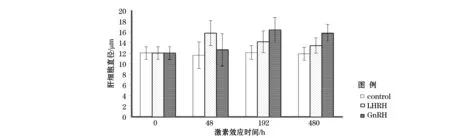
图5 激素诱导后肝脏细胞直径的变化Fig.5 The cChanges in of hepatocytes diameter after exogenous hormones treatment
3 讨 论
本研究首次利用外源激素诱导方法,探讨了外源激素GnRH和LHRH对子一代人工二龄圆斑星鲽雌性后备亲鱼卵巢发育的诱导效果。结果表明在外源激素诱导下,2龄雌性亲鱼卵母细胞可以发育至5时相,但不能达到水合成熟,部分实验鱼可见卵巢的体表隆起,但是未能获得排卵,在实际生产过程中应使用3龄以上的性成熟亲鱼。
3.1 外源激素诱导与内源性激素表达水平变化的关系
本研究观察到,在外源激素诱导后,圆斑星鲽血浆性类固醇激素表达水平先是显著升高而后显著下降,表明外源激素影响了内源性类固醇激素的合成和分泌[10]。利用外源缓释激素GnRH对塞内加尔鳎(Soleasenegalensis)2 龄雌性亲鱼进行成熟诱导,结果表明激素诱导后 1 d内,亲鱼血浆性类固醇激素表达水平在短时间内(6 h)迅速升高至峰值并在随后下降至与对照组类似水平,睾酮出现峰值的时间晚于雌二醇[13],这与本研究结果类似。在其它海水硬骨鱼类如大西洋鲽(Pleuronectesferrugineus)[14]、金眼狼鲈(Moronechrysops)[6]和条纹婢鱼 (Latrislineata)[15]、扁海鲽(Pleuronectesplatessa)中也存在相同趋势的血浆性类固醇激素表达变化[16]。人为操作的压力可能也会对实验鱼的血浆性类固醇激素表达水平起到抑制作用[17],在绿背菱鲆(Phombosoleatapirina)中,实验过程的注射采样操作和日常培育操作会对亲鱼血浆性类固醇激素表达水平带来抑制效应[18]。
3.2 外源激素诱导方式与性腺发育的关系
本研究采用两次重复注射外源激素的方式诱导圆斑星鲽雌性亲鱼性腺发育成熟,虽然可促进卵母细胞发育至Ⅴ期早期,但是不能达到水合成熟而排放,也未能观察到亲鱼的排卵。以往研究证明,对海水硬骨鱼类进行外源激素诱导成熟产卵,单次的注射诱导与多次注射诱导及缓释埋植激素诱导的效果存在较大差异,以单次注射诱导的效果最差,多次注射诱导相对较好,但是多次重复操作可能会对亲鱼造成生殖胁迫[8]。另外,注射法将激素注入鱼体后,激素在鱼体代谢系统内的消除时间(持续有效时间)相对较短,如在塞内加尔鳎中,采用注射GnRH的方法诱导亲鱼成熟,血浆中GnRH在3 d后已消除,无法检测到[13],在美洲鲽(Pleuronectesamericanus)中为 3 d[19],而在细点牙鲷(Dentexdentex)中仅为24 h[20]。本研究的亲鱼最终成熟和排卵的失败也可能与采用的注射方法有关,外源激素进入鱼体后被鱼体自身内分泌系统和代谢系统快速消解。与注射法相比较,目前最为常用的是激素的缓释系统,植入鱼体内后可较长时间持续释放GnRH,如采用缓释系统诱导大西洋拟庸鲽(Hippoglossushippoglossus)性腺成熟产卵,血浆中GnRH可在1个月内保持较高水平[21],而细点牙鲷(Dentexdentex)接受外源激素埋植处理后血浆性激素水平可在24 d内保持较高水平[20],而且对亲鱼生殖胁迫小,亲鱼的产卵效果较注射法或个别自然产卵为好。另外,对于尚未达到生理性成熟的人工亲鱼,采用缓释系统埋植外源激素可诱导性腺成熟排卵,如利用以共聚物作为缓释载体的GnRH可诱导未性成熟的真鲷(Pagrusmajor)达到性成熟并排卵[22],对美洲鲽未性成熟亲鱼采用外源激素诱导,可促进性腺发育成熟的进程,同时血浆性类固醇激素激素出现于本研究类似的表达水平变化,这对于了解其在人工养殖条件下的繁殖生物学特性和周年产卵调控具有重要的应用价值[23]。尽管多数研究表明,外源激素进入鱼体后的消解期长短因为埋置方法和剂量、鱼种代谢水平、水温的不同而差异较大[24],但是实践结果已证明采用缓释系统对于解决人工养殖鱼类的生殖功能障碍和成功诱导产卵较注射法更为可行。在即将开展的下一步研究中,笔者将采用缓释系统继续开展外源激素对亲鱼的诱导成熟产卵研究,另外结合温光调控促熟措施,以比较这几种方法的效果及缓释系统能够并成功获得卵母细胞的水合成熟及产卵。
由于不同的激素在促进硬骨鱼类性腺发育成熟方面的效能差别较大且具有种的特异性,因此研究者针对不同的鱼种选择使用不同种类的激素[25]。目前,在已经研究过的鱼种和激素种类中,GnRH被认为是最有效的外源激素,另外LHRH和HCG因为获取相对容易且价格相对低廉也在水产养殖领域较为广泛的使用。本研究表明,对于圆斑星鲽,GnRH和LHRH的诱导成熟的效果类似,未有太大区别,这可能与圆斑星鲽本身的生殖内分泌特性有关。
3.3 外源激素诱导与卵巢及肝脏组织学特征变化的关系
本研究未能获得雌性亲鱼卵巢中卵母细胞的完全水合成熟和排卵,但是经激素诱导后,卵巢中卵母细胞组成发生明显变化,两种外源激素处理的亲鱼卵母细胞都可以达到5时相早期,表明外源激素可能通过脑-下丘脑-性腺(BPG)轴促进了卵巢发育,同时GSI值的增加也验证了雌鱼卵巢的发育。
研究表明,肝脏是鱼类脂肪和能量的重要储备基地并与产卵进程密切相关[12],但目前尚未有明确报道证实肝脏体积的变化与雌鱼卵巢发育的关系。本研究观察到激素诱导后,圆斑星鲽2龄雌鱼HSI增加,肝细胞直径增大,这些特征与其它一些硬骨鱼类在繁殖过程表达出的特征变化相似。这些变化都间接表明,外源激素诱导下肝脏可能通过卵黄蛋白原的合成和传递作用参与了卵母细胞成熟的调节。
参考文献(References):
[1] WADA T, MITSUNAGA N, SUZUKI H, et al. Growth and habitat of spotted halibutVeraspervariegatusin the shallow coastal nursery area, Shimabara Peninsula in Ariake Bay, Japan [J]. Fisheries Science, 2006, 72: 603-611.
[2] DOU S Z. Food utilization of adult flatfishes co-occurring in the Bohai Sea of China [J]. Netherlands Journal of Sea Research, 1995, 34 (1-3): 183-193.
[3] BAEK H J, KIM Y, AN C M, et al. Effects of hormonal treatment on induced maturation and ovulation in the spotted halibut,Veraspervariegatus[J]. Journal of Aquaculture, 2000, 13(1): 47-53.
[4] DEN J Y, MENG T X, REN S M, et al. Species composition, abundance and distribution of fishes in the Bohai Bay [J]. Marine Fisheries Research, 1988, 9: 10-98. 邓景耀, 孟田湘, 任胜民, 等.渤海鱼类种类组成及数量分布[J]. 海洋水产研究, 1988, 9: 10-98.
[5] DAHLE R, TARANGER G L, KARLSEN Ø, et al. Gonadal development and associated changes in liver size and sexual steroids during the reproductive cycle of captive male and female Atlantic cod (GadusmorhuaL.) [J]. Comp. Biochem. Physol.A. Mol. Integr. Physiol., 2003, 136(3): 641-653.
[6] MYLONAS C C, SCOTT A P, VERMEIRSSEN E L, et al. Changes in plasma gonadotropin II and sex-steroid hormones, and sperm production of striped bass after treatment with controlled-release gonadotropin-releasing hormone agonist delivery systems[J]. Biol. Reprod.,1997, 57:669-675.
[7] KOMATSU T, BHANDARI R K, KOBAYASHI Y, et al. GnRHa-accelerated spermatogenesis in the testes of underyearling golden rabbitfish,Siganusguttatus(Bloch) [J]. Aquaculture, 2006, 257: 558-565.
[8] ZOHAR Y, MYLONAS C C. Endocrine manipulations of spawning in cultured fish: from hormones to genes[J]. Aquaculture, 2001, 197: 99 136.
[9] ANDO M, NIHO H, TSUKAMASA Y, et al. Valuation of cultured spotted halibutVeraspervariegatusby comparing with cultured plaice Paralichthys olivaceus[J]. Nippon Suisan Gakkaishi, 1998, 64(6):1027-1033.
[10] MYLONAS C C, ZOHAR Y. Use of GnRHa-delivery systems for the control of reproduction in fish [J]. Reviews in Fish Biology and Fisheries, 2000, 10(4): 463-491.
[11] XU Y J, LIU X Z, LIU J G, et al. Histological and morphometric studies on the annual gonadal maturation cycle of spotted halibutVeraspervariegatus[J]. Progress in Fishery Sciences, 2011, 32(3): 7-15. 徐永江, 柳学周, 刘君刚, 等.圆斑星鲽卵巢发育的组织学和数量形态特征研究[J]. 渔业科学进展, 2011, 32(3): 7-15.
[12] KJESBU O S. A simple method for determining the maturity stages of Northeast Arctic cod (Gadus morhua L.) by in vitro examination of oocytes [J]. Sarsia, 1991,75: 335-338.
[13] GUZMAN J M, RAMOS J, MYLONAS C C, et al. Spawning performance and plasma levels of GnRHa and sex steroids in cultured female Senegalese sole (Soleasenegalensis) treated with different GnRHa-delivery systems[J]. Aquaculture, 2009, 291 (3-4): 200-209.
[14] LARSSON D G J, MYLONAS C C, ZOHAR Y, et al. Gonadotropin releasing hormone-analogue (GnRH-A) advances ovulation and improves the reproductive performance of a cold-water batch-spawning teleost, the yellowtail flounder (Pleuronectesferrugineus)[J]. Canadian Journal of Fisheries and Aquatic Sciences, 1997, 54: 1957-1964.
[15] MOREHEAD D T, PANKHURST N W, RITAR A J. Effect of treatment with LHRH analogue on oocyte maturation, plasma sex steroid levels and egg production in female striped trumpeterLatrislineata(Latrididae)[J]. Aquaculture, 1998, 169: 315-331.
[16] SCOTT A P, WITTHAMES P R, VERMEIRSSEN E L M, et al. Prolonged-release gonadotrophin-releasing hormone analogue implants enhance oocyte final maturation and ovulation, and increase plasma concentrations of sulfated C21steroids in North Sea plaice [J]. Journal of Fish Biology, 1999, 55: 316-328.
[17] PANKHURST N W, VAN D K G. Effects of stress on reproduction and growth of fish. Fish stress and health in aquaculture. Society for Experimental Biology Seminar Series 62[M]. Cambridge: Cambridge University Press, 1997: 73-93.
[18] BARNET C W, PANHURST N W. The effects of commom laboratory and husbandry practices on the stress response of greenback flounderRhombosoleatapirina(Günther, 1862) [J]. Aquaculture, 1998, 162: 313-329.
[19] HARMIN S A, CRIM L W. Influence of gonadotropin hormone-releasing hormone analog (GnRH-A) on plasma sex steroid profiles and milt production in male winter flounder,Pseudopleuronectesamericanus(Walbaum) [J]. Fish Physiol. Biochem., 1993, 10: 399-407.
[20] GREENWOOD L N, SCOTT A P, VERMEIRSSEN E L, et al. Plasma steroids in mature common dentex (Dentexdentex) stimulated with a gonadotropin-releasing hormone agonist [J]. Gen. Comp. Endocrinol., 2001, 123:1-12.
[21] VERMEIRSSEN R L M, SHILEDS R J, MAZORRA Q C, et al. Gonadotropin-releasing hormone agonist raises plasma concentrations of progestogens and enhances milt fluidity in male Atlantic halibut (Hippoglossushippoglossus) [J]. Fish, Physiol. Biochem., 2000, 22: 77-87.
[22] MATSUYAMA M, HAMADA M, ASHITANT T, et al. Development of LHRH-a copolymer pellet polymerized by ultraviolet and its application for maturation in red sea breamPagrusmajorduring the non-spawning season [J]. Bull. Jpn. Soc. Sci. Fish, 1993, 59(8):1361-1369.
[23] HARMIN S A, CRIM L W, WIEGAND M D. Manipulation of the seasonal reproductive cycle in winter flounder,Pleuronectesamericanus, using a gonadotropic hormone releasing hormone [J]. Marine Biology, 1995, 121: 611-619.
[24] KING H R, PANKHURST N W. Effect of maintenance at elevated temperatures on ovulation and luteinizing hormone releasing hormone analogue responsiveness of female Atlantic salmon (Salmosalar) in Tasmania [J]. Aquaculture, 2004, 223: 583-597.
[25] POORTENAAR C W, PANHURST N W. Effect of Luteinizing Hormone-Releasing Hormone Analogue and Human Chorionic Gonadotropin on Ovulation, Plasma and Ovarian Levels of Gonadal Steroids in Greenback FlounderRhombosoleatapirina[J]. Journal of the World Aquaculture Society, 2000, 31(2): 175-186.

