中国南海西部浮游植物对中尺度涡的响应
钟 超,肖武鹏,黄邦钦
(1.福建省海陆界面生态环境重点实验室,福建 厦门 361005;2. 厦门大学 环境与生态学院,福建 厦门 361005)
中国南海是东南亚最大的陆架边缘海,南北边界的陆架辽阔,深度较浅(<200 m);东西拥有狭窄而陡峭的陆架陆坡,中央海盆区最深可达4 700 m。南海是涡发生频繁的海域,1993—2000年,共86个具有完整生命史的中尺度涡被证实[1]。
南海属于低生产力海区,浮游植物的生长主要受营养盐限制。对南海的长期观测揭示,其真光层深度全年较深,为75~90 m[2],这个深度已经延伸到混合层底部和营养盐跃层的顶部,因此光照不是南海海盆区初级生产力的主要限制因子。由于南海的环流和涡旋,几条较大的河流如珠江和湄公河只能将陆源的高营养盐带进近岸海域,而无法影响到南海中部的大部分海盆区[2];同时南海海盆区海表温度在一年大部分时间持续较高,特别在8月,海盆区海表温度普遍高于29 ℃[3],导致上层海水始终保持着较深的层化,因此营养盐难以从深层得到补充。所以南海海盆大部分区域呈寡营养状态[4]。
这种寡营养的情况会在一些中尺度事件发生时改变。近十几年来,海洋学家们通过研究海洋中物理-生物过程的耦合作用的过程发现,中尺度涡对海洋能量估算起到了关键作用,同时又会引起了涡中心的生物响应,包括生物量、群落结构和碳输出的改变。Huang等在南海北部发现,2个来源地不同的暖涡,涡中心的浮游植物群落结构不同[5]。而在南海西部,特别是在夏季,涡旋活动也比较频繁,那么这些涡旋对浮游植物生物量的分布以及群落结构有什么影响?这个问题至今未有定论。
位于西太平洋暖池和青藏高原之间的南海,其环流主要受东亚季风系统控制,因此在西南风盛行的夏季,南海南部海盆的环流呈现反气旋方向。部分北向的越南沿岸流在约12°N的近岸分离,然后向东流动[6],并伴随上升流发生,同时此处也经常形成一对北部冷涡、南部暖涡的偶极子[1]。对于南海西部区域浮游植物群落结构组成,尚未有特征光合色素方法的研究结果。我们通过HPLC-CHEMTAX方法研究该区域浮游植物生物量及群落结构,揭示这对冷暖涡浮游植物的响应特点,为进一步研究南海浮游植物功能群和物理-生物过程的耦合作用积累数据。
1 材料与方法
1.1 样品采集
35个测站(10°~16°N, 110°~115°E)样品来自2011-09-08—17的“东方红2号”航次取样(站位见图1)。根据潮洲气象网对南海海区的划分[7],调查区域属于南海西部。温盐数据由Seabird SBE 19温盐深剖面仪测量。每站光合色素样品层位为表层(0~5 m),25,50,75,100和150 m共6层。取2~8 L海水样品,在低光环境及负压不超过200 mmHg的条件下过滤, GF/F滤膜(Whatman)直径为25 mm。样品保存于液氮中,运回实验室后立即保存到-80 ℃超低温冰箱,并在一个月内完成样品的测定。

图1 南海西部采样站位图Fig. 1 Sampling locations in western South China Sea
1.2 光合色素分析
将滤膜夹于滤纸中解冻并吸去多余水分,加入N,N-二甲基甲酰胺作为提取剂[8],取滤液与1 mol/L的乙酸铵充分混合于色谱瓶中,保存于-20 ℃冰箱中待HPLC分析。确保整个过程均在暗光及低温条件下进行,以减少光合色素的降解。高效液相色谱分离技术(HPLC)的分析系统为Agilent 1100 Series液相色谱工作站。借助二极管阵列检测器(DAD)检测洗脱峰,固定记录波长为440 nm和663 nm,分离柱采用Eclipse XDB C8。梯度洗脱程序以及色谱峰定性定量参照胡俊[9]和陈纪新等[10],各色素的标准样品从丹麦DHI公司(DK-2970 Hørsholm, Denmark)购得。
1.3 浮游植物不同类群对叶绿素a(Chl-a)贡献的计算
研究评估的浮游植物类群按特征色素分为9种浮游植物功能群:甲藻(Dinoflagllates)、硅藻(Diatoms)、定鞭金藻4型[11](Haptophytes Type 4)、定鞭金藻3型(Haptophytes Type 3)、绿藻(Chlorophytes)、隐藻(Cryptophytes)、原绿球藻(Prochlorococcus)、聚球藻(Synechococcus)和青绿藻(Prasinophytes)。各浮游植物类群Chl-a生物量通过CHEMTAX程序因子分析方法对13种特征光合色素数据计算得出,特征光合色素对应浮游植物类群的初始比率矩阵在Mackey 等[12]的基础上进行修改,具体比率矩阵参数参照文献[9]。
1.4 环境因子测定和数据分析
温盐数据由Seabird SBE 19温盐深剖面仪测量。混合层深度的计算方法是以5 m为参考层,从5 m开始以深第一个位密超过参考层0.125 σθ的深度为该站的混合层底部[13]。对样品进行的聚类分析,采用Primer 5软件进行标准化欧式距离(Normalized Euclidean distance)的相似性聚类。对不同中尺度涡影响下的光合色素浓度及群落结构组成进行的比较,在SPSS Version17.0软件环境下,采用独立样品T检验进行统计分析。
2 结 果
2.1 调查海域的水文特征
参考Colorado Center for Astrodynamics Research资料[14]分析调查期间(2011-09-08—17)海表高度异常数据[14],可知航次期间调查海域出现的冷涡和暖涡的位置与海表高度异常数据标识的位置基本一致,冷涡位于12°N以北,暖涡位于12°N以南。现场表层温盐数据(图2)显示在13°N,112°E海域附近温度最低,盐度较高;而12°N以南温度普遍较高,盐度较低,这个结果与海表高度异常(SSHA)数据比较匹配。75 m层位通常位于温跃层以下,又接近真光层底部,因此能够很好地代表南海表层水和次表层水的混合情况(图2)。从图2可以看到,以 13°N为界,北边水温普遍低于20.5 ℃,盐度高于34.3,且温度和盐度分别有从东南向西北缓慢降低和升高的趋势。13°N以南的温度和盐度分别从北向南剧烈升高和降低,75 m层的温度相差最大达10 ℃,盐度相差1.7。
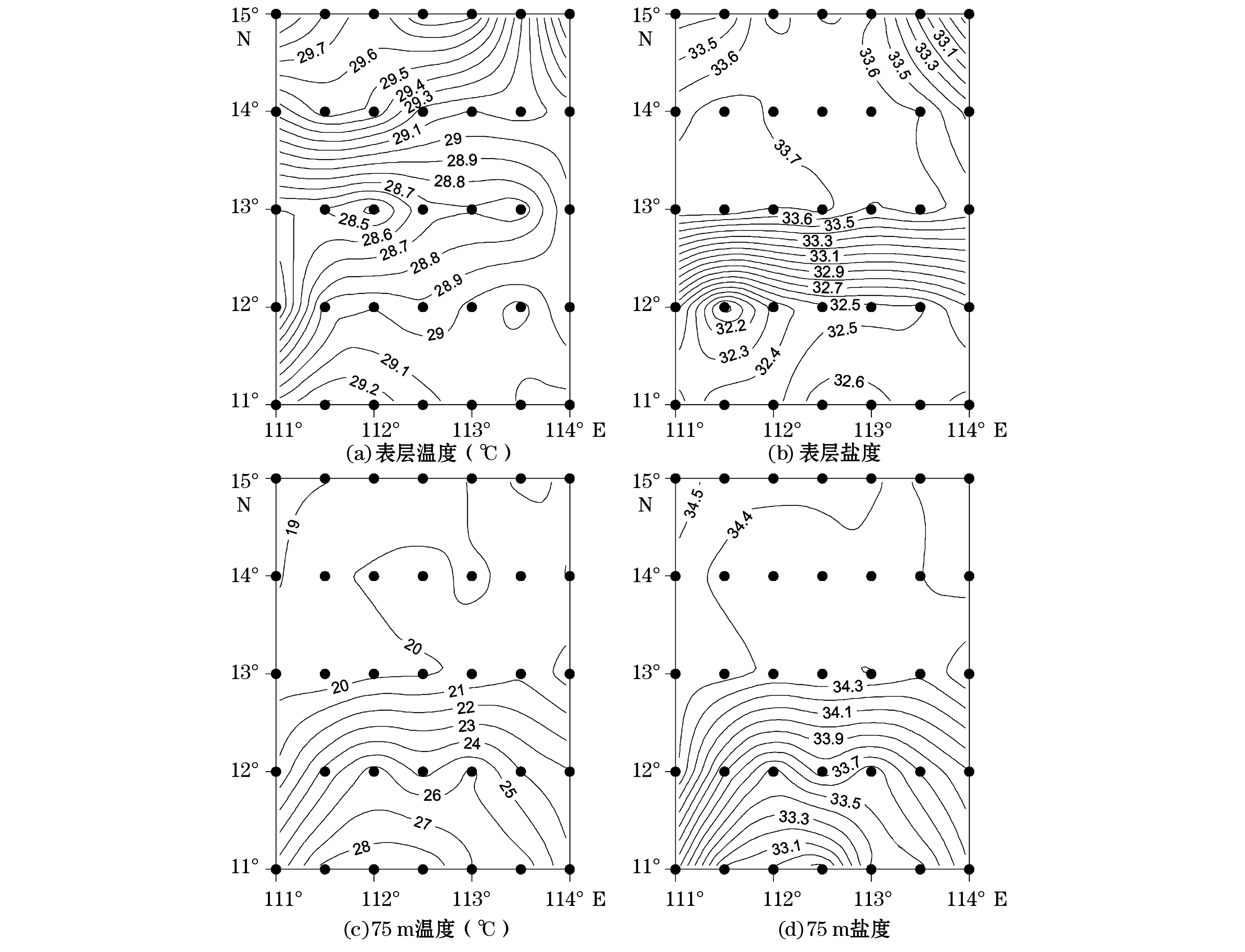
图2 南海西部表层及75 m温盐的水平分布Fig. 2 Horizontal distribution of temperature and salinity at surface and 75 m in western South China Sea
2.2 不同中尺度涡条件下浮游植物总Chl-a和群落结构的分布
使用Primer 5.0软件,把每个站的5,25,50,75,100和150 m的温度、盐度和密度数据作为变量输入,采用标准化欧氏距离进行相似性聚类分析,将35个测站归纳为3个区域,分别定义为暖涡区、冷涡区和对照区,不同区域的站位分布见图1。暖涡区的混合层深度为(32.92±14.45) m;对照区其次,为(26.50±7.25) m;冷涡区最浅,为(17.29±3.95) m。
暖涡区的总Chl-a质量浓度(水柱积分)为(15.16±2.17) mg/m2,显著高于对照区的(10.04±3.79) mg/m2;冷涡区的总Chl-a质量浓度(水柱积分)为(11.17±1.38) mg/m2,和对照区相比无显著差异。暖涡区的叶绿素最大层(DCM)一般位于75 m,总Chl-a质量浓度为(0.24±0.06) mg/m3,DCM层以浅的优势类群为聚球藻和原绿球藻,DCM层以聚球藻、原绿球藻和定鞭金藻4型为优势类群,DCM层以深以定鞭金藻4型占绝对优势。冷涡区的DCM层一般位于50 m,总Chl-a质量浓度为(0.21±0.05) mg/m3,表层以聚球藻占绝对优势,25 m以聚球藻、原绿球藻和定鞭金藻4型为优势类群,50~100 m以定鞭金藻4型占优势。对照区DCM层一般位于50 m,总Chl-a质量浓度为(0.16±0.07) mg/m3,表层和25 m以聚球藻占优势,50~100 m以定鞭金藻4型占优势。在100 m以浅的深度,所有区域的聚球藻贡献量随深度递减,而定鞭金藻4型贡献量随深度递增(图3)。
2.3 不同中尺度涡条件下浮游植物群落结构的特征
3个区域水柱积分(至150 m)的浮游植物群落结构(表1),都以定鞭金藻4型,原绿球藻和聚球藻为优势类群。其中,定鞭金藻4型贡献量(水柱积分,单位为%)在暖涡区最低,约为30 %,冷涡区和对照区的约为40 %。原绿球藻贡献量在暖涡区最高,约为24 %,在冷涡区和对照区的分别约为15 %和18 %。聚球藻贡献量在暖涡区最高,约为35 %;对照区其次,约为24 %右;冷涡区最低,约为17 %。硅藻在南海西部贡献量较低,冷涡区的硅藻贡献率显著高于暖涡区和背景区。
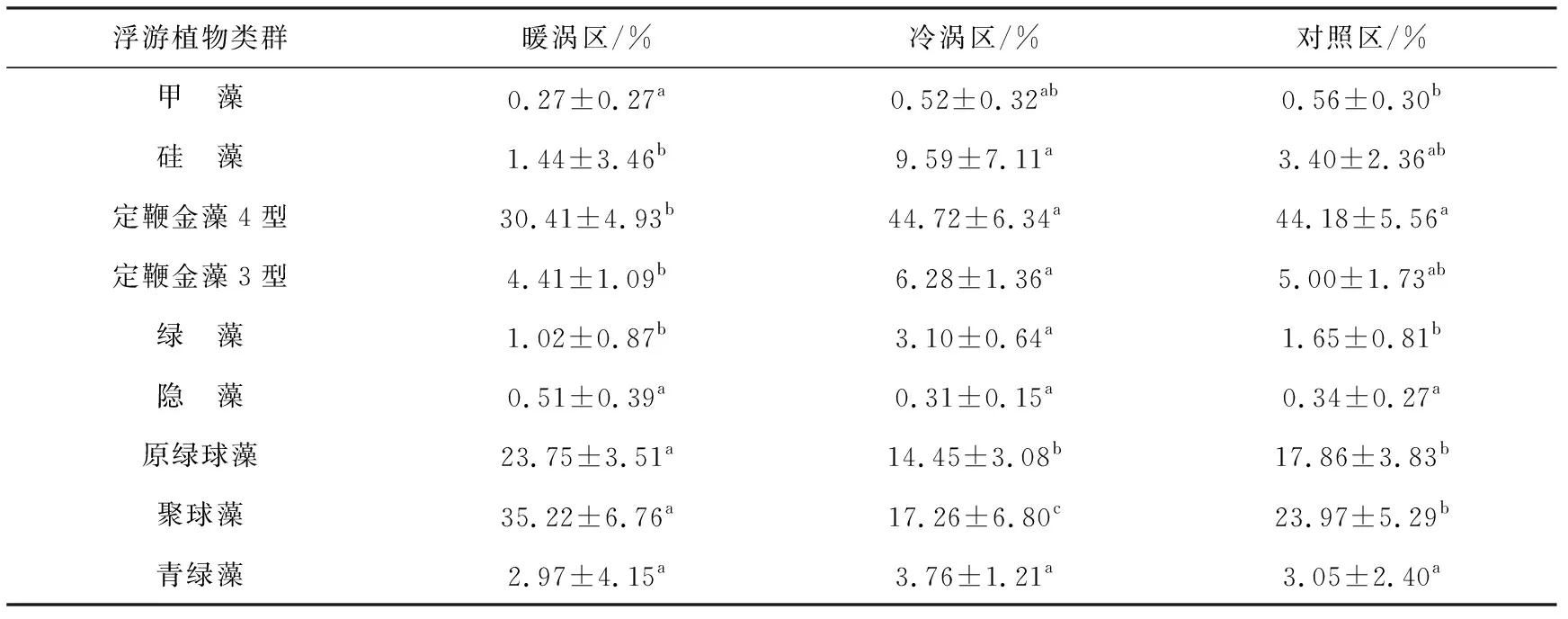
表1 南海西部3个区域的各浮游植物类群百分比Table 1 Percentages of phytoplankton groups in the three regions of western South China Sea
注:上标有相同字母代表差异不显著(p>0.05),不同字母代表差异显著(p<0.05)

图3 南海西部3个区域浮游植物群落结构和总Chl-a质量浓度(mg·m-3)的垂直分布Fig. 3 Vertical distribution of phytoplankton community structure and concentrations of total Chl-a (mg·m-3) in the three regions of western South China Sea
3 讨论
中尺度涡的形成、发展和衰退能够扰乱真光层内的等密度面,从而改变水体中的营养条件[15]。在暖涡中,等密度面的深化将寡营养盐的海水推到了真光层以下。在冷涡中,伴随着等密度面的抬升,深层的营养盐被带入到真光层内被生物利用和消耗。
由于表层海水辐聚造成暖涡区密度跃层下移,同时较大的混合层深度将0~50 m的寡营养海水充分混合,暖涡区DCM层较之对照区的50 m有所下移,出现在75 m左右。Thompson等[16]发现在东南部的印度洋形成的暖涡拥有深达275 m的混合层,且混合层内的荧光Chl-a质量浓度非常接近,该暖涡的混合层比附近的冷涡浅,而叶绿素最大层比冷涡深,这与本研究结果类似。暖涡一般被认为是一个低生产力的区域[15],但也有研究表明暖涡边缘的Chl-a质量浓度比中心高[17],本研究中通过温度、盐度和密度的物理参数对调查区域进行的聚类划分,且缺乏对暖涡跟踪调查的数据支持,无法确认暖涡中心和边缘的具体位置。
一般冷涡区低温高营养盐的深层水上升到了更浅的表层,压缩了混合层深度[15]。从结果来看,冷涡区的DCM层出现在50 m,与对照区没有差别。McGillicuddy等[15]在马尾藻海和Seki等[18]在夏威夷附近都观测到了冷涡对DCM层的抬升现象。在本研究中,由于受限于光合色素采样层位的限制,Chl-a质量浓度在深度剖面的分辨率不够高,很遗憾没有获得确切的冷涡中DCM层抬升的讯号。
对于该区域浮游植物群落结构组成,在此之前没有特征光合色素方法的研究结果。我们的研究结果表明南海西部浮游植物群落结构以定鞭金藻优势最大,同时聚球藻和原绿球藻也贡献了大部分Chl-a。它们由于细胞个体较小,对营养盐吸收效率高、营养盐代谢快,占据了群落的优势地位[10],即使受到冷涡和暖涡的影响,这3个类群的优势也没有被撼动。在对照区的0 m和25 m,群落结构以聚球藻占绝对优势,而到了DCM层的50 m,聚球藻的优势被定鞭金藻取代。随着DCM层的下移,暖涡区50 m层的最主要类群也从定鞭金藻变成了聚球藻。相反,冷涡区营养盐跃层随着密跃层的抬升,25 m层聚球藻的优势也有所下降,而定鞭金藻的贡献量增加。定鞭金藻和聚球藻优势地位的交替取代表明它们对营养条件的倾向是不同的。这个结果不仅反映在类群组成的垂直分布(图3),而且反映在各区域水柱积分类群贡献量的差异(表1)。Latasa等[19]对地中海水华的不同阶段的浮游植物群落结构进行研究发现,定鞭金藻属于中营养类群(mesotrophic group),而聚球藻属于贫营养类群(oligotrophic group)。原绿球藻在暖涡区的贡献量显著高于对照区,这与Huang等[5]在源于南海北部近岸的暖涡中研究结果一致。同时聚球藻在暖涡区显著增加,在冷涡区显著减少,表明了原绿球藻和聚球藻这些微微型的原核类群在贫营养的环境具有较大竞争优势[20]。冷涡中硅藻贡献量有显著增加,但依然只占较低的百分比(10%),反映了冷涡中营养盐浓度足以引起大粒径的藻类增加,但还没有使硅藻类群占据绝对优势[21-22]。
南海一年四季涡旋活动频繁,尤其在夏季西南季风盛行期,南海西部11°~15°N海域受中尺度涡的影响。在如此大范围的中尺度过程作用下,估量整个南海的碳收支问题时就不得不考虑南海涡旋的影响。因为冷涡通过各种机制改变营养盐的垂直通量,让更多的无机氮进入到真光层,从而增加海洋的初级生产力,并提高浮游植物的现存量。而暖涡中的浮游植物与外源的营养盐相隔离[16,23],一般生产力比较低。我们在本研究中发现中尺度涡有限地改变了南海的浮游植物群落结构。不同的浮游植物功能群,在生物地球化学循环过程中起着不同的作用。如硅藻对硅泵和碳泵的输出有重要影响,球石藻产生的二甲基硫在海洋硫循环中起着重要作用,而蓝藻中的束毛藻属由于其固氮功能在全球的氮循环中占据着重要地位。通过化学分类法对南海浮游植物进行了研究,虽然从色素类型上确定了浮游植物类群,但无法对这些类群进行更细致地划分,确定其种类。如能准确获悉南海浮游植物的种类分布(如定鞭金藻),便可以更加深入了解中尺度涡的生物意义。
4 结 语
在南海西部存在着一对偶极子分布模式的暖涡和冷涡。通过聚类分析,将调查站位具体划分归纳为暖涡区、冷涡区和对照区。从总Chl-a的垂直分布来看,暖涡造成了叶绿素最大层的下移。从类群组成来看,虽然南海西部的群落结构都以定鞭金藻、聚球藻和原绿球藻为优势类群,但它们在各区域的贡献量表现出显著差异。相比于对照区,暖涡区定鞭金藻贡献量增加,而原绿球藻和聚球藻贡献量降低;冷涡区硅藻贡献量增加,聚球藻贡献量减少。在今后研究中,需要将光照、营养盐等更多参数考虑进来,才能更加清楚和全面地认知中尺度涡的物理-化学-生物耦合与生态作用。
致谢:感谢“东方红2号”全体船员和航次首席对样品采集的大力支持与帮助。
参考文献(References):
[1] WANG G, SU J, CHU P C. Mesoscale eddies in the South China Sea observed with altimeter data[J]. Geophys. Res. Lett., 2003, 30(21): 2121.
[2] TSENG C M, WONG G T F, LIN I I, et al. A unique seasonal pattern in phytoplankton biomass in low-latitude waters in the South China Sea[J]. Geophys. Res. Lett., 2005, 32, L08608,doi:10.1029/2004GL022111.
[3] CHAO S Y, SHAW P T, WU S Y. Deep water ventilation in the South China Sea[J]. Deep Sea Research Part I: Oceanographic Research Papers, 1996, 43(4): 445-466.
[4] WONG G T F, KU T L, MULHOLLAND M, et al. The SouthEast Asian Time-series Study (SEATS) and the biogeochemistry of the South China Sea-An overview[J]. Deep Sea Research Part II: Topical Studies in Oceanography, 2007, 54(14-15): 1434-1447.
[5] HUANG B Q, HU J, XU H, et al. Phytoplankton community at warm eddies in the northern South China Sea in winter 2003/2004[J]. Deep Sea Research Part II: Topical Studies in Oceanography, 2010, 57(19): 1792-1798.
[6] XUE H, CHAI F, PETTIGREW N, et al. Kuroshio intrusion and the circulation in the South China Sea[J]. Journal of Geophysical Research, 2004, 109(C2): C02017.
[7] 潮州气象网. 南海海区划分[EB/OL]. [2013-04-27]. http:∥czqx.czonline.net/gdczqx/zhishi/gdcze/mc/mcsm3.htm.Chaozhou meteorological network.South China Sea division[EB/OL]. [2013-04-27]. http:∥czqx.czonline.net/gdczqx/zhishi/gdcze/mc/mcsm3.htm.
[8] FURUYA K, HAYASHI M, YABUSHITA Y. HPLC determination of phytoplankton pigments using N, N-dimethylformamide[J]. Journal of Oceanography, 1998, 54(2): 199-203.
[9] HU J. Studies on phytoplankton community structure and its responses to upwelling in southern Taiwan Strait[D]. Xiamen: XiamenUniversity, 2009. 胡俊. 台湾海峡南部浮游植物类群组成及其对上升流的响应研究[D]. 厦门: 厦门大学, 2009.
[10] CHEN J X, HUANG B Q, LIU Y, et al. Phytoplankton community structure in the transects across East China Sea and northern South China Sea determined by analysis of HPLC photosynthetic pigment signatures[J]. Advances in Earth Science, 2006, 21(7): 738-746. 陈纪新, 黄邦钦, 刘媛, 等. 应用特征光合色素研究东海和南海北部浮游植物的群落结构[J]. 地球科学进展, 2006, 21(7): 738-746.
[11] JEFFREY S W, WRIGHT S W. Photosynthetic pigments in the Haptophyta[C]∥GREEN J C, LEADBEATER B S C. The Haptophy to Algae. Oxford: Clarendon Press:111.
[12] MACKEY M, MACKEY D, HIGGINS H, et al. CHEMTAX a program for estimating class abundances from chemical markers: application to HPLC measurements of phytoplankton[J]. Marine Ecology Progress Series, 1996, 14(1): 265-283.
[13] LUKAS R, LINDSTROM E. The mixed layer of the western equatorial Pacific Ocean[J]. Journal of Geophysical Research, 1991, 96: 3343-3358.
[14] Colorado Center for Astrodynamics Research. Global near realtime CCAR gridded SSH viewer[EB/OL]. [2011-09-08-17]. http:∥eddy.colorado.edu/ccar/data_viewer/index.
[15] MCGILLICUDDY D J, ROBINSON A R, SIEGEL D A, et al. Influence of mesoscale eddies on new production in the Sargasso Sea[J]. Nature, 1998, 394(6690): 263-266.
[16] THOMPSON P A, PESANT S, WAITE A M. Contrasting the vertical differences in the phytoplankton biology of a dipole pair of eddies in the south-eastern Indian Ocean[J]. Deep Sea Research Part II: Topical Studies in Oceanography, 2007, 54(8-10): 1003-1028.
[17] DE SOUZA R B, MATA M M, GARCIA C A E, et al. Multi-sensor satellite and in situ measurements of a warm core ocean eddy south of the Brazil-Malvinas Confluence region[J]. Remote Sensing of Environment, 2006, 100(1): 52-66.
[18] SEKI M P, POLOVINA J J, BRAINARD R E, et al. Biological enhancement at cyclonic eddies tracked with GOES thermal imagery in Hawaiian waters[J]. Geophysical Research Letters, 2001, 28(8): 1583-1586.
[19] LATASA M, SCHAREK R, VIDAL M, et al. Preferences of phytoplankton groups for waters of different trophic status in the northwestern Mediterranean Sea[J]. Marine Ecology Progress Series, 2010, 407: 27-42.
[20] PARTENSKY F, BLANCHOT J, VAULOT D. Differential distribution and ecology ofProchlorococcusandSynechococcusin oceanic waters: a review[J]. Bulletin de l'Institut Oceanographique Monaco, 1999,19: 457-476.
[21] MCGILLICUDDY D J, ANDERSON L A, BATES N R, et al. Eddy/wind interactions stimulate extraordinary mid-ocean plankton blooms[J]. Science, 2007, 316(5827): 1021-1026.
[22] LANDRY M R, BROWN S L, RII Y M, et al. Depth-stratified phytoplankton dynamics in Cyclone Opal, a subtropical mesoscale eddy[J]. Deep Sea Research Part II: Topical Studies in Oceanography, 2008, 55(10): 1348-1359.
[23] XIU P, CHAI F. Modeled biogeochemical responses to mesoscale eddies in the South China Sea[J]. Journal of Geophysical Research, 2011, 116: C10006.

