多聚精氨酸融合增强型绿色荧光蛋白制备方法及穿膜效果
张楠,白银,赵景壮,叶贤龙,王文飞,任桂萍,李德山,荆燕
东北农业大学生命科学学院,黑龙江 哈尔滨 150030
随着人们对疾病的发生机理了解日益深入,一大批具有治疗价值的多肽类药物陆续被人们发现并进入市场,每年平均16.8%多肽类药物进入临床研究[1]。可是目前市场上没有一个多肽类药物作用于胞内蛋白,如此便限制了它们的治疗空间。根据Lipinski五规则[2],蛋白多肽类药物没有良好的渗透性,不能自由进入细胞内部。目前所使用的多肽类药物均只能作用于胞外及细胞表面,如此便有大量的靶点未能开发及利用[3],而且皮下和静脉给药的方式又给病人的身体带来了痛苦。
细胞穿膜肽又称蛋白转导域、特洛伊肽,具有携带比起自身大100倍的物质穿透细胞膜进入细胞内部的能力。自 1988年首次被人们发现以来[4-5],细胞穿膜肽已经被应用于多方面的研究及应用。一小部分基于细胞穿膜肽研发的药物已经进入了临床试验,例如:AZX100 (Capstone Therapeutics),RT001 (ReVance Therapeutics),KAI-9803 (KAI Pharmaceuticals),XG-102 (Auris Medical)。
多聚精氨酸作为目前已知最为简单有效的细胞穿膜肽,其中以九聚精氨酸 (R9)效率最高(大约为TAT的20倍)[6-7],具有极大的研究及应用价值。为了便于纯化 R9融合蛋白,我们在pSUMO载体基础上构建pSUMO-R9-EGFP原核蛋白表达载体。虽然R9具有很高的穿膜效率,但精氨酸作为一种极性很强的氨基酸,大量精氨酸的存在极易使重组蛋白过表达时形成包涵体,从而增加纯化难度。SUMO广泛存在于各种真核细胞中,参与调节细胞凋亡、信号转导、RNA转录、蛋白的核质运输以及细胞周期等多种生理进程[8],SUMO作为一个分子伴侣可增加重组蛋白在大肠杆菌高效表达时的可溶性[9],再经SUMO酶1酶切后可得高度提纯的目的蛋白,且不残留额外的氨基酸[10]。为避免R9对EGFP的空间结构造成影响,两者经一个15氨基酸的GS柔性连接肽 (Gly4Ser)3相间隔。本研究的目的是利用 SUMO表达和纯化系统,高效、可溶性表达R9融合蛋白R9-EGFP,并检验该融合蛋白进入细胞的能力。
实验结果显示,细胞穿膜肽R9可快速有效地携带EGFP进入细胞内部,经流式细胞仪检测,胞内EGFP荧光强度呈时间、剂量依赖性,大约1.5 h以后荧光强度增加不显著。这些数据显示,我们可以利用SUMO-R9表达系统快速高效地表达R9融合蛋白,进行蛋白和细胞间的瞬时相互作用。同时为临床蛋白药物研发和改进提供了新的思路。
1 材料与方法
1.1 材料
菌种大肠杆菌 Escherichia coli DH5α,Rosetta(DE3)用于质粒扩增及蛋白表达。表达质粒 pSUMO及 pEE6.4-EGFP为本实验室保存,Ni-NTA树脂购自Qiagen公司。引物由Invitrogen公司合成。
其中引物RF及RR变性复性后为R9序列两端预留BsaⅠ及NheⅠ黏性末端;引物LF及LR变性复性后为(Gly4Ser)3序列两端预留 NheⅠ及BamHⅠ黏性末端;引物E1、E2、E3用于EGFP的克隆。
1.2 pSUMO-EGFP及pSUMO-R9-EGFP的构建
以引物E3、E2克隆EGFP基因后,利用引物上的BsaⅠ、NotⅠ酶切位点将片段制备出粘性末端。利用连接酶将基因插入相应的 SUMO载体,获得的重组载体命名为pSUMO-EGFP。
以引物E1、E2克隆EGFP基因后利用引物上的BamHⅠ、NotⅠ酶切位点将片段制备出粘性末端。利用连接酶将基因插入相应的 SUMO载体,再经BsaⅠ、BamHⅠ酶切制备出粘性末端,插入R9及GS linker序列,重组载体经测序鉴定正确后,将重组载体命名为pSUMO-R9-EGFP。

表1 本研究中所用的引物Table 1 Primers used in this study
1.3 SUMO-EGFP及SUMO-R9-EGFP的蛋白表达
将构建好的 pSUMO-EGFP及 pSUMO-R9-EGFP转化Rosetta(DE3)。挑取单克隆于LB培养基 (氨苄青霉素100 mg/L),37 ℃培养过夜。将过夜培养物以1∶100的比例接种至0.5 L上述抗性的LB培养基中,37 ℃培养至OD600为0.4时,加入IPTG使其终浓度达0.25 mmol/L,30 ℃继续培养4 h后,离心收获菌体。
1.4 SUMO-EGFP及SUMO-R9-EGFP可溶性的比较
收获的菌体以缓冲液1 (50 mmol/L磷酸三钠,pH 8.0,150 mmol/L NaCl,40 mmol/L咪唑)重悬,超声破碎菌体后离心,分别取上清液和沉淀进行 15% SDS-PAGE电泳分析。比较SUMO-EGFP融合蛋白和SUMO-R9-EGFP融合蛋白的可溶性表达。
1.5 SUMO-EGFP及SUMO-R9-EGFP蛋白的提取
收获的菌体以缓冲液1重悬,进行超声破碎。4 ℃、12 000×g离心,留取细菌裂解上清,将裂解上清经AKTA purifier 100系统进行纯化。首先将裂解上清上样于已用缓冲液 1预平衡过的5 mL Ni-NTA柱,上样速度0.5 mL/min。上样完毕后,先用缓冲液 1充分洗柱,后用缓冲液 2(50 mmol/L 磷酸三钠,pH 8.0,150 mmol/L NaCl,400 mmol/L咪唑)进行洗脱。洗脱后组份经HiPrep 26/10 Desalting脱盐至PBS中。
1.6 EGFP及R9-EGFP蛋白的提取
将上述融合蛋白加入SUMO蛋白酶1 (摩尔比20∶1)后4 ℃过夜酶切,酶切产物上样于PBS平衡过的 Ni-NTA柱,流穿组分即为纯化后的EGFP及R9-EGFP蛋白。
1.7 R9-EGFP穿膜活性的检测
将EGFP及R9-EGFP稀释至50 μg/mL添加至细胞密度为 1.5×106/孔、培养于 6孔板的HepG2细胞培养基中,分别在孵育0.5、1、1.5、2 h后胰酶消化、PBS洗涤后重悬经BD Aria流式细胞仪检测 R9-EGFP穿膜效率 (激发波长488 nm,检测波长 525 nm)。同时将 EGFP及R9-EGFP 稀释浓度梯度 5 μg/mL、10 μg/mL、15 μg/mL 、 20 μg/mL 添 加 至 细 胞 密 度 为1.5×106/孔、培养于6孔板的HepG2细胞培养基中,孵育1 h后胰酶消化、PBS洗涤后重悬进行流式检测R9-EGFP穿膜效率。
1.8 R9-EGFP穿膜活性的激光共聚焦观测
将R9-EGFP稀释至40 μg/mL添加至细胞密度为 1×106/孔、培养于 6孔板的 HepG2细胞爬片后培养基中,分别在孵育1.5 h,5 μg/mL DAPI孵育10 min后,PBS洗涤后经激光共聚焦 (Leica TCSSP2AoBS)观测。同时,以相同浓度 EGFP处理的HepG2细胞作为对照。
1.9 肝素对R9-EGFP穿膜效率的抑制试验
将肝素稀释至 1 μg/mL、2 μg/mL、3 μg/mL、4 μg/mL添加至细胞密度为1.5×106/孔、培养于6孔板的HepG2细胞培养基中,孵育30 min后,加入40 μg/mL R9-EGFP蛋白。同时只添加同样浓度的 EGFP、R9-EGFP蛋白于另外两个培养孔中,作为对照。继续孵育1.5 h后,胰酶消化、PBS洗涤后重悬进行流式检测 R9-EGFP穿膜效率。
2 结果
2.1 SUMO-EGFP与SUMO-R9-EGFP的表达
SUMO-EGFP蛋白表达情况见图 1,SUMO-R9-EGFP蛋白表达情况见图2。由图1、图2可以看出两种蛋白都不同程度以可溶形式表达,但蛋白在上清中相对表达量SUMO-R9-EGFP(30%)相对SUMO-EGFP (50%)略有降低。
2.2 EGFP及R9-EGFP的纯化
EGFP和 R9-EGFP蛋白纯化结果见图 3。SDS-PAGE电泳结果显示经SUMO酶1酶切后再次经 Ni-NTA柱层析,均可得到高度纯化的EGFP及R9-EGFP蛋白。电泳结果显示R9-EGFP(29 kDa)蛋白分子量略大于EGFP (27 kDa)蛋白。灰度扫描分析两种蛋白纯度均95%以上。

图2 SUMO-R9-EGFP蛋白表达电泳分析Fig. 2 Expression analysis of the SUMO-R9-EGFP fusion protein. 1: protein molecular weight marker; 2:supernatant of SUMO-R9-EGFP cell lysates before induced; 3: precipitate of SUMO-R9-EGFP cell lysates before induced; 4: supernatant of SUMO-R9-EGFP cell lysates after induced; 5: precipitate of SUMO-R9-EGFP cell lysates after induced.

图3 纯化后EGFP及R9-EGFP蛋白电泳分析Fig. 3 SDS-PAGE analysis of the mature EGFP and R9-EGFP peptides. 1: protein molecular weight marker;2: purified mature EGFP protein; 3: purified mature R9-EGFP protein.
2.3 R9-EGFP穿膜能力的检测
流式检测结果显示只有 R9-EGFP蛋白可以检测到荧光信号,单独EGFP无信号。R9-EGFP信号强度呈现出时间 (图4)及剂量 (图5)依赖性。大约1.5 h后信号强度达到平台期,与未处理及 EGFP处理相比大约 50%的细胞表现出强荧光信号。只添加EGFP蛋白的细胞未检测到荧光信号。随蛋白浓度增加 R9-EGFP处理细胞荧光信号强度呈递增趋势 (由9.6%递增至48%),而 EGFP处理细胞与空细胞相比荧光信号未有变化。
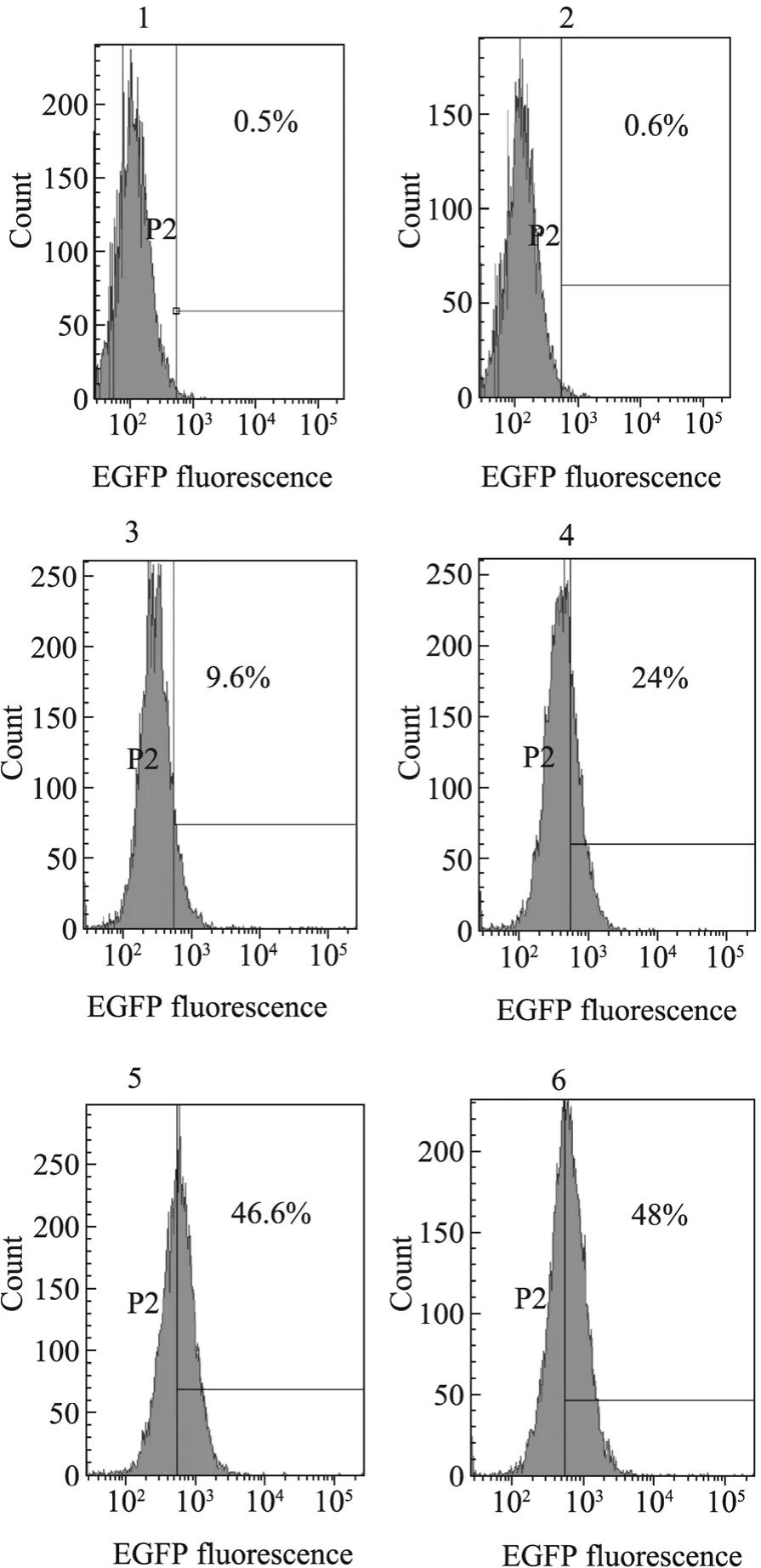
图4 R9-EGFP时间梯度流式检测结果Fig. 4 Incubation of HepG2 cells with time gradients of R9-EGFP. 1: HepG2 cells without protein; 2: HepG2 incubated with EGFP 2 h; 3: HepG2 incubated with R9-EGFP 0.5 h; 4: HepG2 incubated with R9-EGFP 1 h;5: HepG2 incubated with R9-EGFP 1.5 h; 6: HepG2 incubated with R9-EGFP 2 h.

图5 R9-EGFP剂量梯度流式检测结果Fig. 5 Incubation of HepG2 cells with dosage gradients of R9-EGFP. 1: HepG2 cells without protein; 2: HepG2 incubated with 20 μg/mL EGFP 1 h; 3: HepG2 incubated with 5 μg/mL R9-EGFP 1 h; 4: HepG2 incubated with 10 μg/mL R9-EGFP 1 h; 5: HepG2 incubated with 15 μg/mL R9-EGFP 1 h; 6: HepG2 incubated with 20 μg/mL R9-EGFP 1 h.
2.4 R9-EGFP穿膜活性的激光共聚焦观测
激光共聚焦结果 (图 6)显示,单独 EGFP没有进入细胞内部的能力,而 R9-EGFP (绿色)可以进入细胞内部,聚集于细胞质内,没有继续进入细胞核 (蓝色区域)中。
2.5 肝素对R9-EGFP穿膜活性的抑制结果
肝素抑制结果 (图 7)显示,肝素对R9-EGFP的穿膜效果有明显抑制作用,在2 μg/mL的浓度下可抑制50%左右的穿膜效率,随着肝素浓度的增加抑制效果没有明显增加。由此可以推断出R9的穿膜机制一定程度上依赖于与细胞表面的肝素结合,但并不完全依赖肝素一条途径。
3 讨论
目前将多肽类药物、DNA等导入细胞内普遍采用的手段有:物理方法,如电穿孔[11]、显微注射[12]等;生物及化学方法,如洋地黄皂苷处理法[13]、成孔蛋白质法[14]等;其他方法,如运用免疫毒素[15]等蛋白质载体、颗粒 (如脂质体)包裹法[16]和病毒载体[17]等。但由于上述方法存在分子导入率低、易造成细胞损伤甚至死亡,以及细胞内部无相应靶向性等诸多不足,使得许多无生物膜通透性且易降解的亲水性多肽、蛋白质及寡核苷酸在药学领域的应用大大受限。相比之下,细胞穿膜肽在这方面显然具有很大优势:细胞膜亲和性高,穿膜速度快,最重要的是对细胞膜没有破坏性。将它们作为生物活性分子的细胞内转运工具,应用于细胞生物学、基因治疗、药物体内转运、临床药效评价等领域,具有诱人的前景。同时研究发现细胞穿膜肽可增加多肽类药物的口服[18]、肺部[19]、肠道[20]给药的吸收及生物利用度,基于细胞穿膜肽所开发的多肽药物及给药方式国内外均有所研究。未来的几十年里对于多肽类药物稳定性及体内转运方面的研究将是整个生物医药领域的发展趋势,而细胞穿膜肽必将是其中研究热点之一。
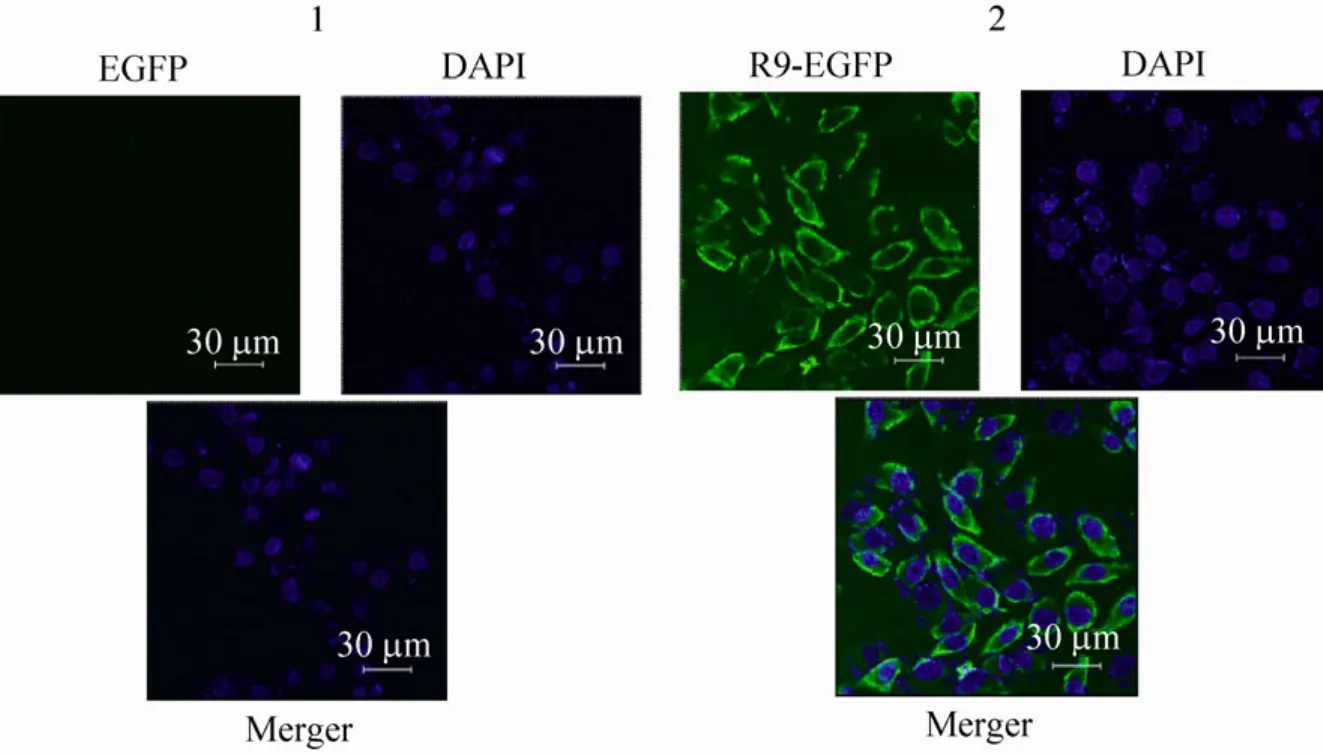
图6 R9-EGFP激光共聚焦检测结果Fig. 6 Confocal fluorescence microscopy of HepG2 cells incubated with R9-EGFP. 1: HepG2 incubated with 50 μg/mL EGFP 1.5 h; 2: HepG2 incubated with 50 μg/mL R9-EGFP 1.5 h.
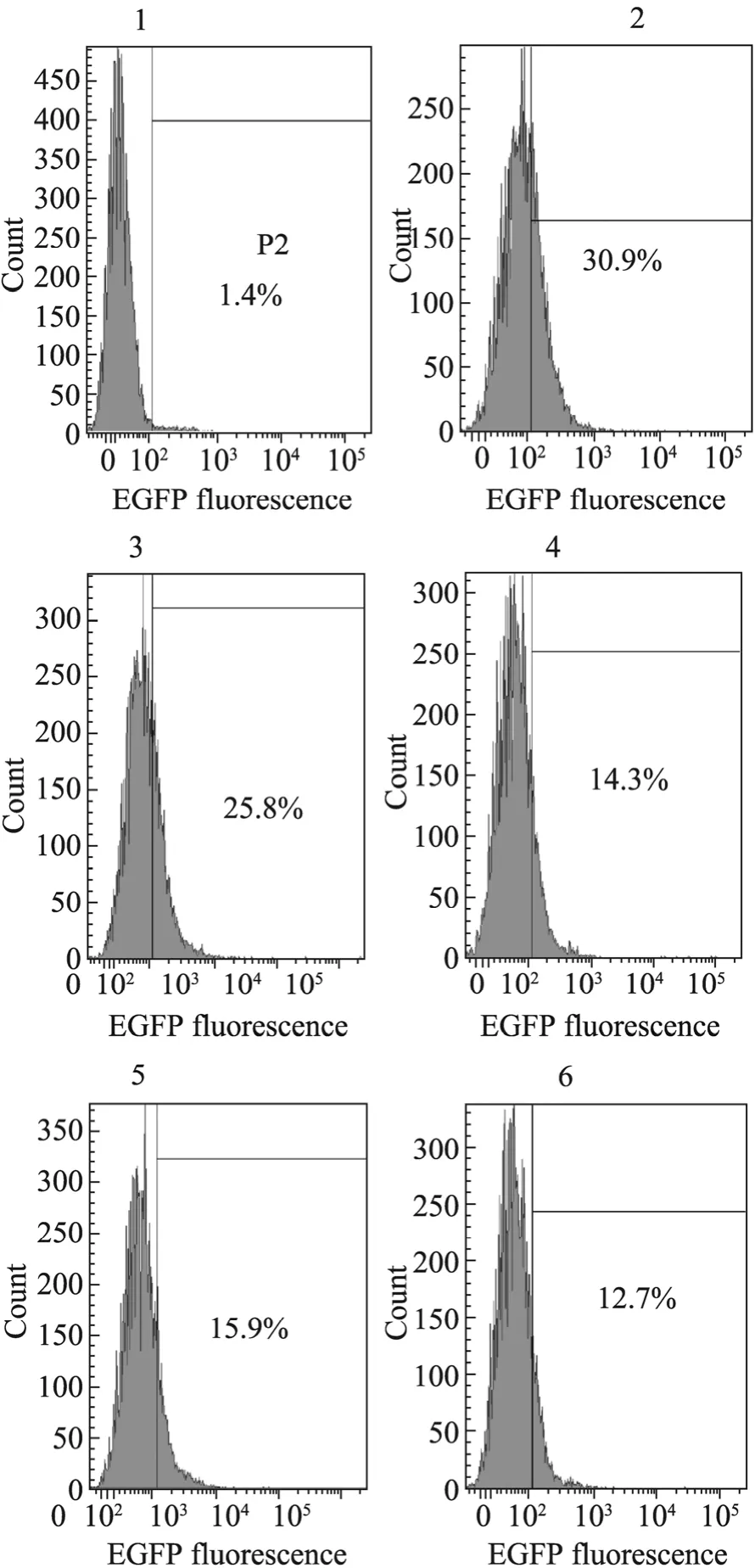
图7 肝素对R9-EGFP活性抑制实验检测结果Fig. 7 Competitive inhibition of HepG2 uptaking R9-EGFP by heparin. 1: HepG2 incubated with 40 μg/mL EGFP 1.5 h; 2: HepG2 incubated with 40 μg/mL R9-EGFP 1.5 h; 3: HepG2 incubated with 1 μg/mL heparin 30 min and 40 μg/mL R9-EGFP 1.5 h;4: HepG2 incubated with 2 μg/mL heparin 30 min and 40 μg/mL R9-EGFP 1.5 h; 5: HepG2 incubated with 3 μg/mL heparin 30 min and 40 μg/mL R9-EGFP 1.5 h;6: HepG2 incubated with 4 μg/mL heparin 30 min and 40 μg/mL R9-EGFP 1.5 h.
但典型的细胞穿膜肽富含赖氨酸、精氨酸等极性氨基酸。当蛋白在大肠杆菌中高效表达时大量赖氨酸、精氨酸的存在不利于目的蛋白保持可溶形式。本研究在pSUMO载体的基础上添加了R9,为防R9对EGFP蛋白造成影响两者经一个15个氨基酸的GS柔性连接肽相间隔。我们的结果显示,相对于单独 EGFP,虽然 R9对 EGFP的可溶性表达有一定的影响,但在 SUMO分子伴侣的作用下仍有30%~40%融合蛋白呈现可溶状态。我们在对细胞穿膜肽融合p53及CD基因表达时均得到相同的结论,且最终均未对蛋白活性造成明显影响,为其他R9融合蛋白的表达及纯化提供了依据。
经SUMO酶1酶切及Ni-NTA柱层析后可得到高度提纯、有活性、无残留额外氨基酸的目的蛋白。体外细胞实验显示单独的EGFP不能进入细胞内部,而R9可快速有效地携带EGFP进入细胞内部,穿膜效率呈现浓度和时间依赖性,大约1.5 h后荧光信号达到最高。同时HepG2细胞MTT检测发现无论EGFP还是R9-EGFP均没有对细胞生长造成明显抑制 (数据未显示)。
目前关于穿膜肽的确切穿膜机制仍不明确。研究结果显示富含精氨酸类的穿膜肽跨膜运输需与细胞表面的肝素等多糖结合才能发挥作用[21],但不同实验室得出的结论并不一致[22-23]。我们实验结果显示,多聚精氨酸的跨膜运输的确与肝素的结合有关[24],但并不完全依赖肝素一条途径。同时将蛋白4 ℃过夜孵育显示R9-EGFP没有穿膜效果 (结果略),这也说明多聚精氨酸的跨膜运输是一个耗能过程而不是简单的直接跨膜转运。
以往多聚精氨酸融合蛋白制备方法为包涵体变性复性或者体外合成多肽后经二硫键共价偶联。前者蛋白制备时间长,且存在复性率低、蛋白浓度低且末端残留His标签 (已有文献报道显示His标签可将蛋白聚集于肝脏,具有潜在的肝细胞毒副作用[25])等原因。而后者费用昂贵,不宜工业化生产蛋白。
经pSUMO-R9/Ni-NTA系统可快速高效地得到R9融合蛋白,简化纯化步骤,方便对蛋白活性及功能的研究。总之,本研究结果证实了应用pSUMO-R9/Ni-NTA系统表达R9融合蛋白的可行性,为多肽类药物的研发提供了捷径和新的思路。
但是绝大多数细胞穿膜肽自身没有细胞特异性,如此便会造成应用时的靶向性不足以及药品的浪费。因此未来开发具有组织器官靶向性、可胞内定位的细胞穿膜肽类药物并配合合适的剂型将是细胞穿膜肽研究的方向之一。
[1]Development Trends for Peptide Therapeutics[EB/OL]. [2011-12-26]. http://www.peptidetherapeutics.org/PTF_Summary.
[2]Lipinski CA, Lombardo F, Dominy BW, et al.Experimental and computational approaches to estimate solubility and permeability in drug discovery and development settings. Adv Drug Deliv Rev, 1997, 23(1–3): 3-25.
[3]Hopkins AL, Groom CR. The druggable genome.Nat Rev Drug Discov, 2002, 1(9): 727-730.
[4]Green M, Loewenstein PM. Autonomous functional domains of chemically synthesized human immunodeficiency virus Tat transactivator protein.Cell, 1988, 55(6): 1179-1188.
[5]Frankel AD, Pabo CO. Cellular uptake of the Tat protein from human immunodeficiency virus. Cell,1988, 55(6): 1189-1193.
[6]Wender PA, Mitchell DJ, Pattabiraman K, et al.The design, synthesis, and evaluation of molecules that enable or enhance cellular uptake: peptoid molecular transporters. Proc Natl Acad Sci USA,2000, 97(24): 13003-13008.
[7]Wouter PR, Petra HB, Parvesh W, et al.Preferential uptake of L-versus D-amino acid cell-penetrating peptides in a cell type-dependent manner. Chem Biol, 2011, 18(8): 1000-1010.
[8]Marblestone JG, Edavettal SC, Lim Y, et al.Comparison of SUMO fusion technology with traditional gene fusion systems: enhanced expression and solubility with SUMO. Protein Sci,2006, 15(1): 182-189.
[9]Butt TR, Edavettal SC, Hall JP, et al. SUMO fusion technology for difficult-to-express proteins. Protein Expr Purif, 2005, 43(1): 1-9.
[10]Malakhov MP, Mattern MR, Malakhov OA, et al.SUMO fusions and SUMO-specific protease for efficient expression and purification of proteins.Struct Funct Gen, 2004, 5(1/2): 75-86.
[11]Deora AA, Diaz F, Schreiner R. Eff i cient electroporation of DNA and protein into conf l uent and differentiated epithelial cells in culture. Traffic,2007, 8(10): 1304-1312.
[12]Lappe S, Maas C, Kneussel M. Microinjection into cultured hippocampal neurons: a straightforward approach for controlled cellular delivery of nucleic acids, peptides and antibodies. J Neurosci Methods,2008, 175(1): 88-95.
[13]Lindnér PG, Heath D, Howell SB, et al. Digitonin enhances the efficacy of carboplatin in liver tumour after intra-arterial administration. Cancer Chemother Pharmacol, 1997, 40(50): 444-448.
[14]Parker MW, Feil SC. Pore-forming protein toxins:from structure to function. Prog Biophys Mol Biol,2005, 88(1): 91-142.
[15]Zheng L, Tao Y, Ping Z, et al. Immunotoxins and cancer therapy. Cell Mol Immunol, 2005, 2(2):106-112.
[16]Zelphati O, Wang Y, Kitada S, et al. Intracellular delivery of proteins with a new lipid-mediated delivery system. J Biol Chem, 2001, 276(37): 35103-35110.
[17]Boeckle S, Wagner E. Optimizing targeted gene delivery: chemical modif i cation of viral vectors and synthesis of artif i cial virus vector systems. AAPS J,2006, 8(4): E731-E742.
[18]El-Sayed K, Mariko M. Oral biodrug delivery using cell-penetrating peptide. Adv Drug Deliv Rev,2012, 64(6): 531-539.
[19]Leena NP, Jeffrey W, Kwang J, et al. Conjugation with cationic cell-penetrating peptide increases pulmonary absorption of insulin. Mol Pharm, 2009,6(2): 492-503.
[20]Morishita M, Kamei N, Ehara J, et al. A novel approach using functional peptides for eff i cient intestinal absorption of insulin. J Control Release,2007, 118(2): 177-184.
[21]Schmidt N, Mishra A, Lai GH et al. Arginine-rich cell-penetrating peptides. FEBS Lett, 2010, 584(9):1806-1813.
[22]Richard JP, Melikov K, Brooks P, et a1. Cellular uptake of un-conjugated, TAT peptide involves clathrin-dependent endocytosis and heparin sulfate receptors. J Biologic Chem, 2005, 280(15):15300-15306.
[23]Wadia JS, Stan RV, Dowdy SF. Transducible TAT-HA fusogenic peptide enhances escape of TAT-fusion proteins after lipid raft macropinocytosis. Nat Med, 2004, 10(3): 310-315.
[24]Fuchs SM, Raines RT. Pathway for polyarginine entry into mammalian cells. Biochemistry, 2004,43(9): 2438-2444.
[25]Özören N, Kim K, Burns TF, et al. The Caspase 9 inhibitor Z-LEHD-FMK protects human liver cells while permitting death of cancer cells exposed to tumor Necrosis factor-related apoptosis-inducing ligand. Cancer Res, 2000, 60(22): 6259-6265.

