三种选育高乙醇耐受性工业酿酒酵母方法的比较
李倩,赵心清,Jin-Soo Kim,白凤武
1 大连理工大学生命科学与技术学院,辽宁 大连 116024
2 大连大学生命科学与技术学院,辽宁 大连 116622
3 ToolGen, Inc, Seoul, 153-023, South Korea
酿酒酵母的乙醇耐性对于超高浓度发酵及连续发酵过程中保持较高的细胞活性非常重要。但酿酒酵母乙醇耐性机制复杂,与乙醇耐性相关的基因有 200多个[1-2],依靠传统的单基因操作或局部代谢支路改造很难得到理想的表型,因此本实验考虑使用人工转录因子 (锌指蛋白文库)[3-4]来获得工业酿酒酵母的高乙醇耐受突变体,并比较其与传统的物理化学诱变方法的正突变率及遗传稳定性等指标。
1 材料与方法
1.1 菌种和培养基
工业酿酒酵母Sc4126,本实验室保存。
YPD培养基 (g/L):葡萄糖 20,蛋白胨 20,酵母粉10;固体培养基添加2% (V/V)琼脂粉。
SD 基本培养基 (g/L):葡萄糖 10,不含氨基酸的酵母氮碱 (YNB)6.7。
人工转录因子相关实验固体和液体培养基分别添加 300 μg/mL 和 100 μg/mL 的 G418。
发酵培养基 (g/L):葡萄糖100,蛋白胨8,酵母粉6。
所有摇瓶培养条件为30 ℃,150 r/min。平板均在30 ℃下培养2~5 d。
1.2 方法
1.2.1 三种育种方法处理菌体
紫外诱变 (UV)参考文献[5]处理菌体,选取合适照射时间使存活率在 50%与 10%左右。等离子体诱变 (Plasma)参考文献[6]处理菌体,选取合适处理时间使存活率在 50%和 10%左右。人工转录因子 (ATF)文库 由韩国 ToolGen公司 Jin-Soo Kim教授提供[4],结构如图1所示。电转锌指蛋白文库质粒到Sc4126中,筛选使用G418。
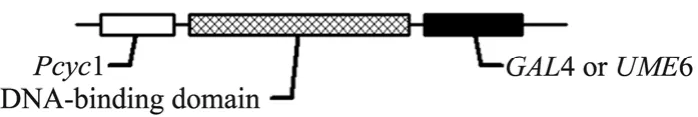
图1 人工转录因子文库主要元件Fig. 1 Key elements of the artificial transcription factor library (ATF).
1.2.2 乙醇耐性突变株的筛选和验证
YPD培养基过夜活化宿主菌Sc4126后添加无水乙醇使终浓度达到 20% (V/V)培养不同时间涂布 YPD平板,选择无菌落长出时对应的处理时间T0来作为耐性筛选条件。
将3种方法得到的突变株用YPD培养基从各自的平板上完全洗下来,加入无水乙醇至终浓度20% (V/V),乙醇冲击T0时间后涂布含10%乙醇的YPD平板。
复筛时将每种育种方法得到的突变株中菌落最大的挑出,在YPD中过夜培养后调整菌株OD600至相同数值,一方面点滴10% (V/V)乙醇平板和普通 YPD平板,另一方面以20% (V/V)接种量转接到含20% (V/V)乙醇的SD基本培养基冲击1~5 h计算存活率,从而定性和定量评估突变体乙醇耐受性。
1.2.3 突变株遗传稳定性验证
在每种突变方法获得的突变株中随机选取 15个突变体,接入 YPD培养基 24 h培养后以 1%(V/V)接种量接至新鲜YPD中,如此传代10次。将最后一次传代的菌体与活化培养的元代突变株调至相同的OD600值,进行两组验证:一组稀释合适倍数涂布含10% (V/V)乙醇YPD平板,培养3 d后计算菌落形成单位 (CFU);另一组分别接入含8%(V/V)乙醇的发酵培养基中培养 36 h后,测量OD600。如果在两组实验中,最后一次传代的突变株与元代突变株的结果差异均在40%以上,则认为此突变株发生了回复突变。
2 结果与分析
2.1 三种改造方法菌体处理条件的确定
确定了乙醇时间T0为2.5 h。人工转录因子文库使用了两种效应域:激活域 (Gal4转录因子)和抑制域 (Ume6转录因子)[4]。根据两种物理诱变存活曲线,考虑到过高的致死率容易导致高比例的负突变[5],选择存活率接近50%和10%的处理时间进行后续实验,即紫外诱变分别选择45 s和90 s处理,等离子体诱变分别选择1.5 min和3.5 min。
2.2 三种育种方法效果比较
每种方法出发菌落数都在10 000株以上,通过足够大的样本量保证结果有统计意义。一般微生物的自发突变率仅有10-6~10-8[7],如表1所示,几种育种方法效率达到10-4以上,其中人工转录因子文库技术正突变率更是高达10-2,比自发突变率高了至少4个数量级,也高出紫外诱变和等离子体诱变1~2个数量级。在两种人工锌指蛋白文库中,锌指序列后接抑制元件Ume6的突变比率比后接激活域Gal4的高26%,推测可能原因是与乙醇耐性相关的天然锌指蛋白多是通过抑制靶基因表达发挥功能,这与Ume6抑制元件功能相似,因此导入这类锌指蛋白的菌株更易筛选得到乙醇耐性提高的表型[8-9]。
进一步对每种方法得到的菌落直径最大的突变体进行了乙醇耐受的定性与定量测试。图2为乙醇平板点滴实验结果,在 10% (V/V)平板上对照菌只能生长1~2个稀释梯度,而突变株均可以生长3~4个稀释梯度。如图3所示20% (V/V)乙醇冲击实验结果,3种方法获得的突变株较对照乙醇耐受性有了显著提高。以1 h为例,UV诱变、ATF方法和等离子体诱变得到的突变体分别较对照存活率提高了23.4%、19.1%和14.5%,3种方法均达到了提高乙醇耐性的目的。
2.3 三种育种方法获得的突变株遗传稳定性比较
在每组15个突变株中,紫外诱变组有7个发生回复突变,等离子体诱变组有4个,而人工转录因子组只有1个回复,远低于物理诱变,说明人工转录因子方法得到的突变株较两种物理诱变方法有遗传稳定的特点。
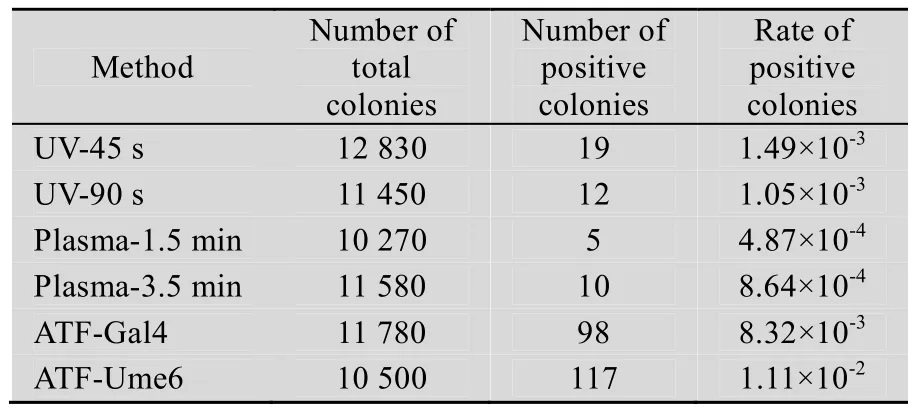
表1 三种诱变方法效率比较Table 1 Efficiency of three mutagenesis approaches using S. cerevisiae Sc4126

图2 突变体乙醇耐性的比较Fig. 2 Analysis of ethanol tolerance of mutants on YPD plates (A)and YPD plates with 10% (V/V)ethanol supplement (B).
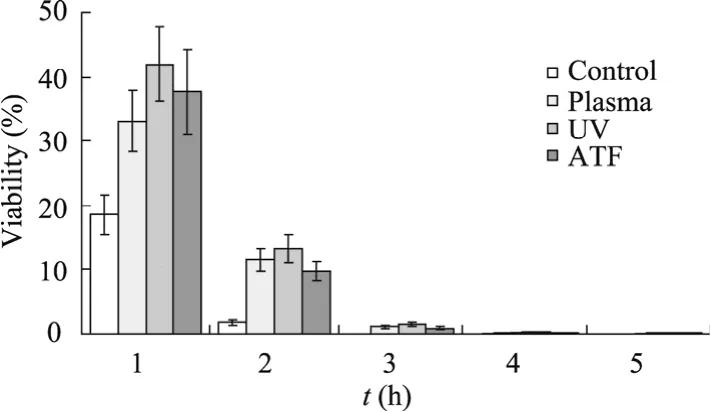
图3 紫外诱变 (UV)、等离子体诱变 (Plasma)和人工转录因子方法 (ATF)筛选到的突变体在 20% (V/V)乙醇冲击下细胞存活率曲线Fig. 3 Viability of mutants obtained by UV treatment,plasma mutagenesis and ATF screening under ethanol-shock treatment at the concentration of 20% (V/V).
3 结论与展望
利用人工转录因子 (人工锌指蛋白)文库技术成功获得200余株乙醇耐性提高的工业酿酒酵母,正突变率高达10-2,相比紫外诱变、介质阻挡等离子体诱变,具有正突变率高且回复突变率低的优点。人工转录因子手段还可以进行酿酒酵母其他胁迫耐性表型的改造,如耐高温和高渗等。获得好的微生物突变体后,可考虑使用诱导型启动子来控制效应域的转录,从而控制基因转录的强度和表达时间,达到对生长和代谢的协同控制。
致谢:感谢修志龙教授提供介质阻挡等离子体设备;感谢陈慧黠博士对等离子体诱变部分的实验给予的帮助和指导;感谢博士生王亮提供的实验思路和实验协助。
[1]Ma M, Liu LZ. Quantitative transcription dynamic analysis reveals candidate genes and key regulators for ethanol tolerance in Saccharomyces cerevisiae. Appl Microbiol Biotechnol, 2010, 87(3): 829-845.
[2]Zhang QM, Zhao XQ, Jiang RJ, et al. Ethanol tolerance in yeast: molecular mechanisms and genetic engineering.Chin J Biotech, 2009, 25(4): 481-487 (in Chinese).张秋美, 赵心清, 姜如娇, 等. 酿酒酵母乙醇耐性的分子机制及基因工程改造. 生物工程学报, 2009, 25(4): 481-487.
[3]Sera T. Zinc-finger-based artificial transcription factors and their applications. Adv Drug Deliv Rev, 2009,61(7/8): 513-26.
[4]Park KS, Lee DK, Lee H, et al. Phenotypic alteration of eukaryotic cells using randomized libraries of artificial transcription factors. Nat Biotechnol, 2003, 21(10):1208-1214.
[5]Li Q, Zhao XQ, He LY, et al. Isolation of auxotrophic mutants of self-flocculating industrial yeast for ethanol fermentation. Ind Microbiol, 2009, 39(5): 44-48 (in Chinese).李倩, 赵心清, 贺雷雨, 等. 自絮凝工业酒精酵母营养缺陷型的筛选和鉴定. 工业微生物, 2009, 39(5): 44-48.
[6]Chen HX, Bai FW, Xiu ZL. Oxidative stress induced in Saccharomyces cerevisiae exposed to dielectric barrier discharge plasma in air at atmospheric pressure. IEEE Transactions Plasma Sci, 2010, 38(8): 1885-1891.
[7]Li RJ. Research Progress of microbial mutation breeding techniques. J Hebei Agri Sci, 2009, 13(10): 73-76 (in Chinese).李荣杰. 微生物诱变育种方法研究进展. 河北农业科学, 2009, 13(10): 73-76.
[8]Martinez-Pastor M, Marchler G, Schüller C, et al. The Saccharomyces cerevisiae zinc finger proteins Msn2p and Msn4p are required for transcriptional induction through the stress response element (STRE). EMBO J,1996, 15: 2227-2235.
[9]Böhm S, Frishman D, Mewes HW. Variations of the C2H2 zinc finger motif in the yeast genome and classification of yeast zinc finger proteins. Nucl Acids Res, 1997, 25(12): 2464-2469.

