胸苷酸合成酶基因多态性与ALL儿童HD-MTX毒副作用的相关性
杨春兰 岳丽杰 于 洁 文飞球 李长钢 郑苗苗 谢 偲丁 慧
大剂量甲氨蝶呤(high-dose methotrexate,HD-MTX)加四氢叶酸钙(CF)解救方案在预防髓外白血病以提高儿童急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)预后方面的效果肯定,但是HD-MTX治疗时发生的严重肝脏和骨髓抑制毒副作用而导致的停药是ALL复发的重要原因之一[1],因此有必要监测MTX引起的毒副作用及可预测其毒副作用的因素。有研究表明胸苷酸合成酶(thymidylate synthase,TS)基因(TYMS)多态性可能与MTX治疗ALL的疗效和毒副作用相关[2-4]。本研究对75例ALL儿童的TYMS3'端非翻译区(untranslated region,UTR)的多态性rs699517、rs2790和rs11280056进行检测,并分析其与52例ALL儿童接受HD-MTX治疗时毒副作用的关系。
1 材料与方法
1.1 对象
2004年3月至2010年6月在深圳市儿童医院住院经骨髓检查确诊的ALL儿童75例,其中男48例,女27例,男女之比为1.8∶1,发病年龄4个月至13岁,中位年龄4.25岁。诊断及分型均符合《儿童急性淋巴细胞白血病诊疗建议(第三次修订草案)》[5]。其中接受HD-MTX化疗的有52例,采用改良ALL-IC-BFM2002方案或GD2008 ALL方案,男35例,女17例,发病年龄6个月至13岁,平均年龄为(5.13±2.85)岁。B-ALL 48例,T-ALL 4例;标危型26例,中危型18例,高危型8例。全部52例均获得第一次完全缓解,并完成了巩固化疗,应用HD-MTX+CF方案预防髓外白血病。HD-MTX治疗前患者一般情况良好,无严重感染;心电图、心肌酶、肝肾功能均正常,符合化疗条件。巩固治疗时标危型和中危型的患者接受4轮HD-MTX(2 g/m2)治疗,高危型患者接受2轮HD-MTX(5 g/m2)治疗,在用HD-MTX同时,每晚顿服巯嘌呤(6-MP)50 mg/m2,所有患者均用CF解救MTX毒性。HD-MTX化疗前使用止吐药;化疗期间每日0.1%洗必泰溶液漱口,0.05%利凡诺坐浴,以防止口腔和肛周感染;每日思密达含漱后口服保护消化道黏膜。
正常对照组为本院门诊健康查体儿童83例,其中男58例,女25例,年龄5个月至12岁,中位年龄4.42岁。正常对照组亦为中国汉族儿童,且无肿瘤病史和家族史。病例组与对照组在性别、年龄分布方面差异无统计学意义(P>0.05)。
1.2 方法
1.2.1 MTX毒副作用统计 每轮HD-MTX输注完后至下轮开始之间或每次HD-MTX输注完后的14天内评估其毒副作用。分析外周血血红蛋白、中性粒细胞、血小板了解骨髓抑制情况;血清ALT、AST升高情况评估肝脏毒性;血清肌酐和尿素氮升高水平评估肾毒性;心脏毒性以心率、心律、心功能情况及心肌酶升高水平判断;神经系统毒副作用包括情绪障碍、失眠、严重头痛、惊厥、瘫痪等;以是否出现恶心、呕吐、腹泻、腹痛、肠梗阻等判断消化道毒性;口腔黏膜损害单独作为一项进行评估。毒副作用分级标准采用美国国立癌症研究所的第3版常规毒性判定标准(NCICTCAE,version3.0)。对观察到的最高级别毒副反应进行统计[6]。
1.2.2TYMS多态性检测 经本院医学伦理委员会审核通过,并获得正常对照组儿童和ALL儿童监护人的知情同意后,正常对照儿童抽取外周静脉血2.0 mL,初诊的ALL儿童在输血及化疗前抽取骨髓液1~1.5 mL。使用QIAamp RNA Blood Mini Kit试剂盒(QIAGEN,德国)按操作说明书提取总RNA,1 μg总RNA使用Reverse Transcriptase XL试剂盒(大连宝生物公司)逆转录获得cDNA。采用巢式PCR扩增,在Tprofessional Std Gradient 96热循环仪(Biometra公司,德国)上进行,引物由英潍捷基(上海)公司合成,第一次PCR上游引物:5'-AGCGAGAACCCAGACCT T-3',下 游 引 物 :5'-TTGACGAATGCAGAACACT T-3'。半巢式PCR上游引物:5'-TACAATCCGCATCCAACTAT-3',下游引物:与第一次PCR扩增下游引物相同。所检测的TYMScDNA片段为第1 040位点至1 585位点(从mRNA的第一个碱基起计数),扩增后片段长度为546 bp。PCR反应体系和PCR反应条件同文献[7]。PCR产物送英潍捷基(上海)公司进行测序。所得测序结果用Chromas软件分析。
1.3 统计学分析
应用基因计数法分别统计正常对照组和ALL各组的TYMS多态性的等位基因及基因型频率,应用SPSS 13.0软件的χ2检验分析各组间差异。P<0.05为差异有统计学意义。对全部75例ALL儿童按性别及年龄(<1岁或≥10岁、1~10岁)各分两组分析其与TYMS多态性关系。对治疗的ALL儿童52例按危险度、各种MTX毒副作用(<2级者、≥2级者)各分为两组[8],分析其与TYMS多态性的关系。
2 结果
2.1 HD-MTX相关的不良反应发生情况
52例接受HD-MTX化疗的ALL儿童,出现的主要不良反应及分级情况见表1。

表1 52例ALL儿童HD-MTX治疗时的不良反应 例(%)Table 1 Toxicities in 52 ALL children treated with HD-MTX
2.2 ALL儿童TYMS多态性与年龄、性别、危险度的关系
TYMSrs699517、rs2790和rs11280056各基因型频率在正常对照组、全部75例ALL儿童和52例接受治疗的儿童中均符合Hardy-Weinberg遗传平衡(P>0.05)。rs699517和rs11280056基因型分布与ALL儿童性别、发病年龄、危险度均不相关(P>0.05);TYMSrs2790与ALL儿童发病年龄、危险度也无相关性(P>0.05)。在正常对照组中TYMSrs2790基因型分布与性别无关(P>0.05),但rs2790基因型与ALL儿童的性别相关,与AA基因型相比,携带等位基因G的ALL男孩数约是女孩的3倍(OR=3.05,95%CI=1.14~8.19,P=0.024),见表2。
2.3 HD-MTX治疗的不良反应与TYMS多态性的关系
将HD-MTX毒副作用(包括骨髓抑制、肝毒性、消化道毒性、口腔黏膜损害)各分为两组(<2级者、≥2级者),分析rs699517、rs2790和rs11280056各基因型在各种毒副作用两组中的分布情况,发现rs2790的基因型与中性粒细胞减少的发生相关,GG基因型具有保护作用,其使发生中性粒细胞减少的危险降低(OR=0.07,95%CI=0.01~0.64,P=0.026),这种作用主要体现在ALL男孩组,见表3,4。rs699517和rs11280056与MTX的这些毒副作用均未观察到相关性(P>0.05),而rs2790与除中性粒细胞减少外的其他MTX毒副作用也无相关性(P>0.05)。

表2 75例ALL儿童和正常对照组儿童的TYMS多态性与性别的关系 例(%)Table 2 Correlation betweenTYMSpolymorphism and gender in the group with 75 childhood ALL patients and normal controls
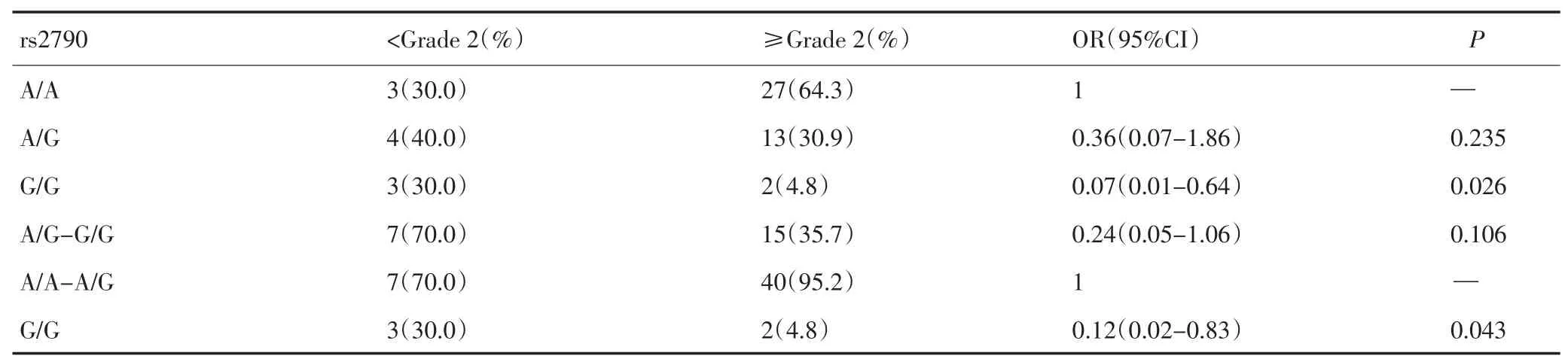
表3 52例ALL儿童TYMSrs2790与HD-MTX引起的中性粒细胞减少的关系Table 3 Relationship betweenTYMSrs2790 and HD-MTX-related neutropenia in 52 cases with childhood ALL

表4 52例ALL儿童TYMSrs2790在不同性别组中与HD-MTX引起的中性粒细胞减少的关系Table 4 Relationship betweenTYMSrs2790 and HD-MTX-related neutropenia in the group with 52 childhood ALL cases of different genders
3 讨论
MTX通过抑制二氢叶酸还原酶,使细胞内TS合成dTMP的底物之一的5,10-亚甲基四氢叶酸产生不足,同时也可直接抑制TS酶活性,使DNA合成障碍,达到细胞毒作用而抗肿瘤[9]。CF的解救一定程度上减少MTX对正常细胞的毒性作用,但MTX毒副作用却不可避免。本研究结果显示HD-MTX治疗儿童ALL时毒副作用较为常见,但多轻微,其中不同程度的骨髓抑制和肝功能损害最为常见,其次为消化道反应、口腔黏膜损害等,大部分患儿对这些毒副作用可耐受,此研究结果与国内多家报道相近,可能由于保肝治疗时机的不同,在肝功能损害发生率上存在明显差异。
本研究结果表明TYMSrs2790与ALL儿童的性别相关,与AA基因型相比,携带等位基因G者男孩数约是女孩的3倍,而在正常对照组儿童中此多态性基因型分布在性别上无显著性差异,考虑患ALL的男孩携带等位基因G的比例较高。此外,本研究结果也表明TYMSrs2790的基因型与HD-MTX引起的中性粒细胞减少发生相关,GG基因型具有保护作用,其使发生中性粒细胞减少的危险降低,进一步分析发现此种保护作用主要出现在ALL男孩组,TYMSrs2790 GG基因型的ALL男孩在HD-MTX治疗时发生中性粒细胞减少的危险明显降低(OR=0.044,95%CI=0.003~0.662,P=0.028),此方面的文献报道较少。此外,TYMSrs699517和rs11280056与HD-MTX的毒副作用无相关性,而rs2790与除中性粒细胞减少外的其他MTX毒副作用也无相关性。
研究表明TYMS多态性可能改变其转录或翻译水平而改变TS蛋白表达[10],可能与MTX对机体的毒副作用相关。Erčulj等[3]对斯洛文尼亚ALL儿童研究发现,TYMS5'-UTR 3R等位基因降低贫血、白细胞减少症、血小板减少症等MTX引起的骨髓抑制毒副作用的发生,同时其可降低总的MTX毒副反应发生危险。另外,3R/3R基因型增加成人ALL MTX治疗引起的贫血发生危险[4]。国内外均鲜见TYMS3'-UTR多态性rs699517、rs2790和rs11280056与ALL儿童的MTX毒副反应关系的文献报道。
综上,本研究表明TYMS多态性与ALL儿童HD-MTX毒副作用存在一定相关性,TYMSrs2790 GG基因型可能降低HD-MTX导致的中性粒细胞减少的发生危险,这可能为ALL儿童化疗个体化提供实验依据。由于TYMS多态性存在显著的种族差异且本研究病例数相对较少,TYMS多态性与ALL儿童HD-MTX毒副作用的相关性仍需更大样本量、多民族地区的进一步研究。
1 Costea I,Moghrabi A,Laverdiere C,et al.Folate cycle gene variants and chemotherapy toxicity in pediatric patients with acute lymphoblastic leukemia[J].Haematologica,2006,91(8):1113-1116.
2 da Silva Silveira V,Canalle R,Scrideli CA,et al.Polymorphisms of xenobiotic metabolizing enzymes and DNA repair genes and outcome in childhood acute lymphoblastic leukemia[J].Leuk Res,2009,33(7):898-901.
3 Erčulj N,Kotnik BF,Debeljak M,et al.Influence of folate pathway polymorphisms on high-dose methotrexate-related toxicity and survival in childhoodacute lymphoblastic leukemia[J].Leuk Lymphoma,2012,53(6):1096-1104.
4 Ongaro A,De Mattei M,Della Porta MG,et al.Gene polymorphisms in folate metabolizing enzymes in adult acute lymphoblastic leukemia:effects onmethotrexate-related toxicity and survival[J].Haematologica,2009,94(10):1391-1398.
5 中华医学会儿科学分会血液组,中华儿科杂志编辑委员会.儿童急性淋巴细胞白血病诊疗建议(第三次修订草案)[J].中华儿科杂志,2006,44(5):392-395.
6 Liu SG,Li ZG,Cui L,et al.Effects of methylenetetrahydrofolate reductase gene polymorphisms on toxicities during consolidation therapy in pediatric acute lymphoblastic leukemia in a Chinese population[J].Leuk Lymphoma,2011,52(6):1030-1040.
7 张洪洪,岳丽杰,袁秀丽,等.GGH基因多态性研究及一个新的错义突变T191G的发现[J].中国肿瘤临床,2012,39(4):185-188.
8 Chen X,Wen F,Yue L,et al.Genetic polymorphism of γ-glutamyl hydrolase in Chinese acute leukemia children and identification of a novel double nonsynonymous mutation[J].Pediatr Hema-tol Oncol,2012,29(4):303-312.
9 Huang L,Tissing WJ,de Jonge R,et al.Polymorphisms in folate-related genes:association with side effects of high-dose methotrexate in childhoodacute lymphoblastic leukemia[J].Leukemia,2008,22(9):1798-1800.
10 Zhang Q,Zhao YP,Liao Q,et al.Associations between gene polymorphisms of thymidylate synthase with its protein expression andchemosensitivity to 5-fluorouracil in pancreatic carcinoma cells[J].Chin Med J(Engl),2011,124(2):262-267.

