用于药物研发的细胞色素P450酶3A4体外肝细胞模型的研究进展
饶小惠,陈 锋,潘明新,汪 艳
(南方医科大学珠江医院1.再生医学研究所,2.肝胆二科,广东广州 510280)
药物研发对医疗进步有着十分重要的作用。20世纪80年代以来,针对心血管、肿瘤、消化系统和疼痛等疾病的新药研发,为疾病治疗提供了更多选择,提高了健康水平、生活质量及平均寿命[1]。药物研发是一个昂贵而且耗时的过程,尽管随着科技进步及投入增加,但是仍然有90%的研发新药不能成功进入临床。20世纪90年代以来,成功上市的新药呈逐年下降趋势,1996年有53种新药通过美国FDA认证,但是到2010年仅有15种[2]。导致新药研发失败的原因有很多,其中一个主要原因是研发后期出现的各种药物毒性反应和药效作用不显著;药物研发过程会对候选药物的药代动力学、药效学以及毒理学特征进行确认,但传统研发体系缺乏在早期能够准确高效分析药物代谢作用和毒性反应的技术工具。
大部分药物进入体内后的代谢过程主要经肝细胞完成。肝细胞含有各种参与体内外物质生物转化的酶类。细胞色素P450酶(cytochrome P450,CYP)是一类含血色素巯基结构的单加氧酶蛋白超家族,是完成相关底物的去毒/生物活化作用的重要药物代谢酶。其中,CYP3A亚家族在肝CYP中含量最高,约占30%,是主要的药物代谢酶类。目前发现 CYP3A包括有 CYP3A4,CYP3A5,CYP3A7及CYP3A43等。CYP3A4在肝细胞中含量最高达40%,其他组织如小肠、肾、肺和脑组织等也有CYP3A4的低水平表达。Ghosh等[3]近期研究发现,CYP3A4不仅参与了药物代谢,还有保护神经元细胞的作用。CYP3A4参与了50%的临床用药的代谢过程,药物代谢谱非常广泛,激素、免疫抑制剂、钙离子通道阻滞剂、咖啡因及抗生素等。其中硝苯地平、咪达唑仑及睾酮是CYP3 A4的特异性底物,常被用于CYP3A4活性水平检测。有些药物,如曲格列酮和胺碘酮等,经CYP3A4代谢后能产生肝不良反应,从而影响了其在临床的应用。一些环境致癌物质(如黄曲霉素B1)也具有CYP3A4代谢依赖性的肝细胞毒性作用。另外,CYP3A4与药物相互作用也是密切相关的,大量临床用药已被证明可以诱导或抑制CYP3A4的活性,使与这些药物合用的其他药物的血浆浓度降低或升高,导致联合用药的疗效减弱或增强甚至产生毒性作用。如特非那定、米贝地尔、阿司咪唑及西伐他丁,由于药物相互作用已经退出了市场。
鉴于CYP3A4在药物代谢过程中的重要作用,药物研发过程需要一个能够再现体内CYP3A4代谢作用的体外模型,用来集中评价CYP3A4对备选药物代谢作用和水平,以及备选药物对CYP3A4活性作用的影响。以肝药物代谢功能为主要对象,现今用于药物开发的体外模型有:①以亚细胞结构微粒体为作用单位的体外代谢模型。亚细胞结构模型中,人肝细胞微粒体是现今最常用的体外模型,因为其来源广,价格低廉且使用简单。② 以细胞为作用单位的代谢模型(简称,细胞模型)。超黏体(supersomes)是基因工程昆虫细胞产生的微粒体,含有较高活性的CYP3A4;其他体外模型还有含有微粒体成分的人肝细胞S9成分等[4]。这些体外模型无法真实反映体内CYP3A4对药物的代谢情况,也不能用于预测体内药物代谢水平的定量分析,因此应用范围有限。③组织器官代谢模型。组织和器官代谢模型是利用组织块或完整器官进行体外药物代谢测试的模型。这些模型虽然在最大程度上保证了代谢主体的完整性,这无疑有利于最大程度地再现体内代谢过程,但其来源罕有并且组织活性维持困难以及成本高,所以大多难以常规使用。
细胞是机体内最小的完整功能执行者;而细胞模型是较单纯的生化模型、细胞器模型,具有更能体现机体生理活动的结构基础和功能能力;较组织器官代谢模型,在技术应用上具有更大的可行性。以细胞为基本功能单位成分的分析模型(cell-based assay,CBA)是现代药物研发技术中受到推崇而日益增多使用的模型工具[5]。因此,本文综述了目前已知的CYP3A4生理功能特征、表达调控机制以及基于已知相关机制进行体外细胞模型构建的细胞种类、构建策略和方式。
1 CYP3A4的表达调控
清楚了解CYP3A4的表达调控机制,是构建理想相关细胞模型的前提和基础理论之一。CYP3A4基因位于染色体7q21.1的P450酶基因簇。CYP3A4的生理性表达包括2个阶段,分别为转录前调控及转录后调控。而转录前调控又可分为2个层面,一个是构成性表达,即生理状态下的持续表达;另一个是诱导性表达,当受到配基活性分子刺激后,表达量增加。
1.1 CYP3A4的转录前调控
CYP3A4基因的5'开放区长35.8 kb,而只有13 kb才是肝特异性的调控区域,该区域包含了一系列的启动子及增强子元件(图1)。
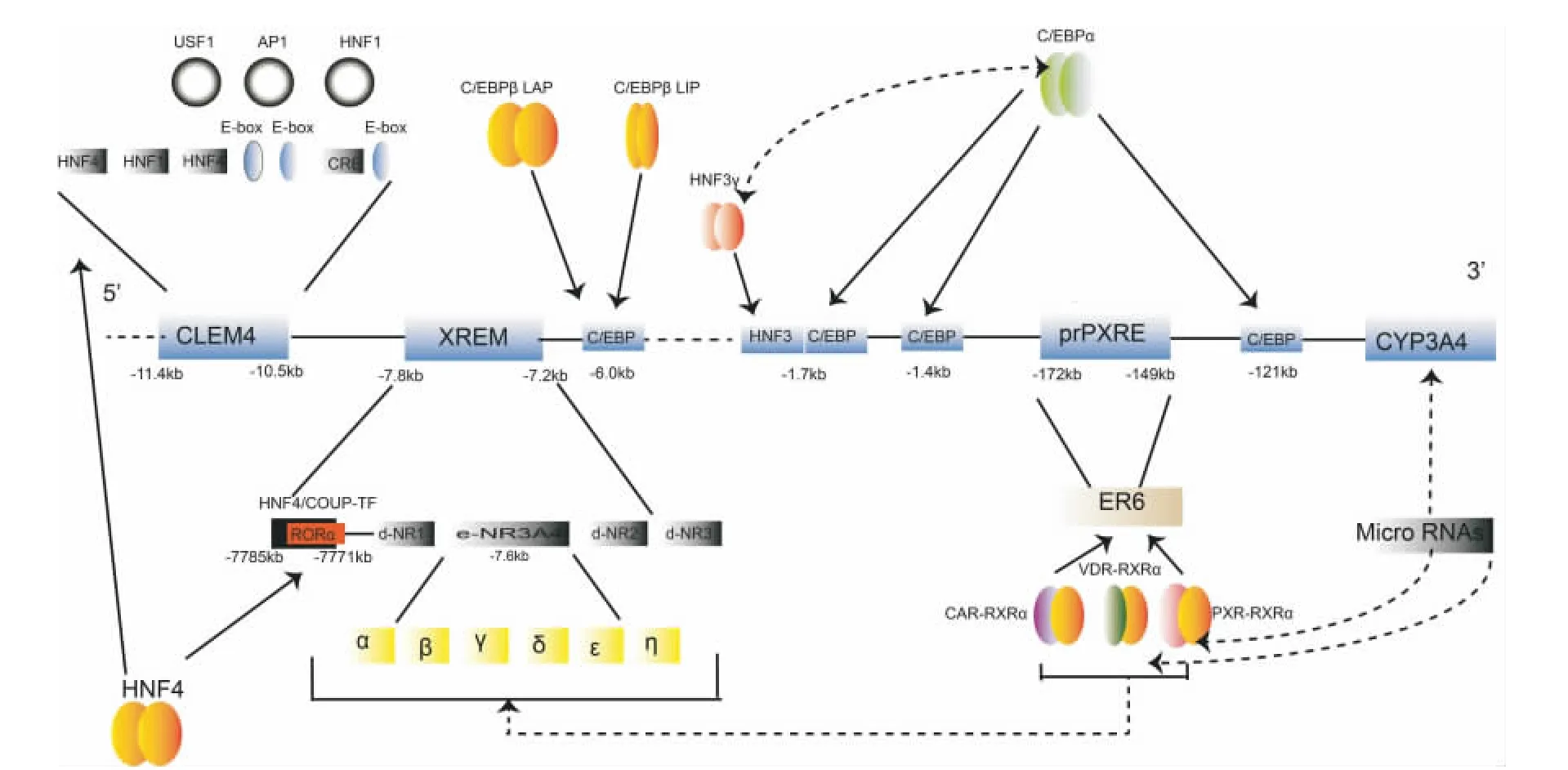
图1 细胞色素氧化酶(CYP)3A 4细胞内调控.CLEM:构成性肝增强子模块件;AP:激活蛋白;C/EBP:CCATT增强子结合蛋白;HNF:肝细胞核因子;USF:上游刺激因子;prPXRE:孕烷X受体反应元件;RXR:维A酸X受体;PXR:核因子X受体;XREM:外源性反应增强模块;CAR:雄甾烷受体;VDR:维生素D受体.
1.1.1 CYP3A4 的诱导性表达
CYP3A4的启动子位于调控序列的近端(-362/+53),近端孕烷 X受体反应元件(proximal pregnane-X-receptor response element,prPXRE)作为最小的启动子,是一个AG(G/T)TCA反向回文序列的六聚体,相互之间被6个核苷酸间隔开。其次是位于CYP3A4转录起始点上游-7.8 kb/-7.2 kb的一个远端外源性反应增强子模块(xenobiotic-responsive enhancer module,XREM)。核因子孕烷X受体(pregnane X receptor,PXR)是调控CYP3A4转录的一个最重要的转录因子,PXR与维甲酸X受体(retinoid X receptor,RXR)α形成异源二聚体,与prPXRE及XREM等元件发生结合,介导CYP3A4的诱导表达[6]。研究指出,PXR启动子及内含子1的单核苷酸多态性(single nucleotide polymorphisms,SNP),与 CYP3A4 表达水平的多态性相关[7]。另有发现,人肝细胞中PXR的3'端非翻译区可以被miR-148a识别,miR-148a表达水平与PXR蛋白水平呈反向关系,生理性地影响到CYP3A4的诱导性/构成性表达水平。最近研究发现一个新的与利福平激活CYP3A4转录相关的调控元件eNR3A4,主要由同向重复的α及β半位点组成,相互之间被4个核苷酸隔开,位于转录起始点上游-7.6 kb处,是PXR激活CYP3A4转录必不可少的一个调控元件[8]。
1.1.2 CYP3A4 的构成性表达
肝源性细胞中CYP3A4表达水平普遍较其他组织来源细胞高,逐渐发现肝组织有高表达的一系列特异性核因子,如肝细胞核因子(hepatic nuclear factor,HNF)4α,HNF1α,FoxA2,SP-1 和 FoxA3[9]等,参与了 CYP3A4 的构成性表达。
构成性肝增强子模块(constitutive liver enhancer module,CLEM)4 位 于 - 11.4 kb/- 10.5 kb,是 调 控CYP3A4构成性表达的一个特异性重要元件。CLEM4长900 bp,由一系列顺式作用元件组成,HNF1α,HNF4α,上游刺激因子(upstream stimulatory factor 1,USF1)及 激活蛋白(activator protein,AP)1共同作用于CLEM4,协同激活该增强子的作用[10]。
在CYP3A4的5'开放区还存在有几个CCAAT增强子结合 蛋 白 α (CCAAT enhancer-binding protein alpha,C/EBPα)的结合位点。C/EBP蛋白家族作为一类普遍存在的转录因子参与了组织分化、炎症反应以及肝脏再生等多种生物学过程[11]。研究发现,C/EBPα通过与 -121,-1393及-1659 bp 3个位点结合,参与了CYP3A4的构成性表达。在肝细胞中,HNF3γ的结合位点位于-1718 bp处,并且与C/EBPα有协同作用,可以增强C/EBPα对CYP3A4的构成性表达[12]。还有研究发现,C/EBPα结合位点突变,对CYP3A4诱导性表达也会产生影响。
C/EBPβ-肝激活蛋白(liver activating protein,LAP)及C/EBPβ-肝 抑 制 蛋 白 (liver inhibitory protein,LIP)是C/EBPβ的2种不同亚型,其作用的元件是一个新的288 bp的增强子,位于-5.59 kb处。在病理状态下(如炎症),随着2种亚型的比例变化,导致CYP3A4的表达水平发生变化[13]。此外,构成性雄甾烷受体(constitutive androstane receptor,CAR)及维生素 D 受体(vitamin D receptor,VDR)也是调控CYP3A4表达的重要转录因子,作用位点与PXR相似,提示这些转录因子的靶基因作用具有重叠性特点,这也正是造成CYP3A4具有广泛的作用底物谱的基础机制之一。
最近研究还发现,微RNA通过对CYP3A4的3’端非翻译区的干扰,对CYP3A4蛋白的表达进行调控;微RNA不仅能直接调控CYP3A4,还能干扰VDR和PXR等转录因子的表达,而间接影响CYP3A4的表达[14]。
1.2 CYP3A4的转录后调控
CYP3A4不仅受到转录前的调控,还受到转录后的调控。在细胞浆中,CYP3A4转录翻译后还会受到磷酸化修饰,主要发生在Ser478,Thr264及Ser420 3个氨基酸残基,而且当CYP3A4磷酸化后,使其易于泛素化而被降解[15]。
2 常用的CYP3A4体外细胞模型
用于药物代谢的CYP3A4体外细胞模型分为肝源性及非肝源性(图2)。常用的非肝源性细胞包括:细菌,酵母菌和昆虫细胞等。然而非肝源性细胞与肝源性细胞相比,其表达的药物代谢酶种类单一,且缺少肝特异性因子,不能如实反映药物在体内的代谢过程,所以在体外药物代谢分析过程中,使用肝源性细胞模型具有明确理论优势。常用的肝源性细胞模型主要包括原代肝细胞及肝细胞系。
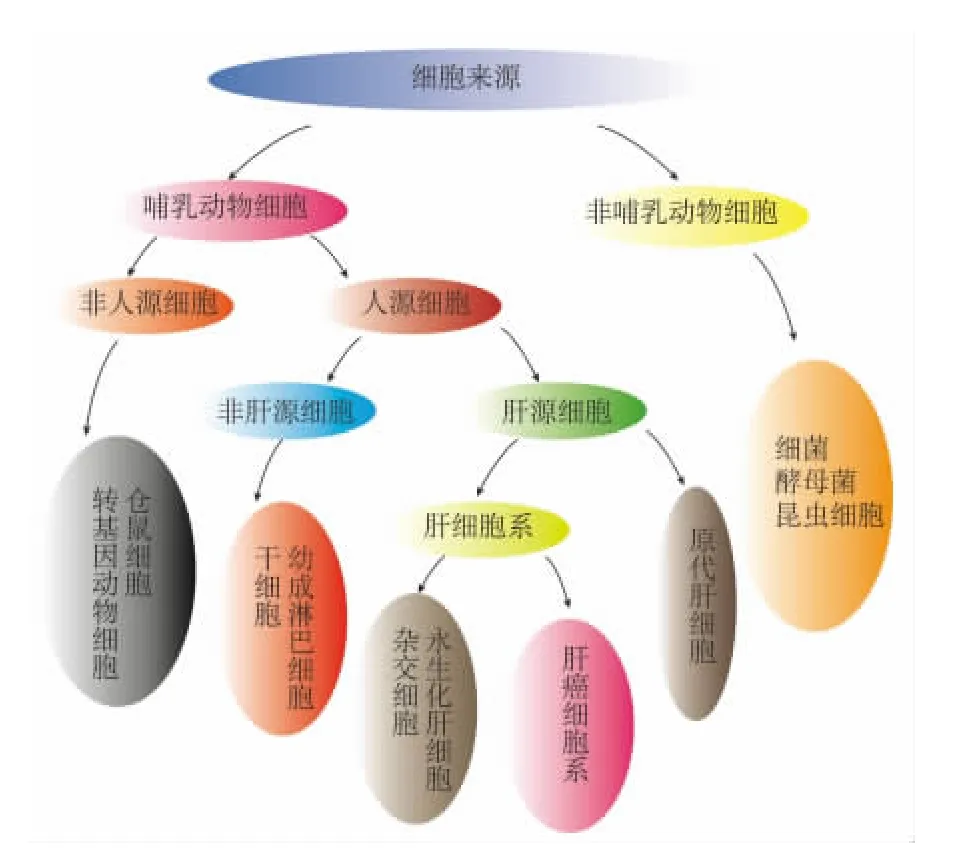
图2 用于药物代谢的CYP3A4体外细胞模型
2.1 原代肝细胞在药物代谢中的应用
人原代肝细胞是最适合用于药物代谢的CYP3A4体外细胞模型,它完整表达了Ⅰ相和Ⅱ相代谢酶以及其他参与分子,能比较准确地模拟药物在人体内的代谢作用,是体外药物代谢的金标准[16]。目前,人原代肝细胞常用于CYP3A4相关的药物代谢研究,如CYP3A4的时间依赖性抑制[17]和药物相互作用等。但是由于细胞来源短缺,人群差异性大和体外培养细胞表型维持困难等缺点,所以广泛应用人原代肝细胞比较困难。由于人原代肝细胞来源稀缺,药物筛选的实践工作中还常常会用到动物来源原代肝细胞。然而动物来源肝细胞,常用如大鼠和猪原代肝细胞,与人类肝细胞的药物代谢酶种类和代谢谱并不一致[18]。因此,目前有研究关注于寻找常用动物肝细胞与人肝细胞的药物代谢作用的相似性关系,希望提高动物模型的预测价值。
2.2 细胞系体外模型在药物代谢中的应用
由于原代肝细胞来源有限以及体外培养困难等缺点,细胞系体外模型具有体外增殖能力,遗传和功能表型相对稳定,并且培养条件比较简单而易于实验室间统一标准,较原代肝细胞更便于用于药物代谢CBA。细胞系可分为肝源性及非肝源性,常用于药物代谢的非肝源性细胞系有Caco-2细胞,HeLa细胞等;Wahlang等[19]用1α,25-双羟维生素D3 诱导的 Caco-2 单层细胞模型来研究它的膜通透性和代谢,发现CYP3A4的抑制剂伊曲康唑和P-糖蛋白的抑制剂维拉帕米可提高目标化合物通透性,为增加该药的口服生物利用度提供了新的途径。而肝源性细胞系的生理功能与原代肝细胞更为相似,而且保留了部分药物代谢酶活性,所以较非肝源性细胞更常用于药物代谢。目前相关报道中常用的肝源性细胞系如下。
①HepG2是目前最常用的永生化肝癌细胞系,分离自高分化肝细胞肿瘤,就其各种肝性表型在分子和细胞水平的特点,也是了解得比较全面的细胞系。在标准培养条件下,HepG2的CYP表达水平非常低下,如CYP3A4的mRNA及代谢活性比原代肝细胞低2~3个数量级。但经过不同方式的优化后,这些分子表达水平有所提高,使HepG2成为广泛用于CYP3A4相关的药物代谢实验的最常用的体外细胞模型[20]。如 1,25-(OH)2D3,麝香保心丸及辣椒素等对CYP3A4表达的诱导作用[21-23];五味子提取物对 CYP3A4的抑制性研究[24]。
②HepaRG细胞分离自一例丙肝病毒阳性女性患者的肝癌组织,早期常用于乙肝病毒研究[25]。当接种密度低时,HepaRG细胞呈未分化的细长形态;加入二甲亚砜培养后随着细胞生长,细胞能逐渐分化,形成典型的条索状肝细胞样克隆。而且,与HepG2细胞相比,HepaRG细胞能表达一系列的CYP酶,如CYP3A4,CYP2B6及CYP2C9等。因此,HepaRG细胞被认为是原代肝细胞最理想的替代者,用于CYP3A4的药物诱导及抑制研究[26-27]。最近,有学者优化HepaRG的培养条件,用于药物代谢及毒性研究[28]。
③BC2细胞来源于一例男性患者的肝肿瘤组织,可以在体外生长同时分化,并能在几周内保持比较稳定的分化状态。分化后的细胞具有很强的蛋白、糖原及尿素的合成功能,表 达 一 系 列 的 CYP酶(CYP1A1/2,CYP2A6,CYP2B6,CYP2C9,CYP2E1及CYP3A4)及Ⅱ相代谢酶。同时,BC2细胞对CYP酶诱导剂敏感,如加入地塞米松刺激后,CYP3A4表达可提高5倍[29]。之后该研究组在BC2细胞群中,以P-糖蛋白高水平表达为标准,筛选出较BC2在药物转运和代谢酶方面表达水平高的亚细胞株[30]。
④Huh7细胞是另一种商业化并且被广泛应用的肝癌细胞系。Huh7细胞在体外增殖停止后,逐渐分化成熟。有学者通过基因芯片对分化成熟的细胞进行基因表达分析,发现P450酶,Ⅱ相代谢酶及相关的转录因子等表达明显增高。特别是CYP3A4的代谢活性达到了原代肝细胞的30%,并且能被利福平诱导及酮康唑抑制。同时,Huh7细胞经黄曲霉素B1处理后,可产生明显的CYP3A4依赖性细胞毒性[31]。因此,Hosomi等[32]用 Huh7 细胞研发了一个高敏感性的检测系统,研究药物CYP3A4依赖性的细胞毒性,有利于药物开发早期的药物筛选。
3 高表达CYP3A4的体外细胞模型建立及技术进展
为了获得一个准确可靠的药物研发体外细胞模型,随着对肝细胞药物代谢酶表达调控的深入了解和相关技术进步,不断尝试通过各种办法建立高表达CYP3A4的体外细胞模型。
3.1 永生化原代肝细胞
原代肝细胞保留了肝完整的功能,是研究药物代谢的金标准。然而,原代肝细胞在体外不能增殖,所以不能被广泛推广。学者们试图通过让原代肝细胞永生化,使其能在体外培养扩增。原代肝细胞永生化的方法主要是转染编码肿瘤病毒基因、原癌基因或端粒酶的质粒[33]。随着研究的进展,出现了杂交细胞,条件永生化肝细胞及从转基因动物分离的细胞系。但是,原代肝细胞永生化后,细胞表型发生改变,特别是CYP3A4表达低下,所以并不适合用于CYP3A4相关性药物代谢研究。
3.2 CYP3A4过表达体外细胞模型
肝源性细胞系普遍存在的主要问题是处于去分化或低分化状态,各类代谢酶表达水平低下或不全。因此,相关改造的核心目标集中在如何恢复和提高肝特征功能表型。另一种改造细胞的方法是,通过转染编码CYP3A4的质粒,在细胞系中过表达CYP3A4,提高细胞系在 CYP3A4相关性药物代谢的应用潜质。各种各样的非肝源性宿主细胞如细菌、酵母菌、昆虫细胞和哺乳动物细胞等,已经被成功改造。1991年,文献报道在B淋巴细胞样干细胞中成功表达[34]。1998年,Chen等[35]已成功在中国仓鼠肺细胞中表达CYP3A4,并用于黄曲霉素B1、环磷酰胺及杂色曲霉素的代谢研究。HepG2作为应用最广泛的肝癌细胞系,大量文献报道在HepG2中成功过表达CYP3A4,并用于CYP3A4相关的药物代谢及毒性研究[36-37]。
3.3 可诱导CYP3A4过表达体外细胞模型
随着对CYP3A4表达调控研究的深入,有学者认为CYP3A4在细胞系中表达降低是由CYP3A4相关的转录因子及辅助因子表达减少导致的。Nibourg等[38]比较了HepG2及原代肝细胞的转录因子表达,发现 C/EBP α mRNA只达到原代肝细胞的15%,HNF3α是25%,HNF1α是40%。有学者通过转染编码特异性转录因子(C/EBPα,HNF3γ,PXR)的质粒 ,成功在 HepG2提高了 CYP3A4的表达。Küblbeck等[39]改造出了一种嵌合转录因子,即在PXR及CAR末端加入一段很强的激活域,转染C3A细胞后增强了CYP3A4的表达,特别是利福平诱导后,CYP3A4 mRNA提高了约30倍。虽然在细胞中过表达相关转录因子可以增强CYP3A4的表达,但是仍然达不到原代肝细胞的表达水平。因为CYP3A4在细胞内的表达调控是一个多因子参与的复杂的调控网络,单个或若干个转录因子的表达提高,并不能使CYP3A4的表达恢复到正常水平,所以还需对CYP3A4表达调控做进一步的研究。
3.4 干细胞模型研究
尽管已有大量研究着力于提高CYP3A4的表达水平,但是至今仍无法获得理想的CYP3A4体外细胞模型,学者们开始寻求新的策略,如采用干细胞诱导分化的肝样细胞。干细胞具有多向分化及增殖功能,大量文献报道通过不同的方法成功诱导人胚胎干细胞分化成肝样细胞,并对其基因蛋白及功能进行了检测,发现肝样细胞表现出很多肝特异性的表型[40]。人诱导多能干细胞是一种从分化成熟体细胞逆向分化而来的干细胞,可以获取不同遗传背景人群的人诱导多能干细胞,从而建立特异性的体外肝样细胞模型进行肝毒性研究[41-42]。然而,干细胞诱导分化的肝样细胞表达CYP3A4水平较低,在药物代谢上受到一定限制,所以还有待进一步提高功能。再如,依据肝组织生理结构特点,结合生物材料和微加工技术等,构建模拟肝脏微环境的三维细胞培养体系,可以获得包括药物代谢酶在内的多种肝性特征表型远高于传统培养系统的肝细胞模型[43-45]。这些模型在药物代谢、毒理以及病理学的基础和应用研究方面都正在产生越来越重要的影响。
4 展望
生理性体外细胞模型在药物研发过程中具有重要应用价值,原代肝细胞模型仍然是其中金标准。很多研究正在逐渐对肝源性和非肝源性细胞系进行改造,使其中CYP酶的表达能力更接近于原代肝细胞水平。尤其是关于CYP3A4研究比较倾向于丰富和成熟。获得能够准确预测CYP3A4依赖性药物代谢的体外细胞模型是本领域的研究目标,为此,学者们尝试了各种方法,如改良培养条件;采用基因工程的办法在细胞系中过表达CYP3A4或相关调控因子;肝细胞永生化等。虽然不断进步,但目前尚都不能达此目标。干细胞研究,尤其是人胚胎干细胞及人诱导多能干细胞的迅速进展为CYP3A4依赖性模型的建立提供了新思路。现在已经可以通过各种办法使其向肝样细胞分化,并获得不同程度和水平的各种肝特异性的功能;但如何使各方面表型达到成熟水平,还是一个亟待解决的问题。新型生物工程学技术从构建模拟肝组织生理微环境的角度,显著提高了体外肝细胞模型的参考价值。将以上思路互相借鉴融合,有可能获得预测能力显著提高的CYP3A4药物代谢体外细胞模型。
[1]Khanna I.Drug discovery in pharmaceutical industry:productivity challenges and trends[J].Drug Discov Today,2012,17(19-20):1088-1102.
[2]Mullard A.2010 FDA drug approvals[J].Nat Rev Drug Discov,2011,10(2):82-85.
[3]Ghosh C,Marchi N,Desai NK,Puvenna V,Hossain M,Gonzalez-Martinez J,et al.Cellular localization and functional significance of CYP3A4 in the human epileptic brain[J].Epilepsia,2011,52(3):562-571.
[4]Feng Y,Mitchison TJ,Bender A,Young DW,Tallarico JA.Multiparameter phenotypic profiling:using cellular effects to characterize small-molecule compounds[J].Nat Rev Drug Discov,2009,8(7):567-578.
[5]Liddle C,Goodwin BJ,George J,Tapner M,Farrell GC.Separate and interactive regulation of cytochrome P450 3A4 by triiodothyronine,dexamethasone,and growth hormone in cultured hepatocytes[J].J Clin Endocrinol Metab,1998,83(7):2411-2416.
[6]Lamba J,Lamba V,Strom S,Venkataramanan R,Schuetz E.Novel single nucleotide polymorphisms in the promoter and intron 1 of human pregnane X receptor/NR1I2 and their association with CYP3A4 expression[J].Drug Metab Dispos,2008,36(1):169-181.
[7]Takagi S,Nakajima M,Mohri T,Yokoi T.Post-transcriptional regulation of human pregnane X receptor by micro-RNA affects the expression of cytochrome P450 3A4[J].J Biol Chem,2008,283(15):9674-9680.
[8]Toriyabe T,Nagata K,Takada T,Aratsu Y,Matsubara T,Yoshinari K,et al.Unveiling a new essential cis element for the transactivation of the CYP3A4 gene by xenobiotics[J].Mol Pharmacol,2009,75(3):677-684.
[9]Lamba V,Panetta JC,Strom S,Schuetz EG.Genetic predictors of interindividual variability in hepatic CYP3A4 expression[J].J Pharmacol Exp Ther,2010,332(3):1088-1099.
[10]Matsumura K,Saito T,Takahashi Y,Ozeki T,Kiyotani K,Fujieda M,et al.Identification of a novel polymorphic enhancer of the human CYP3A4 gene[J].Mol Pharmacol,2004,65(2):326-334.
[11]Ramji DP,Foka P.CCAAT/enhancer-binding proteins:structure,function and regulation[J].Biochem J,2002,365(Pt 3):561-575.
[12]Rodríguez-Antona C, Bort R, Jover R,Tindberg N,Ingelman-Sundberg M,Gómez-Lechón MJ,et al.Transcriptional regulation of human CYP3A4 basal expression by CCAAT enhancer-binding protein alpha and hepatocyte nuclear factor-3 gamma[J].Mol Pharmacol,2003,63(5):1180-1189.
[13]Martínez-Jiménez CP, Gómez-Lechón MJ, Castell JV,Jover R.Transcriptional regulation of the human hepatic CYP3A4:identification of a new distal enhancer region responsive to CCAAT/enhancer-binding protein beta isoforms(liver activating protein and liver inhibitory protein)[J].Mol Pharmacol,2005,67(6):2088-2101.
[14]Pan YZ,Gao W,Yu AM.MicroRNAs regulate CYP3A4 expression via direct and indirect targeting[J].Drug Metab Dispos,2009,37(10):2112-2117.
[15]Wang Y,Liao M,Hoe N,Acharya P,Deng C,Krutchinsky AN,et al.A role for protein phosphorylation in cytochrome P450 3A4 ubiquitin-dependent proteasomal degradation[J].J Biol Chem,2009,284(9):5671-5684.
[16]LeCluyse EL. Human hepatocyte culture systems for the in vitro evaluation of cytochrome P450 expression and regulation[J].Eur J Pharm Sci,2001,13(4):343-368.
[17]Li AP,Doshi U.Higher throughput human hepatocyte assays for the evaluation of time-dependent inhibition of CYP3A4[J].Drug Metab Lett,2011,5(3):183-191.
[18]Martignoni M,Groothuis GM,de Kanter R.Species differences between mouse,rat,dog,monkey and human CYP-mediated drug metabolism,inhibition and induction[J].Expert Opin Drug Metab Toxicol,2006,2(6):875-894.
[19]Wahlang B,Pawar YB,Bansal AK.Identification of permeability-related hurdles in oral delivery of curcumin using the Caco-2 cell model[J].Eur J Pharm Biopharm,2011,77(2):275-282.
[20]Yoshitomi S,Ikemoto K,Takahashi J,Miki H,Namba M,Asahi S.Establishment of the transformants expressing human cytochrome P450 subtypes in HepG2,and their applications on drug metabolism and toxicology[J].Toxicol In Vitro,2001,15(3):245-256.
[21]Li S,Miao XH.Induction of CYP3A4 by 1alpha,25-dihydroxyvitamin D3 in HepG2 cells[J].Chin J Hepatol(中华肝脏病杂志),2008,16(3):220-223.
[22]Jiang B,Cai F,Gao S,Meng L,Liang F,Dai X,et al.Induction of cytochrome P450 3A by Shexiang Baoxin Pill and its main components[J].Chem Biol Interact,2012,195(2):105-113.
[23]Han EH,Kim HG,Choi JH,Jang YJ,Lee SS,Kwon KI,et al.Capsaicin induces CYP3A4 expression via pregnane X receptor and CCAAT/enhancer-binding protein β activation[J].Mol Nutr Food Res,2012,56(5):797-809.
[24]Wan CK,Tse AK,Yu ZL,Zhu GY,Wang H,Fong DW.Inhibition of cytochrome P450 3A4 activity by schisandrol A and gomisin A isolated from Fructus Schisandrae Chinensis[J].Phytomedicine,2010,17(8-9):702-705.
[25]Gripon P, Rumin S, Urban S, Le Seyec J,Glaise D,Cannie I,et al.Infection of a human hepatoma cell line by hepatitis B virus[J].Proc Natl Acad Sci USA,2002,99(24):15655-15660.
[26]Kaneko A,Kato M,Sekiguchi N,Mitsui T,Takeda K,Aso Y.In vitro model for the prediction of clinical CYP3A4 induction using HepaRG cells[J].Xenobiotica,2009,39(11):803-810.
[27]McGinnity DF, Zhang G, Kenny JR, Hamilton GA,Otmani S,Stams KR,et al.Evaluation of multiple in vitro systems for assessment of CYP3A4 induction in drug discovery:human hepatocytes,pregnane X receptor reporter gene,and Fa2N-4 and HepaRG cells[J].Drug Metab Dispos,2009,37(6):1259-1268.
[28]Anthérieu S,Chesné C,Li R,Guguen-Guillouzo C,Guillouzo A.Optimization of the HepaRG cell model for drug metabolism and toxicity studies[J].Toxicol In Vitro,2012,26(8):1278-1285.
[29]Gómez-Lechón MJ,Donato T,Jover R,Rodriguez C,Ponsoda X,Glaise D,et al.Expression and induction of a large set of drug-metabolizing enzymes by the highly differentiated human hepatoma cell line BC2[J].Eur J Biochem,2001,268(5):1448-1459.
[30]O'Connor JE,Martínez A,Castell JV,Gómez-Lechón MJ.Multiparametric characterization by flow cytometry of flow-sorted subpopulations of a human hepatoma cell line useful for drug research[J].Cytometry A,2005,63(1):48-58.
[31]Sivertsson L,Ek M,Darnell M,Edebert I,Ingelman-Sundberg M,Neve EP.CYP3A4 catalytic activity is induced in confluent Huh7 hepatoma cells[J].Drug Metab Dispos,2010,38(6):995-1002.
[32]Hosomi H,Fukami T,Iwamura A,Nakajima M,Yokoi T.Development of a highly sensitive cytotoxicity assay system for CYP3A4-mediated metabolic activation[J].Drug Metab Dispos,2011,39(8):1388-1395.
[33]Maruyama M,Kobayashi N,Westerman KA,Sakaguchi M,Allain JE,Totsugawa T,et al.Establishment of a highly differentiated immortalized human cholangiocyte cell line with SV40T and hTERT[J].Transplantation,2004,77(3):446-451.
[34]Crespi CL,Penman BW,Steimel DT,Gelboin HV,Gonzalez FJ.The development of a human cell line stably expressing human CYP3A4:role in the metabolic activation of aflatoxin B1 and comparison to CYP1A2 and CYP2A3[J].Carcinogenesis,1991,12(2):355-359.
[35]Chen Q,Wu J,Yu Y.Establishment of transgenic cell line CHL-3A4 and its metabolic activation[J].Chin J Prev Med(中华预防医学杂志),1998,32(5):281-284.
[36]Tolosa L, Donato MT, Pérez-Cataldo G, Castell JV, Gómez-Lechón MJ.Upgrading cytochrome P450 activity in HepG2 cells cotransfected with adenoviral vectors for drug hepatotoxicity assessment[J].Toxicol In Vitro,2012,26(8):1272-1277.
[37]Aoyama K,Yoshinari K,Kim HJ,Nagata K,Yamazoe Y.Simultaneous expression of plural forms of human cytochrome P450 at desired ratios in HepG2 cells:adenovirus-mediated tool for cytochrome P450 reconstitution[J].Drug Metab Pharmacokinet,2009,24(3):209-217.
[38]Nibourg GA, Huisman MT, van der Hoeven TV,van Gulik TM,Chamuleau RA,Hoekstra R.Stable overexpression of pregnane X receptor in HepG2 cells increases its potential for bioartificial liver application[J].Liver Transplant,2010,16(9):1075-1085.
[39]Küblbeck J,Reinisalo M,Mustonen R,Honkakoski P.Up-regulation of CYP expression in hepatoma cells stably transfected by chimeric nuclear receptors[J].Eur J Pharm Sci,2010,40(4):263-272.
[40]Brolén G,Sivertsson L,Björquist P,Eriksson G,Ek M,Semb H,et al.Hepatocyte-like cells derived from human embryonic stem cells specifically via definitive endoderm and a progenitor stage[J].J Biotechnol,2010,145(3):284-294.
[41]Rashid ST,Corbineau S,Hannan N,Marciniak SJ,Miranda E,Alexander G,et al.Modeling inherited metabolic disorders of the liver using human induced pluripotent stem cells[J].J Clin Invest,2010,120(9):3127-3136.
[42]Ghodsizadeh A, Taei A, Totonchi M, Seifinejad A,Gourabi H,Pournasr B,et al.Generation of liver disease-specific induced pluripotent stem cells along with efficient differentiation to functional hepatocyte-like cells[J].Stem Cell Rev,2010,6(4):622-632.
[43]Toh YC,Lim TC,Tai D,Xiao G,van Noort D,Yu H.A microfluidic 3D hepatocyte chip for drug toxicity testing[J].Lab Chip,2009,9(14):2026-2035.
[44]Ploss A,Khetani SR,Jones CT,Syder AJ,Trehan K,Gaysinskaya VA,et al.Persistent hepatitis C virus infection in microscale primary human hepatocyte cultures[J].Proc Natl Acad Sci USA,2010,107(7):3141-3145.
[45]Wang Y,Toh YC,Li Q,Nugraha B,Zheng B,Lu TB,et al.Mechanical compaction directly modulates the dynamics of bile canaliculi formation[J].Integr Biol(CAMB),2013,5(2):390-401.

