吡格列酮治疗2型糖尿病早期肾病的临床研究
浦英杰 (江苏省无锡市藕塘社区卫生服务中心,江苏 无锡 214153)
糖尿病性肾病是糖尿病最常见的微血管并发症之一,高血糖、高胰岛素血症在其发生、发展中起着重要作用[1]。新近研究表明噻唑烷二酮类胰岛素增敏剂不仅具有降糖、调脂及改善胰岛素抵抗的作用[2],还可以延缓糖尿病肾病的进展[3]。本研究旨在观察盐酸吡格列酮治疗2型糖尿病早期DN的疗效,并对血浆内皮素(ET)、血清一氧化氮(NO)水平进行了测定,以探讨其作用机制。
1 资料与方法
1.1 一般资料:2型糖尿病患者47例,诊断均符合1999年WHO糖尿病诊断标准,同时近1个月内均伴有连续3次24 h尿白蛋白排泄率(UAER)为30~300 mg/24 h,肾功能正常(血肌酐≤133 μmol/L,尿素氮≤7.1 mmol/L),血压稳定(140~160 mm Hg/85~100 mm Hg)(1 mm Hg=0.1333 kPa),无酮症酸中毒、高渗性昏迷、失代偿性心功能衰竭(NYHA·Ⅳ)、严重感染及肝功能不全(谷丙转氨酶大于正常值上限2倍以上)及近期服用肾毒性药物史。所有患者随机分为两组:治疗组24例,男13例,女11例,平均年龄(56.9±11.2)岁,平均病程(8.1±4.6)年;对照组23例,男11例,女12例,平均年龄(52.6±9.1)岁,平均病程(7.9±5.1)年。两组性别、年龄和病程均具有可比性。
1.2 研究方法:所有患者均给予糖尿病饮食控制和运动治疗,对照组给予门冬胰岛素30治疗,治疗组在对照组基础上加用盐酸吡格列酮(30 mg/片,江苏德源药业有限公司生产),30 mg/d,晨起空腹服用,疗程6个月,每2周随诊一次,根据血糖调整胰岛素剂量。血糖控制目标:空腹血糖:4.4~7.0 mmol/L,餐后2 h:4.4~10.0 mmol/L。治疗期间不用抗血小板、抗凝、扩血管、降脂及血管紧张素转换酶抑制剂(ACEI)等药物。治疗前后取静脉血测定空腹血糖(FPG)、餐后2 h血糖(2hPG)、HBA1C、血脂[三酰甘油(TG)、总胆固醇(TC)、低密度胆固醇(LDL-C)、高密度胆固醇(HDL-C)]、肝肾功能、空腹血胰岛素(放射免疫法)、ET-1(放射免疫法)、NO(硝酸还原酶法,以NO-2/NO-3值代表NO水平)。收集24 h尿测定UAER(放射免疫法)。用稳态模型(Homa)计算胰岛β细胞功能[(Homaβ=20×FINS/FPG-3.5)]和胰岛素抵抗(HomaIR=FBG×FINS/22.5)。
2 结果
2.1 两组治疗前后血糖、血脂的变化:与治疗前比较,两组治疗后FPG、2hPG、HBA1C均有下降(P<0.01),治疗组 TG、TC、LDL-C、HDL-C治疗后与治疗前比较,HDL-C升高,其余各项下降,差异有统计学意义(P<0.05)。对照组治疗前后血脂水平无明显变化(P>0.05)。见表1。
2.2 两组治疗前后 UAER、Homaβ、HomaIR、ET -1、NO 的变化:与治疗前比较,治疗组HomaIR和ET-1水平较治疗前显著下降(P<0.01),Homaβ、NO明显升高(P<0.01);对照组Homaβ、HomaIR、ET -1、NO 水平治疗前后比较无明显变化(P>0.05)。见表2。
表1 两组治疗前后血糖、血脂的变化()
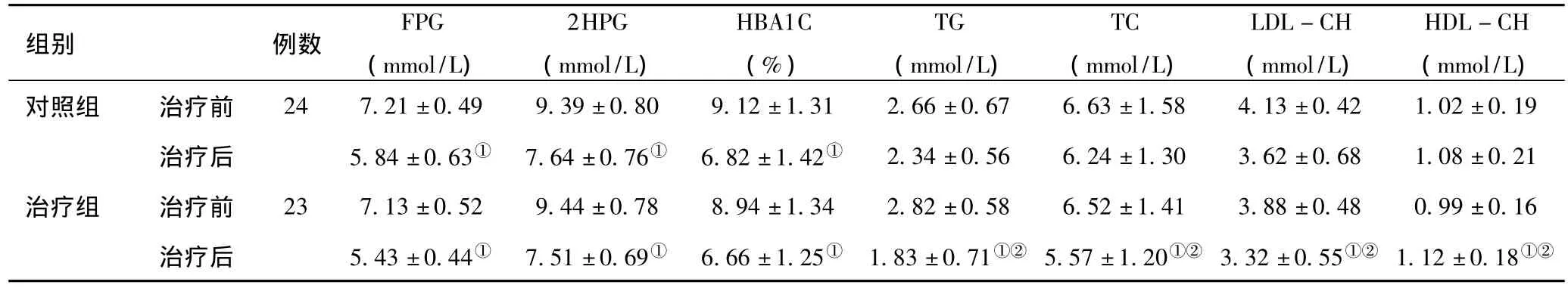
表1 两组治疗前后血糖、血脂的变化()
注:与治疗前比较,①P﹤0.01;与对照组比较,②P﹤0.05
组别 例数FPG(mmol/L)2HPG(mmol/L)HBA1C(%)TG(mmol/L)TC(mmol/L)LDL-CH(mmol/L)HDL-CH(mmol/L)对照组 治疗前 24 7.21±0.49 9.39±0.80 9.12±1.31 2.66±0.67 6.63±1.58 4.13±0.42 1.02±0.19治疗后 5.84±0.63① 7.64±0.76① 6.82±1.42① 2.34±0.56 6.24±1.30 3.62±0.68 1.08±0.21治疗组 治疗前 23 7.13±0.52 9.44±0.78 8.94±1.34 2.82±0.58 6.52±1.41 3.88±0.48 0.99±0.16治疗后 5.43±0.44① 7.51±0.69① 6.66±1.25① 1.83±0.71①② 5.57±1.20①② 3.32±0.55①② 1.12±0.18①②
表2 两组治疗前后 UAER、Homaβ、HomaIR、ET -1、NO、的变化()
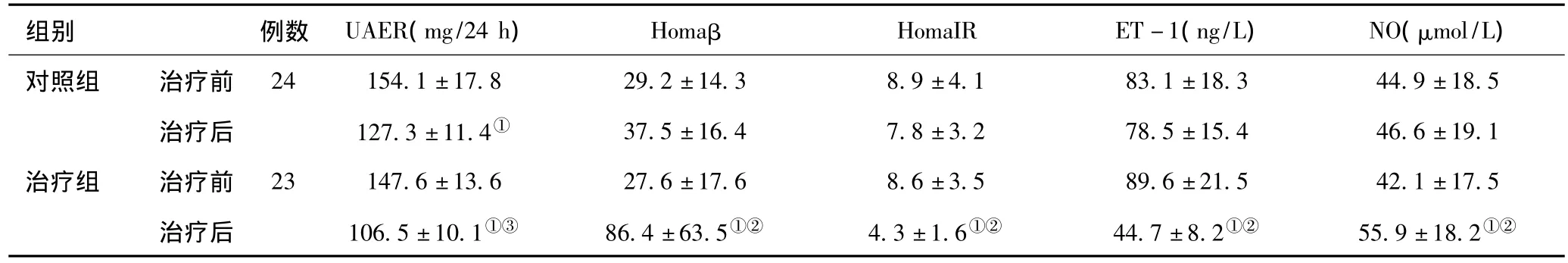
表2 两组治疗前后 UAER、Homaβ、HomaIR、ET -1、NO、的变化()
注:与治疗前比较,①P﹤0.01;与对照组比较,②P﹤0.01,③P﹤0.05
组别 例数 UAER(mg/24 h) Homaβ HomaIR ET-1(ng/L) NO(μmol/L)对照组 治疗前 24 154.1±17.8 29.2±14.3 8.9±4.1 83.1±18.3 44.9±18.5治疗后 127.3±11.4① 37.5±16.4 7.8±3.2 78.5±15.4 46.6±19.1治疗组 治疗前 23 147.6±13.6 27.6±17.6 8.6±3.5 89.6±21.5 42.1±17.5治疗后 106.5±10.1①③ 86.4±63.5①② 4.3±1.6①② 44.7±8.2①② 55.9±18.2①②
3 讨论
糖尿病肾病是糖尿病最常见的并发症之一,其发病机制尚未阐明。近年来研究表明高血糖、高胰岛素血症在其发生发展中起着重要作用。持续性的高血糖能促进蛋白质非酶促糖化、蛋白激酶C激活、多元醇通路激活、炎性反应介质产生增多及抗氧化体系的功能损害等,致使氧化应激加强;高胰岛素血症是胰岛素抵抗的标志,同时存在的胰岛素抵抗和血浆中氧自由基浓度呈正相关,后者能促进蛋白质和脂质氧化修饰,使蛋白质变性和酶活性丧失,影响受体和膜离子通道。还可激活磷脂酶A2,加重炎性反应,促进病变发展。而脂质过氧化是动脉粥样硬化的重要发病机制。血管内皮对自由基十分敏感,氧自由基能抑制内皮细胞增殖,激活NF-KB核转录因子,加强白细胞-内皮细胞相互作用而促进血管内皮功能损伤的发生和发展。血管内皮功能损伤导致NO的合成与释放减少,活性下降;进而引起ET-1合成和释放增加。两者失衡可引起肾脏血管的强烈收缩,减少肾血流量,促进血管平滑肌细胞和肾小球系膜细胞增生,刺激胶原合成增加,肾小球基底膜增厚,促进蛋白尿生成[4]。严格控制血糖能有效地延缓DN的发生和发展。
吡格列酮是噻唑烷二酮类降糖药物,具有降低血糖、调节血脂,减轻胰岛β细胞的负担,保护胰岛功能的作用。新近表明吡格列酮可通过降低血清炎性细胞因子[3]及尿Nephrin排泄[5]、抑制血小板功能而改善血流动力学等途径直接发挥肾保护作用[6]。本研究结果也证实吡格列酮具有降低血糖、调节血脂、改善胰岛β细胞功能,并能降低糖尿病患者24 h尿微量白蛋白。进一步研究显示吡格列酮治疗6个月后患者血清ET下降,NO水平升高,而ET-1、NO的异常在一定程度上可作为反映血管内皮细胞功能的指标,提示吡格列酮可改善DN患者的血管内皮功能,达到降低蛋白尿的作用。治疗期间未发生不良反应,安全性好,值得临床上推广应用。
[1]Paolisso G,Giugliano D.Oxidative stress and insulin:is there a relationship[J]?Diabetologia,1996,39(3):357.
[2]Viberti G,Kahn SE,Greene Da,et al.A diabetes outcome progression tril(ADOPT):An international multicenter study of the comparative rosiglitzone,glyburide,and metformin in recently diagnosed type 2 diabetes[J].Diabeeetes Care,2002,25(10):1737.
[3]杨玉萍.盐酸比格列酮治疗糖尿病肾病减少微量蛋白尿的临床应用[J]. 吉林医学,2011,32(13):2591.
[4]何明蕊,孙珉丹.糖尿病 肾病 的发病机制研究进展[J]. 吉林医学,2010,31(35):6546.
[5]赵俐丽,叶山东,陈 燕,等.吡格列酮对2型糖尿病患者尿Nephrin排泄的影响[J].中国糖尿病杂志,2010,18(12):901.
[6]吴凤珍,郑 茂,赵俐丽,等.吡格列酮对2型糖尿病患者尿单核细胞趋化蛋白1排泄的影影响[J].中国糖尿病杂,2010,18(11):843.

