厌氧氨氧化颗粒反应器的快速启动研究
李 媛 , 阮文权 *, 任洪艳
(1.江南大学 环境与土木工程学院,江苏 无锡 214122;2.江南大学 工业生物技术教育部重点实验室,江苏 无锡214122)
传统的废水处理工艺均以有机物的去除为其目标,在设计中一般不考虑对氮的去除问题,往往使得处理出水中的氨氮难以达到排放标准。废水中氮污染的加剧引起了研究者的广泛关注,与物理化学脱氮法相比,生物脱氮技术具有高效、低能耗的优点[1-2]。而传统的硝化反硝化技术,存在需要充氧,外加碳源,需中和等弊端。近年来,研究发现[3-4]的厌 氧 氨 氧 化 (ANaerobic Ammonium Oxidation,ANAMMOX)被认为目前最经济的生物脱氮途径之一,即在厌氧条件下,以氨氮为电子供体,亚硝酸盐氮为电子受体实现氮的去除[3-4]。
厌氧氨氧化反应器的快速启动和厌氧氨氧化菌的高效富集成为研究重点和热点[5-9],但是由于厌氧氨氧化菌的倍增时间长[10],污泥产率系数低,活性易受到分子氧的抑制,限制了其推广应用。作者采用选择压原理,旨在通过逐步缩短水力停留时间(HRT)、提高有机负荷所形成的选择筛选过程使低于临界沉降速率的细小、分散污泥洗出[11],从而得到厌氧氨氧化菌的富集。另外,在菌种保藏方面,研究者通过冷冻方法[12]、冷冻和饥饿状态[13]对污泥进行保存,试验采取常温放置的厌氧氨氧化颗粒污泥为种泥,旨在得出厌氧氨氧化菌不需特殊保存,在常温放置亦可短时间恢复活性。
1 材料与方法
1.1 试验装置及材料
采用如图1所示的UASB实验装置,由玻璃制成,有效容积为11 L,其中反应区容积为7.7 L,沉淀区容积为4.3 L。反应器外裹黑布,以防止光氧化菌的影响。通过恒温水浴系统控制反应区温度为(33±1)℃,进水pH 用NaHCO3控制在 7.5左右。 模拟废水由蠕动泵经反应器底部的布水系统进入反应器,气、泥、水混合液通过设在反应器顶部的三相分离器分离,出水由溢流堰排出。
1.2 试验用水及接种污泥
试验采用模拟废水,配水成份如下:KH2PO410 mg/L,CaCl2·2H2O 5.6 mg/L,MgSO4·7H2O 300 mg/L,KHCO31 250 mg/L,微量元素浓缩液[14]各 1.25 mL,微量元素Ⅰ(g/L):EDTA 5.000,FeSO45.000;微量元素Ⅱ (g/L):MnCl2·4H2O 0.990,CuSO4·5H2O 0.250,EDTA 15.000,H3BO40.014,ZnSO4·7H2O 0.430,NiCl2·6H2O 0.190,NaMoO4·2H2O 0.220,NaSeO4·10H2O 0.210;底物NH4+-N及NO2--N用NH4Cl和NaNO2提供,浓度按需配制。
接种污泥为常温放置2年的厌氧氨氧化颗粒污泥。 其 MLSS约为 10 g/L,MLVSS为 6.78 g/L,MLVSS/MLSS为 0.68。
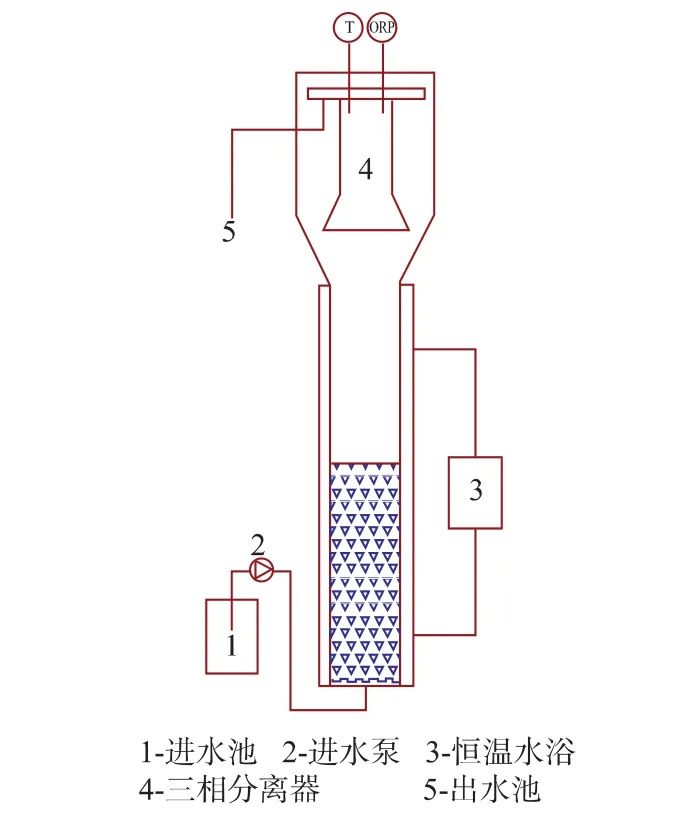
图1 厌氧氨氧化反应器示意图Fig.1 Schematic diagram of anammox reactor
1.3 测定项目和分析方法
NH4+-N采用纳氏试剂法;NO2--N采用N-(1-萘基)-乙二胺光度法;NO3--N采用紫外分光光度法;pH用pHS-9V型酸度计;MLSS和MLVSS采用重量法。以上所有方法均参照国家环保总局《水和废水监测分析方法》第四版。
2 结果与讨论
试验通过缩短水力停留时间(HRT)、提高有机负荷的选择筛选过程使低于临界沉降速率的细小、分散污泥洗出,从而得到厌氧氨氧化菌的富集,包括污泥活化阶段与培养阶段。由于接种污泥常温保藏,初期采用表1所示Ⅰ阶段对其进行活化(数据未进行监测)。培养阶段通过HRT的缩短(12 h缩短到4 h)来促进厌氧氨氧化菌的富集,并考察了此阶段反应器运行效能及污泥特性。培养阶段根据反应器的运行效能又可分为启动阶段(Ⅱ-Ⅲ)和富集阶段(Ⅳ-Ⅴ)。
2.1 反应器运行效能
2.1.1 氨氮、亚硝酸盐的去除效能 经过14 d的活化阶段,反应器中污泥颜色由黑色转为棕黄色,说明厌氧氨氧化菌活性的快速恢复。由图2、图3可知,此时,反应器中污泥对氨氮和亚硝酸盐氮已有10%左右的去除率。第18 d由于添加COD(100 mg/L)的缘故,反应器内异养菌生长快于自养菌生长,污泥变黑,反硝化作用引起亚硝酸盐氮的去除率高达90%,之后,进水不添加COD,COD对反应器的影响可在2天恢复,可见,反应器具有较好的抗冲击负荷能力。
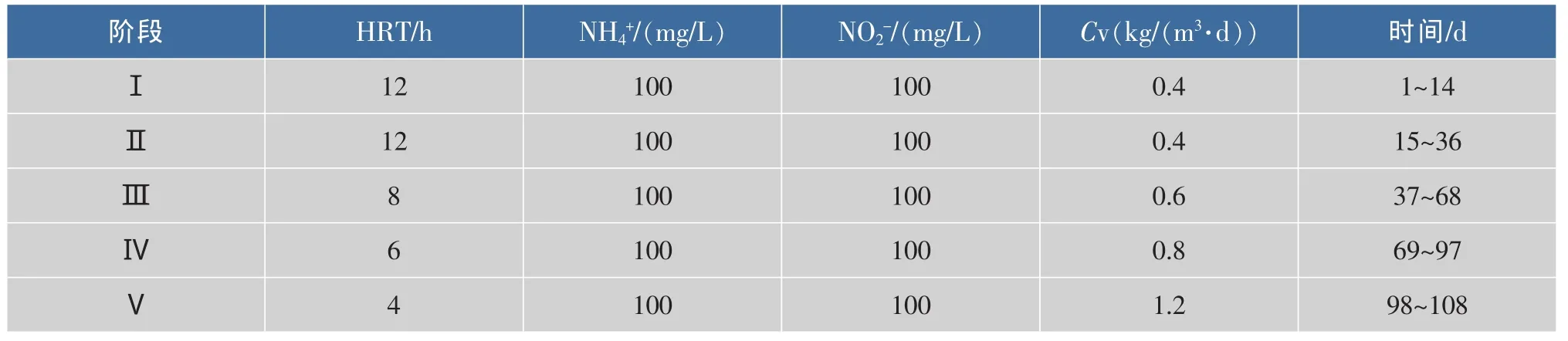
表1 反应器各阶段运行参数表Table 1 Operational parameters of reactor during different periods
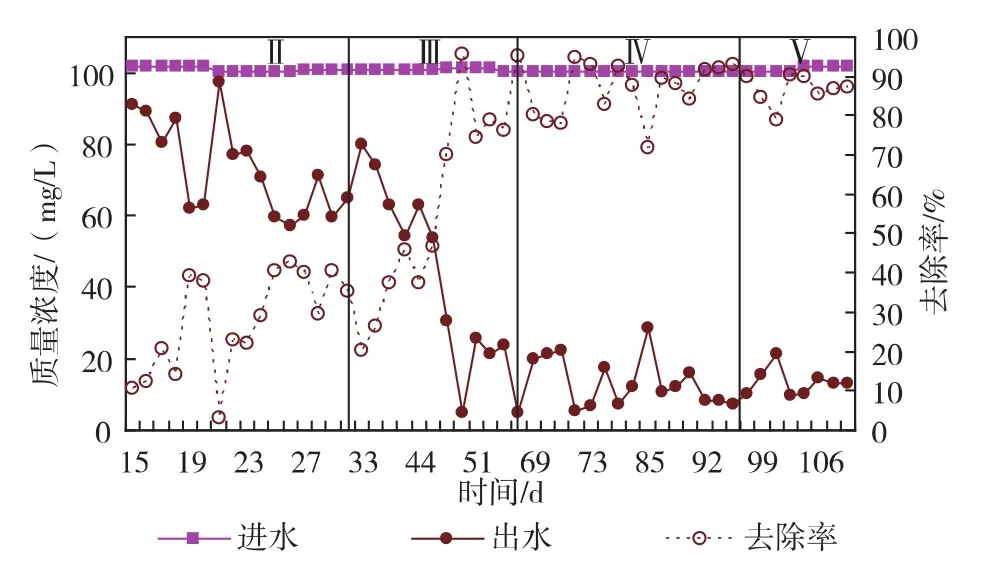
图2 运行期间氨氮变化曲线Fig.2 Variation of ammonium nitrogen during operation time
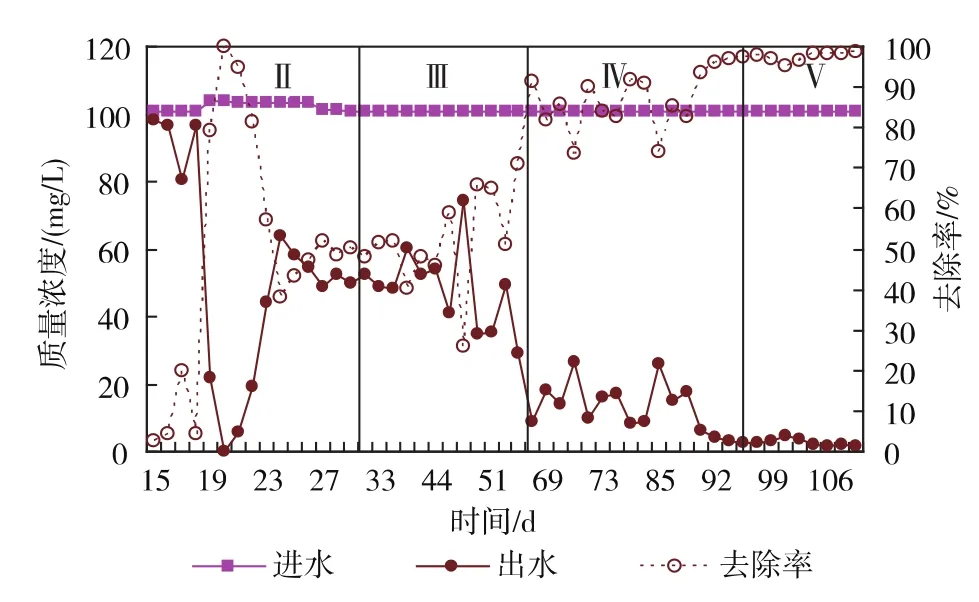
图3 运行期间亚硝酸盐氮变化曲线Fig.3 Variation of nitrite nitrogen during operation time
随着HRT从12 h缩短到8 h,由图2,3可见,氨氮和亚硝酸盐氮的去除率逐渐上升,第Ⅲ阶段末期(第68天),均可达90%,认为反应器成功启动。
在富集培养阶段,随着HRT的不断缩短,反应器内上升流速从20 cm/h上升到30 cm/h,加速泥水充分混合,增大反应器有效容积,反应器有明显的产气现象。在此阶段,氨氮去除率稳定高效,达90%,亚硝酸盐氮的去除率亦高达99%。同时,从厌氧氨氧化反应的化学计量式可知,反应亚硝酸氮与氨氮消耗比大于1,说明厌氧氨氧化反应器启动成功。
2.1.2 氮负荷的去除效能 从图4可知,运行期间,随着HRT缩短,进水氨氮和亚硝酸盐氮分别控制在 100 mg/L,总氮的进水负荷从 0.4 kg/(m3·d)逐步上升到 1.2 kg/(m3·d),总氮去除负荷呈现稳步上升,高达85%,说明厌氧氨氧化菌的不断富集。同时反应器对氨氮和亚硝酸盐的去除负荷相近,在富集培养阶段分别可达 0.38 kg NH4+-N/(m3·d)和 0.57 kg NO2--N/(m3·d)。
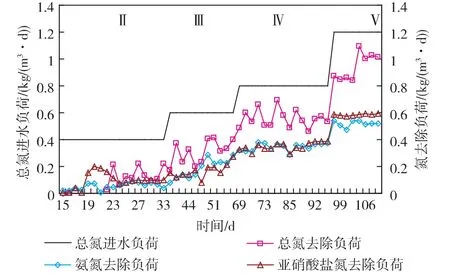
图4 运行期间氮负荷变化曲线Fig.4 Variation of nitrogen loading rate during operation time
2.1.3 亚硝酸盐氮去除、硝酸盐氮生成与氨氮去除比例 在启动阶段,亚硝酸盐氮去除与氨氮去除比、硝酸盐氮生成与氨氮去除比波动较大,一方面因为初期厌氧氨氧化菌活性较低,另一方面可能反应器中厌氧氨氧化菌与其他菌共存。通过水力条件的筛选,由图5可知,在富集阶段,氨氮去除、亚硝酸盐氮去除与硝酸盐氮的生成比为NH4+-N∶NO2--N∶NO3--N=1∶1.08∶0.26。 其中,硝酸盐氮生成与氨氮去除比接近理论值(0.26),而亚硝酸盐氮去除与氨氮去除比与理论值(1.32)有所偏差,这是因为反应器未进行严格厌氧,水中的溶解氧导致氨氮去除量的增加。由于进水基质、操作条件和反应器构型的原因,不同厌氧氨氧化反应器所得出的NO2--N与NH4+-N计量摩尔比波动范围在0.5-4.0[15]。
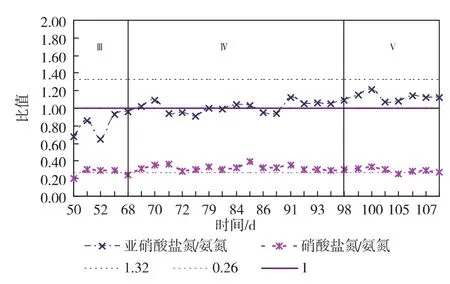
图5 运行期间亚硝酸氮去除、硝酸盐生成与氨氮比例变化曲线Fig.5 Nitrite removaland nitrate production vs.ammonium removal during operating time
2.2 污泥特性研究
反应器接种的颗粒污泥为图6(a)所示,由于未采用任何保藏措施,颗粒污泥外观成黑色,粒径以1~3 mm居多,并未发生解体现象。厌氧氨氧化活性可以快速恢复,在第30 d,即HRT12 h时,颗粒污泥颜色由黑色变为图6(b)所示的红棕色,这是厌氧氨氧化菌体内丰富的细胞色素C引起的[16-17],而颗粒粒径未发生明显变化,图6(c)为反应器中颗粒污泥照片。
同时,结合图2、图3中第Ⅱ阶段末期及第Ⅲ阶段初期反应器对氮的去除效果,可知,在此阶段,伴随着氮负荷的上升,反应器中厌氧氨氧化颗粒污泥正在不断形成与富集,氮的去除效率不断提高,外观表现为颗粒污泥颜色的改变。
颗粒污泥较好的沉降性能,可以在反应器内截留高的生物量,这是保持厌氧反应器高效的重要原因。对反应器中形成的厌氧氨氧化颗粒污泥沉降速度进行测定,如表2所示。颗粒污泥的沉降速度随着粒径的增大而增大。颗粒粒径范围在1~5 mm左右,沉降速度在20~78 m/h。平均粒径0.3~1.3 mm的厌氧颗粒污泥沉降速度在13~53 m/h,可见,厌氧颗粒污泥的密度大,结构密实,同一粒径的颗粒污泥,沉降速度大于厌氧氨氧化颗粒污泥。这是因为,厌氧氨氧化颗粒污泥表面及内部存在气孔,将产生的氮气排出,造成其比重较小。

图6 不同时期颗粒污泥照片Fig.6 Photos of granular during different operation
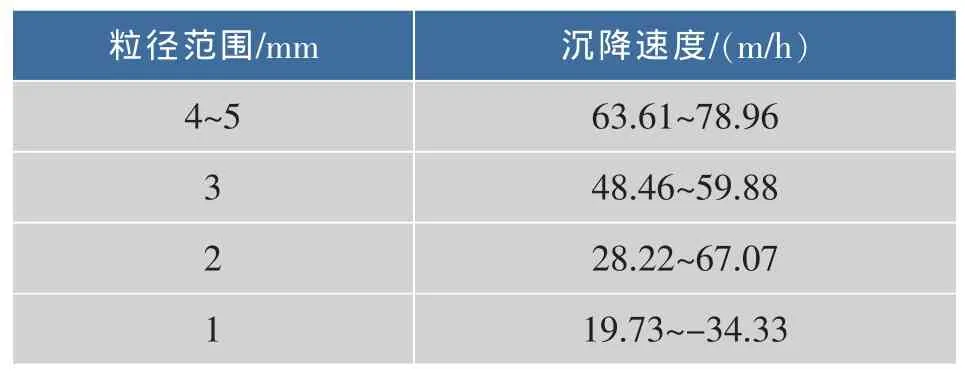
表2 颗粒污泥沉降速度表Table 2 Settling velocity of anmmox granular
3 结语
1)接种常温放置的厌氧氨氧化颗粒污泥,以人工配水为原水,在33~35℃条件下,通过缩短水力停留时间的方式,经过68 d的运行,可成功启动厌氧氨氧化反应器。
2)反应器运行30 d,颗粒污泥颜色由黑色变为红棕色。所形成颗粒污泥具有极好的沉降性能,沉降速度达 20~78 m/h。
3)反应器运行稳定高效,在水力停留时间为4 h、 有机负荷为 1.2 kg/(m3·d)的条件下,NH4+-N 和NO2--N的去除率分别达90%、99%。氨氮、亚硝酸盐氮消耗量与硝酸盐氮生成量之比为1∶1.08∶0.26。
[1]Pongsak N,Siriporn S,et al.Anaerobic ammonium oxidation by Nitrosomonas spp.And anammox bacteria in a sequencing batch reactor[J].Journal of Environmental Management,2009,90:967-972.
[2]Nutchanat C,Suwanchai N.Anammox enrichment from different conventional sludges[J].Chemosphere,2007,66:2225-2232.
[3]Bock E,Schmidt I,Stuven R,Zart D.Nitrogen loss caused by denitrifying Nitrosomonas cells using ammonium or hydrogen as electron donors and nitrite as electron acceptor[J].Arch Microbiol,1995,163:16-20.
[4]Strous M,Gerven E V,Kuenen J G,et al.Effects of aerobic and microaerobic conditions on anaerobic ammonium-oxidizing(anammox)sludge[J].Appl Environ Microbiol 1997,63:2446-2448.
[5]解庆林,李小霞,李艳红,等.基于ASBR反应器的厌氧氨氧化启动及特性研究[J].环境科学学报,2009,29(4):759-763.XIE Qing-lin,LI Xiao-xia,LI Yan-hong,et al.Start up of an anaerobic ammonium oxidation process in an anaerobic sequencing batch reactor[J].Acta scientiae circumstantiae,2009,29(4):759-763.(in Chinese)
[6]陈胜,孙德智,遇光禄.填充床快速启动厌氧氨氧化反应器及其脱氮性能研究[J].环境科学,2010,31(3):691-696.CHEN Sheng,SUN De-zhi,YU Guang-lu.Rapid startup and nitrogen removal characteristic of anaerobic ammonium oxidation reactor in packed bed biofilm reactor with suspended carrier[J].Environmental Science,2010,31(3):691-696.(in Chinese)
[7]唐崇俭,郑平,陈建伟.流加菌种对厌氧氨氧化工艺的影响[J].生物工程学报,2011,27(1):1-8.TANG Chong-jian,ZHENG Ping,CHEN Jian-wei.Effect of sequential biocatalyst addition on Anammox process[J].Chinese Journal of Biotechnology,2011,27(1):1-8.(in Chinese)
[8]路青,华兆哲,李秀芬,等.MBR中厌氧氨氧化运行特性及微生态结构[J].食品与生物技术学报,2010,29(4):581-588.LU Qing,HUA Zhao-zhe,LI Xiu-fen,et al.Operation characterictics and microbial community distribution of Anammox in a membrane bioreactor[J].Journal of Food Science and Biotechnology,2010,29(4):581-588.(in Chinese)
[9]周少奇,姚俊芹.UASB厌氧氨氧化反应器启动研究[J].食品与生物技术学报,2005,24(6):1-5.ZHOU Shao-qi,YAO Jun-qin.Start up of anaerobic ammonium oxidation reaction in UASB bioreactor[J].Journal of Food Science and Biotechnology,2005,24(6):1-5.(in Chinese)
[10]Schmidt I,Sliekers O.New concepts of microbial treatment processes for the nitrogen removal in wastewater[J].FEMS Microbiol,2003,27:481-492.
[11]王强,陈坚,堵国成.选择压法培育好氧颗粒污泥的试验[J].环境科学,2003,24(4):99-104.WANG Qiang,CHEN Jian,DU Guo-cheng.Studies on aerobic granular sludge cultivated under selective pressure[J].Environmental Science,2003,24(4):99-104.(in Chinese)
[12]Vogel Sang C,Goli Embiewski K,Ostgaard K.Effect of preservation techniques on the regeneration of gel entrapped nitrifying sludge[J].Water Res,1999,33(1):164-168.
[13]Laurin V,Labbe V,Juteau P,et al.Long-term storage conditions for carriers with denitrifying biomass of the fluidzed.Methanolfed denitrification reactor of the Montreal Biodome,and the impact on denitrifying activity and bacterial popuIation[J].Water Res,2006,40(9):1836-1840.
[14]WANG T,ZHANG H M,YANG F L,et al.Start-up of the Anammox process from the conventional activated sludge in a membrane bioreactor[J].Bioresource Technology,2009,100:2501-2506.
[15]AHN Y H.Sustainable nitrogen elimination biotechnologies:a review[J].Process Biochem,2006,41:1709-1721.
[16]赵志宏.厌氧氨氧化微生物颗粒化的启动研究及因素分析[D].长沙:湖南大学,2007.
[17]秦玉洁,周少奇,朱明石.厌氧氨氧化反应.微生态的研究[J].环境科学,2008,29(6):1638-1643.QIN Yu-jie,ZHOU Shao-qi,ZHU Ming-shi.Micro-ecology of the anaerobic ammonium oxidation reactor[J].Environmental Science,2008,29(6):1638-1643.(in Chinese)

