γδT细胞对人宫颈癌HeLa细胞增殖和凋亡的影响*
李 华,韦立蓓,王育斌
(1.武汉科技大学附属天佑医院妇产科,湖北武汉430064;2.武汉科技大学医学院生理学系)
γδT细胞具有天然免疫的特点,在整个T细胞群体中所占的比例虽较少,但当各种感染和疾病发生时,能为机体提供第一道防线。近年来,γδT细胞在抗感染、抗肿瘤及免疫调节等方面的作用成为研究者关注的热点[1]。人γδT细胞有两个主要的亚群,即 Vδ1T和 Vδ2T细胞。Vδ1T细胞主要分布在人上皮组织中,Vδ2T细胞主要分布在人外周血中。研究[2]报道在一些实体瘤(如结肠肿瘤、乳腺肿瘤)中有γδT细胞的浸润,同时实验研究证明,γδT细胞对肿瘤细胞显示了较为广谱的杀伤活性。我们以往的研究[3,4]也发现在宫颈癌组织有γδT细胞浸润,并经体外扩增后对人宫颈癌HeLa细胞有较强的杀伤作用。本研究通过MTT法和流式细胞术检测γδT细胞对人宫颈癌HeLa细胞增殖和凋亡的影响,进一步探讨γδT细胞体外杀伤宫颈癌细胞的作用机制。
1 材料和方法
1.1 材料
人宫颈癌细胞系HeLa细胞由武汉大学中南医院肿瘤防治研究中心提供,人宫颈癌新鲜标本由湖北省肿瘤医院提供。抗TCRγδ单克隆抗体、PE标记的抗TCRγδ抗体(IgG1,clone IMMU 510)及PE标记的同型对照(clone 679.1Mc7)购于法国Immunotech公司,Annexin-V-FICT/PI双染细胞凋亡检测试剂盒,购自上海美季生物技术有限公司,RPMI-1640培养基、二甲基亚砜(DMSO)购自美国Gibco公司,小牛血清、胰蛋白酶及MTT检测试剂盒,购自美国Sigma公司。实验中涉及到人宫颈癌标本及临床资料的收集经医院伦理委员会批准,并与患者签署了知情同意书。
1.2 细胞培养
无菌采集宫颈癌患者手术切除的肿瘤组织块,用RPMI 1640完全培养基清洗后去除坏死组织及周边的正常组织,分离出肿瘤浸润细胞(tumor infiltrating lymphocytes,TIL)并制成细胞悬液,取1ml的细胞悬液参照文献[4]常规细胞培养3~4周后采用流式细胞术进行表型鉴定,选取TCRγδ抗体阳性细胞比例90.0%以上(即高纯度的γδT细胞)用于后续实验。将人宫颈癌HeLa细胞置于RPMI-1640完全培养基(含100ml/L小牛血清)、37℃、5%CO2和饱和湿度条件下的培养箱内培养。
1.3 MTT法测定细胞增殖
取对数生长期的HeLa细胞(靶细胞),接种于96孔培养板(每孔含1×104个细胞),培养至细胞贴壁后分别加入不同浓度的γδT细胞(效应细胞),使靶/效比为1∶0、1∶0.5、1∶1、1∶2、1∶4、1∶16 和1∶32),置于培养箱(37℃,5%CO2)中继续共培养24h和48h后,用PBS洗去γδT细胞,收集贴壁的HeLa细胞用于MTT法检测,具体步骤按照试剂盒说明书进行。在酶联免疫检测仪上,读取490nm处D值,HeLa细胞增殖率计算公式:增殖率 (%)= (D效靶反应孔- D靶细胞自然释放孔-
1.4 流式细胞仪检测细胞凋亡
按上述培养条件和方法将HeLa细胞和γδT细胞(1∶4)共培养24h,并以不加 γδT细胞为对照;PBS轻轻洗去γδT细胞,用不含乙二胺四乙酸(EDTA)的胰酶消化15min,用冷PBS洗涤细胞两次,2000rpm,离心5min,收集 HeLa细胞;用400μl 1×Binding Buffer悬浮细胞,调整密度为1×106个/ml,在细胞悬浮液中加入5μl FITC标记的膜联蛋白-V(FITC-Annexin-V),轻轻混匀后于2℃ ~8℃避光条件下孵育15min;加入10μl碘化丙啶(PI)后轻轻混匀于2℃ ~8℃避光条件下孵育5min。于1h内上流式细胞仪检测。
1.5 统计学方法
实验数据采用SPSS 13.0软件进行统计学分析,计量资料用均数±标准差(s)表示,计数资料用率或百分比表示,组间比较采用t检验,多组间均数的比较采用方差分析,方差分析中两组间均数的比较采用q检验,P<0.05或P<0.01表示差异具有统计学意义。
2 结果
2.1 γδT细胞抑制HeLa细胞的增殖
MTT法检测结果(图1)显示,与不加γδT细胞(1∶0)比较,各效靶比HeLa细胞的增殖率显著降低并呈现剂量依赖性,差异有统计学意义(P<0.05),靶细胞∶效应细胞为1∶30,共培养24h和48h的增殖率为(40.99±8.42)%、(31.67±8.74)%,表明50%以上的细胞停止增殖。24h和48h相同比例之间比较,差异无统计学意义(P>0.05),表明没有明显时间依赖性。
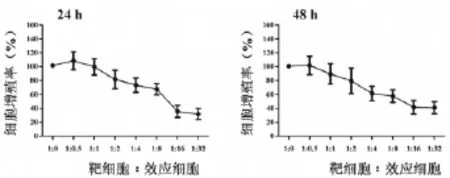
图1 γδT细胞对HeLa细胞增殖的影响
2.2 γδT细胞促进HeLa细胞的凋亡
HeLa细胞和γδT细胞(1∶7.5)共培养24h后上流式细胞仪检测(图2),以FITC-Annexin-V和PI染色双阳性的细胞比例代表凋亡的HeLa细胞比例,结果显示,γδT+HeLa组凋亡细胞率为(31.98±2.56)%,HeLa组为(1.73±0.24)%,表明 γδT细胞能显著促进HeLa细胞的凋亡(P<0.05)。
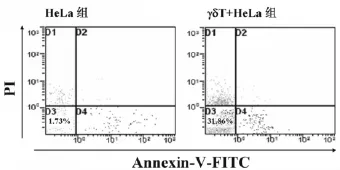
图2 γδT细胞对HeLa细胞凋亡的影响
3 讨论
宫颈癌是常见的妇科恶性肿瘤,我国宫颈癌的发病率及死亡率居世界前列。近年来由于宫颈细胞学筛查的普遍应用,使其发病率和死亡率已有明显下降,但在农村和偏远的山区仍呈高发的态势。宫颈癌治疗以手术及放化疗为基本手段,但近年来卵巢癌的治疗手段有了长足的进展,其中免疫治疗作为肿瘤生物治疗的重要组成部分已经成为宫颈癌的新治疗模式。γδT细胞作为一种新的肿瘤免疫治疗细胞,无主要组织相容性抗原(MHC)限制性以及不依赖抗原的处理和呈递过程,直接对肿瘤细胞进行识别和杀伤[5],因此在抗肿瘤中发挥重要作用。本研究从宫颈癌患者手术切除的肿瘤组织中分离出TIL,经体外扩增成功获得了大量高纯度的γδT细胞,为展开γδT细胞体外抗肿瘤作用机制的研究奠定了基础。有报道称,γδT细胞可以不依赖于胸腺发育,在某些组织拥有优势分布,特别是皮肤、食道、肺和生殖道的上皮内,能够杀伤上皮来源的实体瘤,比如结肠肿瘤[6]、肾肿瘤[7]等。本研究中选择的人宫颈癌细胞系亦为上皮来源的肿瘤细胞,在与γδT细胞按不同比例共培养后,MTT法检测结果显示,HeLa细胞的增殖率显著降低并呈现剂量依赖性,表明γδT细胞能够抑制肿瘤细胞的增殖,这可能是γδT细胞抗宫颈癌作用机制之一。
细胞凋亡是生理或病理状态下都可能发生的现象,对机体正常细胞群的稳定、防御和免疫反应、疾病或中毒时引起的细胞损伤、老化以及肿瘤的发生、进展起着重要作用。在正常细胞中,磷脂酰丝氨酸(Phosphatidylserine,PS)位于细胞膜的内侧,但在细胞凋亡的早期,PS可从细胞膜的内侧翻转到细胞膜的表面,暴露在细胞外环境中。Annexin-V是能与PS高亲和力特异性结合的Ca2+依赖性磷脂结合蛋白[8]。PI作为一种核酸染料,不能透过完整的细胞膜,但能够透过凋亡中、晚期的细胞和死细胞膜而使细胞核红染。因此本研究中采用FITC-Annexin-V与PI双染能将凋亡的细胞以及死细胞区分开来,结果直观可靠。另外,本研究根据细胞增殖实验的结果,选择了合适的比例将γδT细胞与HeLa细胞共培养后,利用流式细胞术分析细胞凋亡率,结果显示γδT细胞能显著促进HeLa细胞的凋亡。
综上所述,本研究提示γδT细胞通过抑制细胞增殖、促进细胞凋亡,从而发挥抗肿瘤作用,为临床开展以γδT细胞为基础的免疫治疗提供了参考依据。
[1]Kabelitz D,Wesch D,He W.Perspectives of gamma delta T cells in tumor immunology [J].Cancer Res,2007,67(1):5
[2]Todaro M,D'Asaro M,Caccamo N,et al.Efficient killing of human colon cancer stem cells by gammadelta T lymphocytes[J].J Immunol,2009,182(11):7287
[3]Li Hua,Wang Yubin,Zhou Fu Xiang.Effect of ex vivo-expanded gamma delta-T cells combined with galectin-1 antibody on the growth of human cervical cancer xenografts in SCID mice[J].Clinical and Investigative Medicine,2010,33(5):E280
[4]李华,王育斌,周福祥.γδT细胞对宫颈癌细胞体外杀伤作用的探讨[J].武汉大学学报(医学版),2012,33(5):631
[5]Wu J,Groh V,Spies T.T cell antigen receptor engagement and specificity in the recognition of stress-inducible MHC class I-related chains by human epithelial gamma delta T cells[J].J Immunol,2002,169(3):1236
[6]Iovino F,Meraviglia S,Spina M,et al.Immunotherapy targeting colon cancer stem cells[J].Immunotherapy,2011,3(1):97
[7]Lang JM,Kaikobad MR,Wallace M,et al.Pilot trial of interleukin-2 and zoledronic acid to augment γδ T cells as treatment for patients with refractory renal cell carcinoma[J].Cancer Immunol Immunother,2011,60(10):1447
[8]Madureira PA,Waisman DM.Annexin A2:the importance of being redox sensitive [J].Int J Mol Sci,2013,14(2):3568

