金樱子多糖对免疫抑制小鼠肝功能及血脂代谢的调节作用
肖 慧, 李 丽, 谭 娟,2,3, 皮建辉,2,3*
(怀化学院1.生命科学系; 2.民族药用植物资源研究与利用湖南省重点实验室;3.湘西药用植物与民族植物学湖南省高校重点实验室, 湖南 怀化 418008;4.湖南师范大学生命科学学院, 湖南长沙 410081)
金樱子多糖对免疫抑制小鼠肝功能及血脂代谢的调节作用
肖 慧1,4, 李 丽1, 谭 娟1,2,3, 皮建辉1,2,3*
(怀化学院1.生命科学系; 2.民族药用植物资源研究与利用湖南省重点实验室;3.湘西药用植物与民族植物学湖南省高校重点实验室, 湖南 怀化 418008;4.湖南师范大学生命科学学院, 湖南长沙 410081)
为探讨金樱子多糖对免疫抑制小鼠肝功能及血脂代谢的调节作用,取50只昆明小鼠随机平均分为正常对照组、模型组、RLP低剂量组、RLP中剂量组、RLP高剂量组.低、中、高剂量组分别按100 mg kg·d、200 mg kg·d、400mg kg·d连续灌胃30 d;正常对照组和模型组灌胃生理盐水.于试验前一周在继续灌胃的基础上,除正常对照组外,分别于第1、3、5天给小鼠按25 mg kg体重腹腔注射地塞米松(Dex)建立免疫抑制动物模型.摘小鼠眼球取血,用试剂盒测定小鼠血清的总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇 (HDL-C)、低密度脂蛋白胆固醇(LDL-C)、谷草转氨酶(AST)、谷丙转氨酶(ALT).结果表明,金樱子多糖能显著降低免疫抑制小鼠血清中TC、LDL-C、AST、ALT含量,对HDL-C和TG有一定的调节作用.因此,金樱子多糖对免疫抑制小鼠肝功能及血脂代谢具有一定的调节作用.
金樱子多糖; 血脂代谢; 转氨酶; 昆明小鼠
金樱子 (Rosa laevigata Mickx)是蔷薇科蔷薇属常绿蔓性灌木野生果,其主要活性成分是多糖、黄酮类物质、三萜类及其衍生物等[1].其多糖具有抗氧化活性[2],能改善药物性肝损伤小鼠的血脂代谢[3],对药物性肝损伤小鼠具有良好的保护作用[4].肝脏是免疫反应的重要靶器官及调节器官,含有各种免疫细胞及免疫因子,如各种淋巴细胞、单核巨噬细胞、K细胞、NK细胞、树突状细胞等,这些细胞在各种因素作用下,产生免疫因子,共同构成复杂的免疫系统成分[5].当哺乳动物的免疫功能受到抑制时,其肝脏的免疫作用下降同时,其脂肪代谢、胆汁的分泌、高密度脂蛋白 (HDL)的合成等功能也会相继受到影响.为探讨金樱子多糖 (Rosa laevigata Michx polysaccharides,RLP)的免疫调节活性,进一步开发与利用RLP,我们分析了RLP对免疫抑制小鼠肝功能与血脂代谢的调节作用.
1 材料与方法
1.1 材料、仪器与试剂
1.1.1 研究材料
金樱子采集于湖南省怀化市会同县山地,经怀化学院生命科学系李爱民博士鉴定为蔷薇科蔷薇属常绿蔓性灌木金樱子 (Rosa laevigata Mickx)野生果.金樱子多糖由本实验室提取,按葡萄糖标准曲线方程:A=9.8857[C]+0.0025(R2=0.9996),确定提取的金樱子多糖纯度为83.7%.试验动物采用清洁级KM小鼠,体重22-26 g,购自中南大学实验动物中心,许可证号:SCXK(湘)2006-0002.
1.1.2 主要仪器
DU800紫外 可见分光光度计 (美国Beckman公司)、DTC-21旋转蒸发仪 (美国)、TD4G台式过滤离心机 (长沙湘仪离心机仪器有限公司)、FD-1C冷冻真空干燥机 (北京德天佑科技发展有限公司)、HH-601超级恒温水浴锅 (金坛市国旺实验仪器厂)、LRH-250A生化培养箱 (广东省医疗器械厂)等.
1.1.3 试剂
地塞米松磷酸钠注射液 (Dex)(郑州卓峰制药有限公司,编号:1010721);肝素钠 (购于怀化解放军五三五医院);高密度脂蛋白胆固醇 (HDL-C)试剂盒(北京北化康泰临床试剂有限公司,编号:006328);低密度脂蛋白胆固醇 (LDL-C)试剂盒 (北京北化康泰临床试剂有限公司,编号:006340);总胆固醇(TC)试剂盒 (北京北化康泰临床试剂有限公司,编号:006301);甘油三酯 (TG)试剂盒 (北京北化康泰临床试剂有限公司,编号:006304);谷草转氨酶(AST GOT)测定试剂盒 (赖氏法)(南京建成生物工程研究所);谷丙转氨酶 (ALT GPT)测定试剂盒(赖氏法)(南京建成生物工程研究所).其他化学药品与试剂均为国产分析纯.
1.2 实验方法
1.2.1 动物试验
将50只清洁级KM小鼠随机平均分为正常对照组、模型组、RLP低剂量组、RLP中剂量组、RLP高剂量组.除正常对照组和模型组小鼠灌胃0.9%生理盐水外,RLP低、中、高剂量组小鼠于每天晚上19:00-21:00之间分别灌胃100 mg kg、200 mg kg、400 mg kg体重的RLP,连续灌胃30天.于试验前一周在继续灌胃的基础上,除正常对照组外,分别于第1、3、5天给小鼠按25 mg kg体重腹腔注射地塞米松 (Dex)建立免疫抑制动物模型.
1.2.2 血清生理生化指标的测定
试验前小鼠禁食不禁水12h,摘眼球取血于经肝素处理后的离心管中,4℃条件下3 000 rpm离心10 min,收集血清保存于-20℃冰箱中备用.严格按试剂盒规定方法测定TC、TG、HDL-C、LDL-C、AST和ALT.
1.2.3 数据统计学处理
数据以均数±标准差 ( x±s)表示,采用Excel统计软件进行统计分析.组间显著性比较采用t检验,P<0.05为显著性标准,P<0.01为极显著性标准.
2 结果
2.1 金樱子多糖对免疫抑制小鼠血清TC和TG的影响
由表1可知,模型组小鼠血清TC、TG浓度均极显著高于正常对照组(p<0.01),说明模型组小鼠存在TC、TG代谢异常.经RLP干预后,各剂量组小鼠血清中TC浓度均低于模型组,且中、高剂量组有极显著差异 (p<0.01);各剂量组小鼠血清中TG浓度均低于模型组,但仅高剂量组有显著差异 (p<0.05).

表1 金樱子多糖对免疫抑制小鼠血清TC和TG的影响
2.2 金樱子多糖对免疫抑制小鼠血清HDL-C和LDL-C的影响
表2显示,小鼠模型组与正常对照组的血清HDL-C和LDL-C浓度均存在极显著的统计学差异 (p<0.01),说明模型组小鼠存在脂密度蛋白代谢异常.各RLP干预组实验小鼠的血清中HDL-C浓度均高于模型组,但仅中剂量组有显著差异 (p<0.05),不过低剂量组还是明显低于正常组 (p<0.01);各剂量组血清LDL-C浓度均显著低于模型组 (p<0.05或p<0.01),不过低剂量组还是明显高于正常组 (p<0.05).
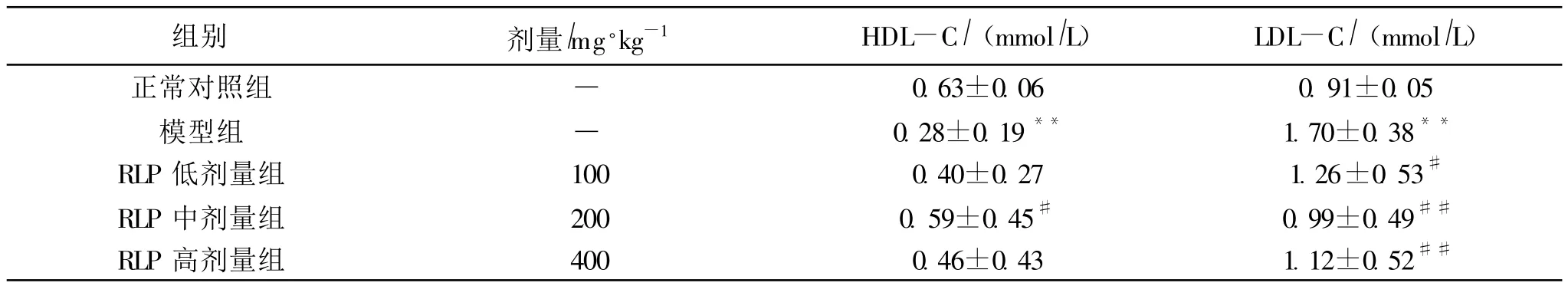
表2 金樱子多糖对免疫抑制小鼠血清HDL-C和LDL-C的影响
2.3 金樱子多糖对免疫抑制小鼠血清AST和ALT的影响
表3显示,模型组小鼠血清AST和ALT含量均极显著高于正常对照组 (p<0.01),表明短期内高剂量Dex对小鼠肝功能有一定的损害作用.RLP各剂量组小鼠血清中AST和ALT浓度均低于模型组,且中、高剂量组均有极显著差异 (p<0.01).

表3 金樱子多糖对免疫抑制小鼠血清AST和ALT的影响
3 讨论
地塞米松是一种糖皮质激素的免疫抑制剂,正常生理剂量的地塞米松对肝脏没有损伤,但高剂量或长期使用会造成明显的肝损伤.吕嵘等[6]发现,2倍生理剂量的地塞米松能使大耳白兔肝脏组织出现不同程度的肝细胞空泡样变性和红细胞大量沉积,4倍生理剂量的地塞米松能使肝脏组织发生严重病理变化.肝脏不但是消化器官 (消化腺),而且还具有内分泌作用与免疫功能,具有多种免疫细胞及免疫因子、含有复杂的免疫系统成分[5],高剂量的地塞米松损伤肝组织的同时,也降低了肝脏的内分泌与免疫作用.
肝脏具有脂肪代谢与合成HDL的功能.血脂异常最常见的表现是TC、TG和LDL-C水平上升,而HDL-C下降.当LDL-C的浓度升高时,机体会产生过多的过氧化物质.有实验证明,脂质过氧化产物丙二醛(MDA)能修饰LDL-C变性生成MDA-LDL-C,这种变性的LDL-C不能被正常的LDL-C受体识别,造成胆固醇在本内大量堆积.而HDL是血液中密度最高、颗粒最小的一种脂蛋白,能穿透血管内膜将沉积在LDL里面的胆固醇清除并携带出血管壁至肝脏进行分解排泄[7].本实验表明,经Dex处理后的模型组小鼠与正常对照组相比,血清TC、TG、LDL-C都有明显升高,HDL-C也有明显的降低,说明Dex明显影响了肝脏的功能.由于Dex的作用,一方面肝组织受损伤,脂肪代谢与HDL合成功能下降,使血脂升高、HDL水平降低;另方面,肝脏免疫与内分泌功能下降,体内胰岛素浓度增加,使肝脏合成的胆固醇也增多,同时雌二醇水平降低,使LDL受体活性及数目减少,不能及时清除过多的LDL,使胆固醇大量蓄积在体内[8].但经RLP干预后,血清中TC、TG、LDL-C都有不同程度地降低,而HDL-C有一定地升高,表明RLP对Dex所致的免疫抑制小鼠血脂代谢有一定的调节作用.
高剂量的Dex所致小鼠肝细胞损伤,使生物膜脂质过氧化加强,肝细胞膜甚至肝细胞线粒体膜通透性升高,使细胞内转氨酶释放到血清中,导致血清中AST和ALT的酶活力上升[9].经RLP不同剂量干预后,中、高剂量组血清AST和ALT浓度显著下降,说明RLP对Dex所致免疫抑制小鼠肝功能有一定的保护作用.
[1]吴兴文,高品一,李玲芝,等.中药金樱子的化学成分研究 [J].药学实践杂,2009,27(3):183-185.
[2]赵云涛,国兴明,李付振.金樱子多糖的抗氧化作用[J].生物学杂志,2003,20(2):23-24.
[3]皮朝琼,真义才,蔡珊兰,等.金樱子多糖对药物性肝损伤小鼠血脂代谢的影响 [J].怀化学院学报,2011,30(11):36-38.
[4]皮朝琼,蔡珊兰,真义才,等.金樱子多糖对小鼠急性药物肝损伤的保护作用[J].中国农学通报,2012,28(35):55-58.
[5]吴全裕.肝脏的内分泌与免疫功能分析 [J].中国卫生产业,2012,(5):167,169.
[6]吕嵘,白卫兵,王生奎.地塞米松对兔肝脏组织形态结构的影响 [J].动物医学进展,2010,31(2):56-59.
[7]林志明,吴红棉.毛蚶氨基多糖降血脂作用的研究[A].食品安全监督与法制建设国际研讨会暨第二届中国食品研究生论坛论文集 [C].杭州:食品安全监督与法制建设国际研讨会暨第二届中国食品研究生论坛会议,2005:1004-1007.
[8]王继峰,牛建昭,李华,等.大豆提取物对去卵巢大鼠脂代谢的作用[J].中国中药杂志,2002,27(4):285-288.
[9]刘娟.当归多糖对地塞米松所致肝损伤的干预作用[J].中国生化药物杂志,2012,33(1):55-57.
Effects of Rosa laevigata Michx polysaccharides on Liver Function and Lipid Metabolism in Immunosuppressed Mice
XIAO Hui1,4, LI Li1, TAN Juan1,2,3, PI Jian-hui1,2,3*
(1.Department of Life Science;2.Laboratory of Hunan Province forStudy and Utilization of Ethnic Medicinal Plant Resources;3.Laboratory of Hunan Higher Education for Hunan-western Medicinal Plant and Ethnobotany,Huaihua University,Huaihua,Hunan418008;4.School of Life Science,Hunan nomalUniversity,Changsha,Hunan410081)
To study modulating effects of Rosa laevigata Michx polysaccharides on liver function and lipid metabolism in immunosuppressed mice,50 KM mice were randomly divided into normal group,model group,low dose group,middle dose group and high dose group,respectively.And low dose group,middle dose group and high dose group were given Rosa laevigata Michx polysaccharides with 100 mg kg,200 mg kg and 400 mg kg every day,respectively,while that of normal group and model group were insteaded of NS.After continuously giving drug 30 days,other groups were injected with Dex(25 mg kg)3 times by intraperitoneal injection on the first,the second and the third day,respectively,but the normal control group were instead of saline.And after giving Rosa laevigata Michx polysaccharides 1 week simultaneously,TC,TG,HDL-C,LDL-C,AST and ALT of serum in mice were tested,respectively.The results showed,Rosa laevigata Michx polysaccharides can significantly reduce the content of TC,LDL-C,AST and ALT,and regulate the content of TG and HDL-C in serum.
Rosa laevigata Michx polysaccharides; lipid metabolism; Transaminase; KM mice
R965
A
1671-9743(2013)11-0006-03
2013-08-15
怀化市重大科技攻关项目 (HHKJ200911);民族药用植物资源研究与利用湖南省重点实验室委托项目(HHUW2010-71).
肖 慧(1991-),女,湖南怀化人,怀化学院生命科学系2012届毕业生,湖南师范大学2012级硕士研究生.
*通讯作者:皮建辉(1969-),男,湖南益阳人,怀化学院教授,主要研究药用植物与开发.

