苯并噻唑类化合物对高脂模型小鼠抗氧化能力的影响
花尔并,王秋月,王莹莹,刘为铸,申婷婷
(天津科技大学生物工程学院,天津 300457)
沉默信息调节因子1(silent information regulator 1,SIRT1)[1]作为哺乳动物中与酵母菌中Sir2[2](silent information regulator 2)基因的高度同源基因,在体内参与调节细胞的存活和代谢过程及增殖、衰老和凋亡等生命活动.咪唑并噻唑类化合物(SRT1720)被证明为和白藜芦醇一样是SIRT1 激动剂[3],白藜芦醇也是一种可改善氧化应激和抗氧化功能紊乱的天然抗氧化剂[4].抗氧化的主要机制与清除自由基等作用有关,机体在生理代谢过程中存在自由基产生与清除的动态平衡[5].如果这种动态平衡被破坏,就会导致对机体的损伤,造成许多疾病如糖尿病、心血管病、癌症的发生.清除活性氧是预防这些疾病的一个有效途径.超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、过氧化氢酶(CAT)是清除活性氧的主要抗氧化酶,丙二醛(MDA)含量体现机体脂质过氧化程度.这4个指标可用以评价抗氧化能力.
基于目前SIRT1 小分子激动剂的研究刚刚起步,对报道的化合物SRT1720 的结构进行优化设计合成出结构相关的SIRT1 小分子激动剂,这从理论和实际操作上都是可行的,并有很大的空间值得去探索,这也是提升新药研发潜力的重要手段.本文所用的苯并噻唑类化合物是根据SIRT1 激动剂SRT1720的结构相关性设计2-间苯胺基苯并噻唑(TJ-1)、2-间苯胺基苯并噻唑-3,4,5-三甲氧基苯甲酰胺(TJ-2)和2-间苯胺基苯并噻唑-1H-吡唑-3-甲酰胺(TJ-3),研究其对于高脂模型小鼠抗氧化能力的影响.
1 材料与方法
1.1 实验动物
50只8 周龄健康雄性 C57BL/6,J 小鼠(18~22,g),购自北京大学医学部实验动物科学部,许可证编号[SCXK(京)2012-0012].
1.2 试剂与仪器
TJ-1(2-间苯胺基苯并噻唑)、TJ-2(2-间苯胺基苯并噻唑-3,4,5-三甲氧基苯甲酰胺)、TJ-3(2-间苯胺基苯并噻唑-1H-吡唑-3-甲酰胺)由本实验室自主合成,具体结构如图1 所示(纯度均为95%以上).

图1 SRT1720、TJ-1、TJ-2、TJ-3的化学结构式Fig.1 Chemical structural formula of SRT1720,TJ-1,TJ-2 and TJ-3
白藜芦醇(95%),天津尖峰公司;超氧化物歧化酶(SOD)测定试剂盒、谷胱甘肽过氧化物酶(GSHPx)测定试剂盒、过氧化氢酶(CAT)测定试剂盒、丙二醛(MDA)测定试剂盒、考马斯亮蓝蛋白测定试剂盒,南京建成生物工程研究所;其余试剂均为国产分析纯.
UV-9100 紫外可见分光光度计,北京瑞利分析仪器厂;UVmini-1240 紫外可见分光光度计,日本岛津公司;3K30 高速台式冷冻离心机,Sigma 公司;SK-1 快速混匀器,江苏省荣华仪器制造公司.
1.3 实验方法
1.3.1 造模方法
小鼠适应性饲养1 周后根据体质量随机分为5组,每组10只,分别为高脂组、白藜芦醇对照组、TJ-1组、TJ-2组、TJ-3组.实验期间小鼠自由摄食、饮水、室内温度(22±2)℃、相对湿度(55±5)%、室内通风良好.高脂组喂饲相应高脂饲料,白藜芦醇对照组和各干预组小鼠喂饲高脂饲料并分别添加0.1%的白藜芦醇、TJ-1、TJ-2、TJ-3 进行干预.
1.3.2 抗氧化指标测定
干预12 周后小鼠禁食12,h,乙醚麻醉摘眼球取血约1~2,mL,3,000,r/min 离心15,min 分离血清.断头摘全脑,以冰冷生理盐水清理血迹,吸干水分,准确称量,并加入9 倍体积的无菌冰冷生理盐水手动制成10%的脑匀浆,4,000,r/min 离心10,min,取上清液置于-85,℃冰箱待用;肝组织匀浆也用同法制备.SOD、GSH-Px、CAT、MDA、考马斯亮蓝蛋白浓度的测定按试剂盒说明书严格操作.
1.4 数据处理
2 结果
2.1 TJ-1、TJ-2 和TJ-3 对 C57/BL6,J 小鼠血清SOD、GSH-Px、CAT、MDA水平的影响
各组小鼠血清SOD、GSH-Px、CAT、MDA 的水平见表1.与高脂组相比,TJ-1组SOD、CAT 活力显著升高(P<0.05),GSH-Px 活力极显著升高(P<0.01),MDA 含量显著降低(P<0.05);TJ-2组SOD、GSH-Px、CAT 活力显著升高(P<0.05),MDA 含量极显著降低(P<0.01);TJ-3组SOD、GSH-Px 显著升高(P<0.05),CAT 活力无显著性差异,MDA 含量极显著降低(P<0.01);白藜芦醇对照组SOD、GSHPx、MDA 均无显著性差异,CAT 活力显著升高(P<0.05).
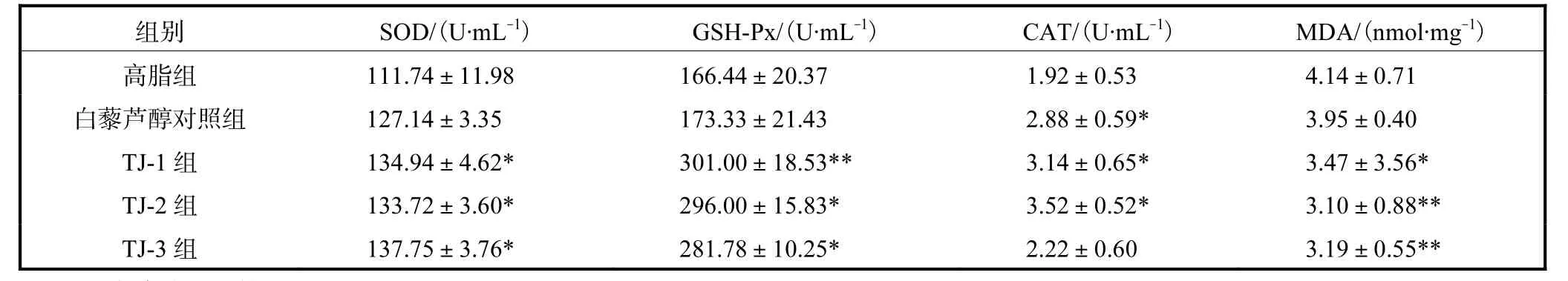
表1 各组小鼠血清SOD、GSH-Px、CAT、MDA的水平(n=10)Tab.1 Levels of SOD,GSH-Px,CAT and MDA in serum in all groups(n=10)
2.2 TJ-1、TJ-2 和TJ-3 对C57/BL6,J小鼠肝脏SOD、GSH-Px、CAT、MDA水平的影响
各组小鼠肝脏SOD、GSH-Px、CAT、MDA 的水平见表2.与高脂组相比,TJ-1组SOD、GSH-Px 活力显著升高(P<0.05),CAT 活力极显著升高(P<0.01),MDA 含量极显著降低(P<0.01);TJ-2组SOD 活力无显著性差异,GSH-Px 活力显著升高(P<0.05),CAT 活力极显著升高(P<0.01),MDA 含量极显著降低(P<0.01);TJ-3组SOD 活力无显著性差异,GSH-Px 活力显著升高(P<0.05),CAT 活力极显著升高(P<0.01),MDA 含量极显著降低(P<0.01);白藜芦醇对照组SOD、GSH-Px 活力无显著性差异,CAT 活力极显著升高(P<0.01),MDA 含量显著降低(P<0.05).
2.3 TJ-1、TJ-2和TJ-3对C57/BL6,J小鼠脑SOD、GSH-Px、MDA水平的影响
各组小鼠脑SOD、GSH-Px、MDA 的水平见表3.与高脂组相比,TJ-1组SOD 活力、MDA 含量均无显著性差异,GSH-Px 活力显著升高(P<0.05);TJ-2组SOD 活力显著升高(P<0.05),MDA 含量显著降低(P<0.05),GSH-Px 活力无显著性差异;TJ-3组SOD、GSH-Px 活力极显著升高(P<0.01),MDA 含量无显著性差异;白藜芦醇对照组SOD 活力极显著升高(P<0.01),GSH-Px 活力、MDA 含量无显著性差异.

表2 各组小鼠肝脏SOD、GSH-Px、CAT、MDA的水平(n=10)Tab.2 Levels of SOD,GSH-Px,CAT and MDA in liver in all groups(n=10)
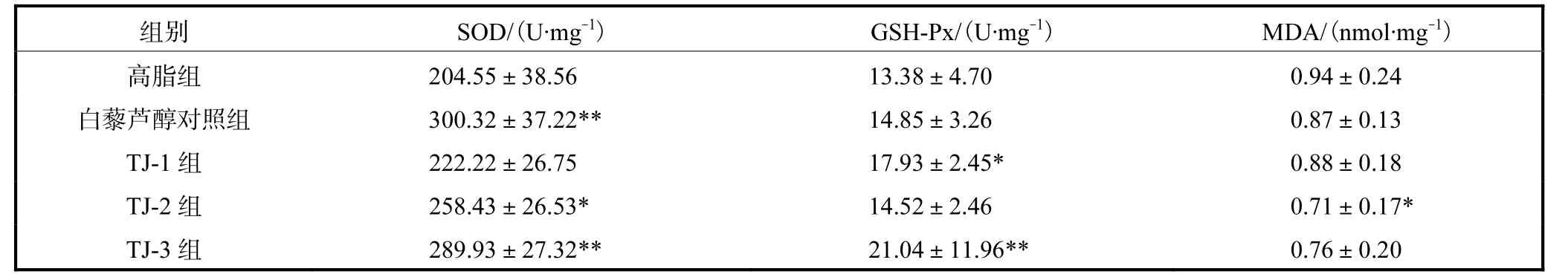
表3 各组小鼠脑SOD、GSH-Px、MDA的水平(n=10)Tab.3 Levels of SOD,GSH-Px and MDA in brain in all groups(n=10)
3 讨论
SIRT1 与众多基因的转录调控、能量代谢及细胞衰老过程的调节有关,白藜芦醇能够激活哺乳动物SIRT1 基因,可以用作SIRT1 基因的小分子激活剂.SRT1720 是一种新型SIRT1 特异性小分子激动剂[6],体外实验结果显示其激活SIRT1 去乙酰化酶活性是白藜芦醇的3.3 倍,而效价是它的1,000 倍,并且具有较高的特异性.本实验运用的苯并噻唑类化合物TJ-1、TJ-2、TJ-3 是根据SRT1720 的结构相关性设计,再进行高脂模型小鼠抗氧化活性的研究.
在正常情况下,机体的氧化和抗氧化系统处于一个动态平衡中,当某种原因使自由基产生增加或机体抗氧化能力减弱时,平衡就被破坏,可能进一步导致各种病理变化[7].超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)和过氧化氢酶(CAT)作为机体内主要的抗氧化酶,是体内抗氧化防御系统的重要组成部分,机体内这些酶活性的高低直接决定了机体的抗氧化水平[8].丙二醛(MDA)是脂质过氧化的产物,其高低可间接反映机体细胞受氧自由基损伤的程度[9].
朱立贤等[10]用白藜芦醇对喂饲高脂饲料的大鼠进行干预,结果表明白藜芦醇均能降低大鼠血清MDA 含量,还能升高大鼠血清SOD、CAT、GSH-Px活力.本文中比较各组血清抗氧化水平,TJ-1、TJ-2、TJ-3 均提高了SOD、GSH-Px、CAT 活力,降低了MDA 含量,其中白藜芦醇的效果与朱立贤等[10]的研究成果有一定差异.肝组织是机体代谢的主要组织,含抗氧化相关酶类最丰富[11].比较各组肝脏抗氧化水平,TJ-1、TJ-2、TJ-3 均提高了SOD、GSH-Px、CAT活力,降低了MDA 含量,且比白藜芦醇的效果更好.与血清的抗氧化水平相比,TJ-1、TJ-2、TJ-3 对肝脏中CAT 活力的提高是极显著的,由此可以得出本文所用3 种苯并噻唑类化合物对肝脏的抗氧化水平作用更明显.脑的抗氧化水平主要是从SOD、GSHPx 和MDA 的水平进行分析,TJ-1、TJ-2、TJ-3 也提高了SOD、GSH-Px、CAT 活力,降低了MDA 含量,但是与血清和肝脏中的抗氧化水平相比作用并不明显,其中白藜芦醇的效果与TJ-1、TJ-2、TJ-3 效果基本一致,所以本实验室自主合成的苯并噻唑类化合物对高脂模型小鼠有一定的抗氧化作用.
[1]Frye R A.Characterization of five human cDNAs with homology to the yeast SIR2 gene :Sir2-like proteins(sirtuins)metabolize NAD and may have protein ADP-ribosyl transferase activity[J].Biochemical and Biophysical Research Communications,1999,260(1):273-279.
[2]Gray S G,Ekström T J.The human histone deacetylase family[J].Experimental Cell Research,2001,262(2):75-83.
[3]Milne J C,Lambert P D,Schenk S,et al.Small molecule activators of SIRT1 as therapeutics for the treatment of type 2 diabetes[J].Nature,2007,450(7170):712-716.
[4]Ungvari Z,Orosz Z,Rivera A,et al.Resveratrol increases vascular oxidative stress resistance[J].American Journal of Physiology,2007,292(5):2417-2424.
[5]Kano M,Takayanagi T,Harada K,et al.Antioxidative activity of anthocyanins from purple sweet potato,Ipomoera batatas cultivar Ayamurasaki[J].Bioscience Biotechnology and Biochemistry,2005,69(5):979-988.
[6]Suzuki K,Hayashi R,Ichikawa T,et al.SRT1720,a SIRT1 activator,promotes tumor cell migration,and lung metastasis of breast cancer in mice[J].Oncology Reports,2012,27(6):1726-1732.
[7]高秋萍,阮红,毛童俊,等.紫心甘薯多糖的抗氧化活性研究[J].营养学报,2011,33(1):59-60.
[8]Bokov A,Chaudhuri A,Richardson A.The role of oxidative damage and stress in aging[J].Mechanisms of Aging and Development,2004,125(10/11):811-826.
[9]田风胜,王芳玲,李华君,等.三黄片对糖尿病患者血清超氧化物歧化酶及丙二醛的影响[J].中国中医药信息杂志,2012,19(1):16-18.
[10]朱立贤,金征宇.白藜芦醇苷对高脂血症大鼠血脂代谢的影响及其抗氧化作用[J].中成药,2006,28(2):260-261.
[11]珅史,张泽生,张民,等.苹果多酚对D-半乳糖致衰小鼠衰老的影响[J].营养学报,2011,33(2):201-203.

