人CYP3A4 与POR 和cyt b5的三重共表达及其条件优化
谢章明,刘文慧,徐迎春,陈枢青
(浙江大学药学院药理毒理与生化药学研究所,浙江 杭州 310058)
细胞色素P450(cytochrome P450,CYP)是一大类含有铁卟啉辅因子的蛋白超家族。在众多的P450 中,CYP3A4 是人肝脏中最丰富的一类酶,也是与临床用药代谢最相关的一类酶[1]。由于CYP3A4 酶活性中心有个较大的“口袋”,从而使其具有了较宽的底物结合选择性[2]。也正因为如此,CYP3A4 代谢了超过50%的临床用药[3],如免疫抑制剂环孢素、解热镇痛药乙酰氨基酚、镇静催眠药地西泮以及镇痛药可待因等。
由于从人组织中得到的CYP3A4 不容易保持其原有的催化活性,而且来源不多,因此人们通过基因重组的方法进行CYP3A4 的异源表达。在实际研究过程中,人们尝试并比较了多种表达系统,其中杆状昆虫表达系统[4]不仅表达量高,而且具有正确的糖基化、磷酸化和组织定位表达等优点,其表达的蛋白生物学特性与天然蛋白相似,可以建立高预测能力的代谢模型,对临床用药有很大的指导意义。为此,本研究用Sf 9 细胞共表达了CYP3A4、POR 及cyt b5,并对其表达条件进行了优化,以期得到表达量高、代谢活性强的微粒体,从而用于体外药物和毒物的代谢研究,以及临床药物相互作用的研究。
1 材料与方法
1.1 材料
1.1.1 细胞培养及主要试剂 草地夜蛾卵巢(Spodoptera frugiperda,Sf 9)细胞(由海南养生堂公司馈赠),胎牛血清(Gibco,Invitrogen 公司),Grace's昆虫细胞培养基(Gibco,Invitrogen公司),Cellfectin(Invitrogen 公司)。
1.1.2 菌株及质粒 大肠杆菌菌株E.coli DH5α(由本实验室保存),DH10Bac 菌株(Invitrogen 公司),载体pFastBac 1(Invitrogen公司),pGEM-CYP3A4、pGEM-POR 及pGEM-cyt b5(由本实验室先前构建)。
1.1.3 生物及化学试剂 KOD-plus DNA polymerase(Toyobo 公司),T4 DNA 连接酶、BamH I、Xho I、Not I、Sph I(TaKaRa 公司),AxyPrepTMBody Fluid Viral DNA/RNA Miniprep Kit(Axygen Biosciences 公司),PCR 引物合成和DNA 测序服务均由上海生物工程有限公司提供,X-gal、蛋白胨和酵母提取物(BBI 公司),琼脂糖、琼脂粉、IPTG、氨苄青霉素、庆大霉素、四环霉素和硫酸卡那霉素(上海生物工程有限公司),K3PO4(国药集团化学试剂有限公司),无水乙醇(杭州大方化学试剂厂)。
1.1.4 主要仪器设备 Centrifuge 5415 冷冻离心机 (Eppendorf 公司),Allegra 64R Centrifuge 冷冻离心机(Beckman 公司),Master Gradient PCR 扩增仪(Eppendorf 公司),VS-840-2 型超净工作台(上海博迅科学仪器厂),LRH-250-Ⅱ微电脑控制生化培养箱(广东医疗器械厂),Universal hood 凝胶成像系统(美国BIORAD 公司),GeneQμant 核酸蛋白测定仪(安玛西亚公司),Agilent 1200 高效液相色谱仪(Agilent 公司)。
1.2 方法
1.2.1 Bacmid-CYP3A4、Bacmid-POR 和Bacmid-cyt b5重组黏粒的制备 分别将CYP3A4、POR和cyt b5这3 种基因的PCR 产物与pFastBac 1载体质粒一起进行双酶切,回收酶切产物用T4连接酶在16℃连接过夜,转化至DH5α 感受态细胞中,挑取单克隆进行双酶切及测序鉴定。将鉴定正确的3 种重组载体转化至DH10Bac感受态细胞中,进行蓝白斑筛选,挑取白斑提黏粒进行PCR 和测序鉴定。
1.2.2 转染及3 种昆虫病毒的扩增 将测序正确的Bacmid-CYP3A4、Bacmid-POR 和Bacmid-cyt b5重组黏粒分别转染Sf 9 细胞,72 h 后收集细胞培养液,500×g 离心5 min,吸取上清即为第一代病毒液P1;用P1 感染Sf 9 细胞,72 h后按上述方法离心收集可得到P2,进一步扩增又可得到P3,一般P3 便可用于蛋白的表达。
1.2.3 Real-Time PCR 法测病毒滴度[5]从DH10Bac 菌中提取空白Bacmid-pFastBac DNA,用GeneQuant 仪器测定其质量浓度为1608μg/ml,然后用双蒸水对其进行逐级稀释,得到质量浓度分别为160.8、16.08、1.608、1.608×10-1μg/ml 和1.608×10-2μg/ml,将其作为随行标准曲线。然后用病毒基因组提取试剂盒从上述3 种P3 病毒液中提取病毒基因组,并分别稀释10 倍和100 倍作为样品。Real-time PCR 上下游引物分别为,上游:5'-ATGATCAACATGGGAGAC TCCCACGTGG-3',下 游:5'-CTAGCTCCACACGT CCAGGGAGTAGC-3';PCR 反应体系10μl,其中模板0.8μl,反应参数:95℃预变性30 s,95℃变性5 s,60℃退火30 s,72℃延伸8 s,40次循环。
1.2.4 Sf 9 细胞的悬浮培养[6]及其条件优化由于制备微粒体需要大量的细胞,而Sf 9 细胞本身是半贴壁生长的,因此本实验采用悬浮培养的方法对Sf 9 细胞进行大批量培养。实验中首先对细胞悬浮培养的条件进行了摸索,通过每天对细胞的计数绘制细胞的生长曲线;然后,在细胞悬浮培养时主要对以下5个条件进行优化:恒温摇床的温度、恒温摇床的转速、每个摇瓶中细胞液的量、表面活性剂的加量及细胞应培养的时间。
1.2.5 CYP3A4 与POR 和cyt b5的共表达将上述制备的3 种P3 病毒液按v-CYP3A4、v-POR和v-cyt b5的体积比,分别为1∶0.5∶1、1∶1∶1、1∶1.5∶1和1∶2∶1的比例加入至Sf 9 细胞中,24 h 后加入无菌的氯高铁血红素溶液至终质量浓度为3μg/ml,表达72 h 后500×g 离心5 min,收集细胞,1×PBS 洗涤细胞数次,最后1 000×g 离心5 min,弃尽上清。
1.2.6 微粒体的制备 收集的表达细胞加入适量含PMSF 的P450 溶解液,冰浴超声破碎,功率30 W,超声15次,每次6 s,间隔14 s。然后,4℃,9 000×g 离心20 min,取上清即为S9溶液。将S9 置于高速离心机中,4℃,19 000×g 离心15 min,取上清置于超高速离心机中,4℃,100 000×g 离心55 min,弃去上清,沉淀用100 mmol/L pH 7.4 的磷酸钾缓冲液溶解即得到微粒体溶液。
1.2.7 代谢条件选择 将微粒体用新鲜配制的再生系统分别稀释至0.5、1.0、1.5、2.0 mg/ml 进行孵育,最后将代谢产物峰对酶浓度作图,用来考查代谢的最佳酶浓度。将代谢孵育时间分别设为0、10、20、40、60 和90 min,最终将代谢产物峰对孵育时间作图,用来考查最佳的代谢孵育时间。
1.2.8 代谢动力学参数比较 将4 种不同的微粒体用新鲜配制的再生系统稀释至上述最佳酶浓度,加入底物睾酮使其终浓度为0、10、20、50、100、150、200、300μmol/L,混匀,在37℃水浴中预孵育5 min,立即加入NADP/NADPH 启动反应。孵育时间为上述得到的最佳孵育时间,然后加200μl 冰乙腈涡旋,沉淀蛋白并终止反应,置于预先冷却的离心机中4℃,16 000×g 离心20 min,取上清HPLC 分析,测定代谢产物6β-羟基睾酮浓度,每个样品平行3 份操作。最后,通过GraphPad Prism 5(Vision 5.01)计算米氏常数Km值、最大反应速率Vmax值以及内在代谢清除率CLint(Vmax/Km)。
2 结果
2.1 Bacmid-CYP3A4、Bacmid-POR 和Bacmid-cyt b5重组黏粒的PCR 鉴定 以M13(+)/M13(-)作为上下游引物分别对重组黏粒Bacmid-CYP3A4、Bacmid-POR 和Bacmid-cyt b5进行PCR,其产物用琼脂糖凝胶电泳鉴定(图1)。结果显示,3 种重组黏粒Bacmid-CYP3A4、Bacmid-POR 和Bacmid-cyt b5的PCR 产物分别在约3 800 bp、4 400 bp 和2 700 bp 处得到一条明亮条带,与理论值相符。

图1 Bacmid-CYP3A4、Bacmid-POR 和Bacmid-cyt b5重组黏粒的PCR 鉴定电泳图Fig.1 The PCR products of the recombinant Bacmid-CYP3A4,Bacmid-POR and Bacmid-cyt b5
2.2 三种P3 病毒的滴度 Real-Time PCR 法测病毒滴度(图2 和表1),所得到的3 种P3 病毒v-CYP3A4、v-POR 和v-cyt b5的滴度分别为128.9μg/ml、31.7μg/ml 和11.5μg/ml。图2示DNA 模板从128.6 ng 逐级稀释至0.01286 ng 得到,病毒滴度测定标准曲线在0.01286 ng~128.6 ng 之间时线性良好。

图2 病毒滴度测定标准曲线(n=3)Fig.2 Standard calibration curve of viral titer quantitation(n=3)

表1 v-CYP3A4、v-POR 和v-cyt b5三种P3 病毒的滴度测定结果Table 1 Real-time PCR titration results for v-CYP3A4,v-POR and v-cyt b5(n=3)
2.3 Sf 9 细胞的悬浮培养条件 对Sf 9 细胞悬浮培养中各条件进行了优化,从而得到了一组最合适的悬浮培养条件(图3)。最佳的细胞培养条件是:恒温摇床的温度为27℃,转速为90 r/min,每250 ml 摇瓶中加80~120 ml 初始密度为5×105个/ml 细胞液,并加入0.1%的Pluronic®F-68,细胞培养72 h。用此条件进行悬浮培养时,最适合细胞的生长和目的蛋白的表达。

图3 悬浮培养时Sf 9 细胞的生长曲线Fig.3 Cell growth curve of Sf 9 in shake-flask culture
2.4 微粒体的代谢条件 用微粒体代谢底物睾酮时,在0 到90 min 内(图4A),代谢物生成量呈线性增长,说明在此时间段内,睾酮的代谢速率具有良好的线性。当微粒体蛋白浓度在0.5 mg/ml 至2.0 mg/ml 范围内(图4B),代谢物的生成量也是呈线性增长的,说明在此蛋白浓度范围内,微粒体代谢睾酮的速率也具有良好的线性,且在2.0 mg/ml 浓度以下时,酶没有饱和。考虑到实验需要一定的代谢量以利于定量,因此本实验选择了代谢孵育时间为1 h,蛋白浓度为1 mg/ml。

图4 微粒体代谢的产物量与时间(A) 及与微粒体蛋白浓度(B) 的关系Fig.4 The relationship between metabolic amount and incubation time(A) and between metabolic amount and microsome protein concentration(B)
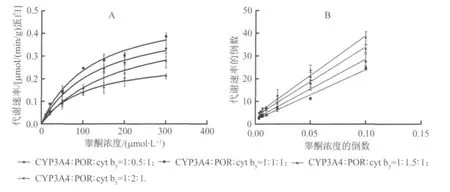
图5 不同微粒体代谢睾酮的代谢动力学曲线及其Lineweaver-Burk 图Fig.5 The kinetic curves and Lineweaver-Burk plot of the metabolism of testosterone by different microsomes
2.5 不同微粒体的代谢动力学参数及代谢活性比较 分别比较4 种微粒体的代谢动力学参数时(图5A 和B,表2),发现当CYP3A4∶POR∶cyt b5=1∶1∶1的比例时,Km值为119.6μmol/L,Vmax为0.52μmol/(min·g 蛋白),此时CLint为4.34 ml/(min·g 蛋白),为4 种微粒体中最大,说明当CYP3A4∶POR∶cyt b5=1∶1∶1时,所表达的微粒体代谢活性最高。

表2 不同微粒体代谢睾酮得到的代谢动力学参数Table 2 Parameters for kinetics of metabolism of testosterone by different microsomes(n=3)
3 讨论
人CYP3A4 是人肝脏中主要的一类细胞色素P450 酶,它负责代谢大量的临床用药及部分环境污染物和内源性物质[7]。细胞色素P450氧化还原酶(cytochrome P450 oxidoreductase,POR)是存在于内质网上专一为细胞色素P450传递电子的一类蛋白。细胞色素b5(cytochrome b5,cyt b5)则 接 受NADH:cyt b5还 原 酶 或NADPH:POR 系统传递的电子,并最终将电子传递给CYP 或其他酶[8]。单独表达的CYP3A4由于缺少POR 及cyt b5等电子转运蛋白而没有活性。因此,本研究通过共表达CYP3A4、POR及cyt b5的方法,以及表达条件的优化来获得较高代谢活性的微粒体。
本研究以杆状昆虫表达系统,对CYP3A4、POR 及cyt b5进行了共表达,并对摇床的温度、转速、摇瓶中细胞液的量、表面活性剂的加量、细胞的培养时间及3 种病毒的加量比例等表达条件进行了优化。最终通过细胞的生长曲线和表达产物制得微粒体对睾酮的代谢动力学曲线。本研究发现,当恒温摇床的温度为27℃,转速为90 r/min,每250 ml 摇瓶中加入80~120 ml 细胞密度为5×105个/ml 的细胞液,并加入0.1%的Pluronic® F-68,细胞培养72 h时,最适合细胞的生长和目的蛋白的表达。此时,当3 种病毒的加量比例为1∶1∶1时,表达条件最佳,其对底物睾酮代谢的Km值、Vmax和CLint分别为119.6μmol/L、0.52μmol/(min·g蛋白)和4.34 ml/(min·g 蛋白)。接下去我们将通过更换表达载体和蛋白融合的表达方法来进一步提高目的蛋白的表达量及CYP3A4 的代谢活性。
在新药开发的早期,药物代谢的研究可以促进新化合物的筛选效率,并提高其在临床上的成功率[9]。而在新药的筛选和开发过程中,研究者通常运用两种不同的体外代谢研究方法来评价基于CYP 的药物-药物相互作用(drugdrug interaction,DDI)[10]。一种方法是研究该新药的代谢途径以及其它药物对该新药代谢的影响。另一种方法是研究该新药对其它药物代谢的影响。这两种方法都需要研究不同的CYP 酶和不同的底物。在药物-药物相互作用的研究中,人们发现不同的底物和代谢环境会对结果造成很大的不同,而CYP3A4 在这个现象中尤其明显[11]。
另外,由于CYP3A4 基因的多态性,不同人种以及同一人种的不同群体间都会携带不同的CYP3A4 突变体,如CYP3A4* 3、CYP3A4* 4、CYP3A4* 5 及CYP3A4* 18[12-13]等。CYP3A4的这些突变体必然会引起CYP3A4 在代谢临床用药或环境污染物上的改变[14]。有些突变体相对于野生型的CYP3A4 来说代谢活性变大了,这就会造成临床用药的药效下降;而有些突变体相对于野生型的CYP3A4 来说代谢活性减弱或消失了,这又会造成临床用药的毒性增加。因此,用定点突变异源表达的方法克隆表达出各种不同的CYP3A4 突变体,并将其用于临床药物的代谢检测,有助于了解不同CYP3A4 突变体对某种药物的代谢能力,从而为个体化用药提供宝贵的参考数据[15-16]。
综上,本研究通过三重共表达CYP3A4、POR 及cyt b5,以及对表达条件的优化不仅提高了目的蛋白的表达量,而且还得到了较高代谢活性的CYP3A4,从而为新药代谢及药物-药物相互作用研究奠定了基础。此外,本研究的表达方法在经过优化后可以放大培养,并且可以用于其他药物代谢酶(如 CYP2D6、CYP2A13、CYP2B6 等等)的表达[17-19],从而可以获得大量高代谢活性的药物代谢酶,为实验室及临床前新药的体外药物代谢动力学试验提供了不可或缺的酶源。另外,对各种药物代谢酶突变体的表达及代谢活性测定也为个体化用药提供了非常宝贵的参考数据。
[1]RAHMIOGLU N,GALL G L,HEATON J,et al.Prediction of variability in CYP3A4 induction using a combined1H NMR metabonomics and targeted UPLC-MS approach [J].Journal of Proteome Research,2011,10:2807-2816.
[2]PENG C C,TEMPLETON I,THUMMEL Ke,et al.Evaluation of 6β-Hydroxycortisol,6β-Hydroxycortisone,and a combination of the two as endogenous probes for inhibition of CYP3A4 in vivo [J].Nature,2011,89(6):888-895.
[3]CHENG Jie,MA Xiao-chao,GONZALEZ F J.Pregnane X receptor-and CYP3A4-humanized mouse models and their applications[J].British Journal of Pharmacology,2011,163:461-468.
[4]ZHANG Hong-bo,PATANA A S,FINEL M.Human UDP-Glucuronosyltransferase expression in insect cells:ratio of active to inactive recombinant proteins and the effects of a C-terminal his-tag on glucuronidation kinetics[J].Drug Metabolism and Disposition,2012,40(10):1935-1944.
[5]LO Huei-ru,CHAO Yu-chan.Rapid titer determination of baculovirus by quantitative realtime polymerase chain reaction[J].Biotechnology Progress,2004,20:354-360.
[6]YAMAJI H,TAGAI S,FUKUDA H.Optimal production of recombinant protein by the baculovirus-insect cell system in shake-flask culture with medium replacement [J].Journal of Bioscience and Bioengineering,1999,87(5):636-641.
[7]WANG R W.,NEWTON D J.,LIU Ni-ni,et al.Human cytochrome P-450 3A4:in vitro drug-drug interaction patterns are substrate-dependent [J].Drug Metabolism and Disposition,1999,28(3):360-366.
[8]KOTRBOVÁ Věra,AIMOVá Dagmar,INGR Marek,et al.Preparation of a biologically active apocytochrome b5via heterologous expression in Escherichia coli [J].Protein Expression and Purification,2009,66:203-209.
[9]MASIMIREMBWA C M,OTTER C,BERG M,et al.Heterologous expression and kinetic characterization of human cytochromes P-450:Validation of a pharmaceutical tool for drug metabolism research[J].Drug Metabolism and Disposition,1999,27(10):1117-1122.
[10]EMOTO C,IWASAKI K.Approach to predict the contribution of cytochrome P450 enzymes to drug metabolism in the early drug-discovery stage:The effect of the expression of cytochrome b5with recombinant P450 enzymes [J].Xenobiotica,2007,37(9):986-999.
[11]YUAN Rae,MADANI Soraya,WEI Xiao-xiong,et al.Evaluation of cytochrome P450 probe substrates commonly used by the pharmaceutical industry to study in vitro drug interactions [J].Drug Metabolism and Disposition,2002,30 (12):1311-1319.
[12]DAI D,TANG J,ROSE R.Identification of variants of CYP3A4 and characterization of their abilities to metabolize testosterone and chlorpyrifos[J].The Journal of Pharmacology and Experimental Therapeutics,2001,299(3):825-831.
[13]HSIEH Kun-pin,LIN Yen-yu,CHENG Ching-ling.Novel mutations of CYP3A4 in Chines[J].Drug Metabolism and Disposition,2000,29(3):268-273.
[14]BJORNSSON T D,CALLAGHAN J T,EINOLF H J,et al.The conduct of in vitro and in vivo drugdrug interaction studies:A pharmaceutical research and manufacturers of America(PhRMA)[J].Drug Metabolism and Disposition,2003,31(7):815-832.
[15]MAEKAWA K,HARAKAWA N,YOSHIMURA T.CYP3A4* 16 and CYP3A4* 18 alleles found in east Asians exhibit differential catalytic activities for seven CYP3A4[J].Drug Metabolism and Disposition,2010,38(12):2100-2104.
[16]MAEKAWA K,YOSHIMURA T,SAITO Y.Functional characterization of CYP3A4.16:catalytic activities toward midazolam and carbamazepine[J].Xenobiotica,2009,39(2):140-147.
[17]KONG L M,CHEN S Q,ZENG S,et al.Comparison of catalytical activity and stereoselectivity between the recombinant human cytochrome P450 2D6.1 and 2D6.10 [J].Pharmazie,2012,67:440-447.
[18]LIU Ting,HONG Yan-jun,CHEN Shu-qing,et al.An investigation of the catalytic activity of CYP2A13* 4 with coumarin and polymorphisms of CYP2A13 in a Chinese Han population[J].Drug Metabolism and Disposition,2012,40:847-851.
[19]CHEN Xuan,PAN Li-qiang,CHEN Shu-qing,et al.Influence of various polymorphic variants of cytochrome P450 oxidoreductase (POR)on drug metabolic activity of CYP3A4 and CYP2B6[J].Plos One,2012,6(7):1-8.

