Cu-Zr-Co-O催化剂催化乙醇直接合成乙酸乙酯
汤清虎,魏志伟,王 京,赵卉茹,赵培正
(河南师范大学 化学化工学院 绿色化学介质与反应省部共建教育部重点实验室,河南 新乡 453007)
乙酸乙酯是一种重要的化工原料和环境友好的有机溶剂,广泛用于香料、染料、制药和油漆等行业。乙醇脱氢一步法合成乙酸乙酯,因具有过程简单、无腐蚀性和毒性较低等优点,引起国内外研究者的广泛关注[1-8]。现用于乙醇脱氢合成乙酸乙酯的催化剂主要有:Pd/CeO2-ZrO2[2],PdO/SiO2[9],Cu-Cr-O[6-7,10],Cu-Zn-Al-O[11],Cu-Zn-Al-Zr-O[12],MoS(x)/C[8]等。其中,在Cu基催化剂上合成乙酸乙酯的选择性较高,但催化剂活性相对较低,且容易发生积碳[7]。添加第二种金属或金属氧化物不仅能改善催化剂的活性、选择性和使用寿命,而且还有利于Cu2+还原为Cu0[13]。Inui等[14-15]研究发现,相对于Cu催化剂,助剂ZrO2的添加可提高乙酸乙酯的选择性,ZnO能抑制丁酮等副产物的形成。Fujita等[16]研究发现,Cu/ZnO催化剂催化乙醇生成乙酸乙酯的选择性明显高于Cu/SiO2催化剂。赵树峰等[17]在用不同方法制备的纳米Cu-Zr-O催化剂催化乙醇合成乙酸乙酯时发现,共沉淀型Cu-Zr-O催化剂具有较好的催化活性。最近,Wang等[18-19]用Cu-Zr-O催化剂催化乙醇合成乙酸乙酯反应,发现添加CoO能有效提高乙醇的转化率和乙酸乙酯的选择性。尽管这些催化体系对乙醇脱氢反应的活性有一定改善,但其催化性能还有待进一步提高。
本工作分别采用反滴加共沉淀法、正滴加共沉淀法和溶胶-凝胶法合成了Cu-Zr-Co-O催化剂,并考察了该催化剂在乙醇脱氢合成乙酸乙酯反应中的催化性能,同时采用XRD、XPS、N2物理吸附、H2-TPR和NH3-TPD等方法表征了催化剂的结构。
1 实验部分
1.1 主要试剂
碳酸钠、硝酸钴:AR,天津市博迪化工有限公司;硝酸铜:AR,天津市德恩化学试剂有限公司;硝酸锆、氢氧化钠、乙醇:AR,国药集团化学试剂有限公司;柠檬酸:AR,新乡市郊西化工厂。
1.2 催化剂的制备
采用反滴加共沉淀法制备Cu-Zr-Co-O催化剂。在60 ℃水浴中,向碳酸钠溶液中滴加硝酸铜、硝酸锆和硝酸钴的混合溶液(其中n(Cu)∶n(Zr)∶n(Co)=3∶2∶1),直至溶液的pH达到7.0,滴加过程中逐渐有沉淀生成,沉淀物经过滤、洗涤、干燥、400 ℃下焙烧后制得Cu-Zr-Co-O催化剂,记为CP-N(1)。将沉淀剂改为氢氧化钠溶液,制备的Cu-Zr-Co-O催化剂记为CP-N(2)。
采用正滴加共沉淀法制备Cu-Zr-Co-O催化剂。在60 ℃水浴中,向硝酸铜、硝酸锆和硝酸钴的混合溶液(其中n(Cu)∶n(Zr)∶n(Co)=3∶2∶1)中滴加碳酸钠溶液(碳酸钠和总的金属离子浓度均为0.50 mol/L),直至溶液的pH达到7.0,滴加过程中逐渐有沉淀生成,沉淀物经过滤、洗涤、干燥、400 ℃下焙烧后制得Cu-Zr-Co-O催化剂,记为CP-P。
采用溶胶-凝胶法制备Cu-Zr-Co-O催化剂。在室温下,向硝酸铜、硝酸锆和硝酸钴的混合溶液(其中n(Cu)∶n(Zr)∶n(Co)=3∶2∶1)中加入柠檬酸溶液(柠檬酸和总的金属离子浓度均为0.25 mol/L),搅拌均匀后,于70 ℃水浴中蒸发,得到透明溶胶,该溶胶于100 ℃下干燥12 h后得到干凝胶,干凝胶经研磨、600 ℃下焙烧后制得Cu-Zr-Co-O催化剂,记为SG-C。
1.3 催化剂的表征
XRD表征在Bruker公司D8 ADVANCE型X射线粉末衍射仪上进行,Cu Kα射线,管电压40 kV,管电流40 mA。XPS表征在Thermo Fisher公司EXCALAB 250Xi型光电子能谱仪上进行,以Al Kα为射线源,以C1s(284.6 eV)为内标校正,测定元素的结合能。N2物理吸附实验在Micromeritics公司ASAP 2020型物理吸附仪上进行,测定前,将试样在250 ℃、0.1 Pa的条件下脱气处理3 h,由BET法计算试样的比表面积。试样表面酸性的测试在Micromeritics公司AutoChem II 2920型全自动程序升温化学吸附仪上进行,N2为载气,TCD检测;将0.30~0.45 mm的待测试样装入试样管中,在N2气流中以10 ℃/min的速率升温至400 ℃预处理1 h,降温至100 ℃吸附NH31 h后,吹扫除去物理吸附的NH3;在N2气流中以10 ℃/min的速率由100 ℃升至600 ℃进行脱附。H2-TPR测试在装配有TCD的流动系统中进行,称取100 mg试样置于石英反应管中,在400 ℃、体积组成为20%O2-80%N2的混合气中处理1 h后通入N2,当温度降至50 ℃以下时,切换为体积组成为5%H2-95%Ar的混合气(流量30 mL/min),待基线平稳后进行TPR测定,升温速率10 ℃/min。
1.4 催化剂的活性评价
乙醇脱氢合成乙酸乙酯反应在常压微型连续流动式固定床反应装置中进行,反应管内径为8 mm。将1.0 mL催化剂(粒径0.30~0.45 mm)装入石英反应管中,在300 ℃、H2气流中预还原1 h,待反应管温度降至80 ℃以下时,切换成体积组成为6%乙醇-94%N2的混合气(乙醇蒸气由N2通过冰水浴恒温的乙醇饱和器产生),调节进料空速为1.2 min-1,待体系稳定后,升温至200 ℃进行反应。反应产物由装配有SE-30毛细管柱和FID的GC-9160型气相色谱仪(上海欧华分析仪器厂)在线分析。反应后的物料主要包括原料乙醇,主产物乙酸乙酯,副产物乙烯、乙醛、乙酸等。预先配制乙醇和各产物的标准试样,求出各试样的相对校正因子,采用面积归一化法定量计算乙醇的转化率和各产物的选择性[20]。
2 结果与讨论
2.1 催化剂的表征结果
不同方法制备的Cu-Zr-Co-O试样的XRD谱图见图1(a)。由图1(a)可见,CP-N(1)试样仅在2θ=33°附近出现一个较宽的无定形ZrO2的衍射峰,说明试样中CuO,CoO,ZrO2均以无定形态存在。CP-N(2) 试样和CP-P试样的XRD谱图类似,除CuO的特征衍射峰[21]外,还可看到归属于t-ZrO2的衍射峰[22],但未观察到CoO的衍射峰,说明添加的CoO以高分散态存在。t-ZrO2的衍射峰强度较弱,表明t-ZrO2的晶粒较小。SG-C试样中同时存在结晶相CuO,t-ZrO2,m-ZrO2[23],但添加的CoO仍以高分散态存在。不同方法制备的Cu-Zr-Co-O试样在300 ℃下预还原后的XRD谱图见图1(b)。由图1(b)可见,在300 ℃下预还原后,CP-N(1)试样只有Cu0的衍射峰出现[21],而未观察到ZrO2和Co的衍射峰,表明试样中ZrO2和Co以无定形态存在。XPS表征结果显示,还原前后CP-N(1)试样的Co 2p3/2的结合能(780.2 eV)未发生变化,表明在300 ℃下预还原后CP-N(1)试样中的Co仍以CoO的形式存在[24]。在300 ℃下预还原后,CP-N(2)试样和CP-P试样的XRD谱图类似,除有Cu0的特征衍射峰外,还可看到t-ZrO2的衍射峰[22],但未发现CoO的衍射峰,表明CoO以高分散态存在。在300 ℃下预还原的SG-C试样的XRD图谱中同时出现Cu0,t-ZrO2,m-ZrO2的特征衍射峰[23],但没有出现Co的衍射峰,表明添加的CoO仍以高分散态存在。对比还原前后试样的XRD谱图可知,预还原后试样中的CuO还原为Cu0,而CoO和ZrO2的存在形式未发生明显变化。根据谢乐公式计算,在300 ℃下预还原后的CP-N(1),CP-N(2),CP-P,SG-C试样上,Cu0粒径分别为14.7,19.7,24.5,36.5 nm。由此可见,催化剂上Cu0的粒径大小与还原前试样中CuO的存在状态有关,CuO的分散度越高,还原后催化剂上Cu0的粒径越小。采用反滴加共沉淀法制备的CP-N(1)试样中CuO以无定形态存在,还原后Cu0的粒径最小。
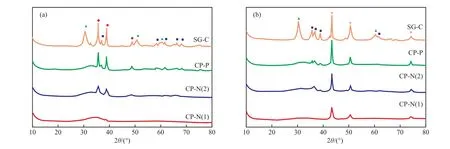
图1 不同方法制备的Cu-Zr-Co-O试样的XRD谱图Fig.1 XRD pro files of Cu-Zr-Co-O samples prepared by different methods.
不同方法制备的Cu-Zr-Co-O试样的H2-TPR谱图见图2。由图2可见,CP-N(1)试样的H2-TPR谱图中有3个还原峰,分别在195,210,550 ℃附近。据文献[24]报道可知,高分散态的CoO与载体之间存在强相互作用,还原一般发生在600 ℃以上。由此可判断,以上3个还原峰应归属于试样中CuO的还原。根据文献[25]的报道可知,195,210℃附近的还原峰归属于分散度较高的无定形CuO的分步还原,这类Cu不能通过XRD表征观察到;而550 ℃附近的还原峰则归属于与ZrO2有较强相互作用的Cu+的还原。CP-N(2)试样的H2-TPR谱图中也有3个还原峰,分别在210,250,550 ℃附近。210 ℃附近的还原峰归属于分散度较高的CuO的还原,250 ℃附近的还原峰归属于孤立的CuO的还原[26],550 ℃附近的还原峰则归属于与ZrO2有较强相互作用的Cu+的还原。210 ℃附近的还原峰强度较弱,表明CP-N(2)试样中分散度较高的CuO较少。CP-P试样的H2-TPR谱图中主要有2个还原峰,分别在210,250 ℃附近,其中210 ℃附近的还原峰强度很弱,表明CP-P试样中分散度较高的CuO很少;同时在540 ℃附近还有一个很弱的还原峰,表明CP-P试样上Cu+很少。SG-C试样的还原峰主要在250 ℃左右,在210 ℃附近也有一个较弱的肩峰,表明SG-C试样上分散度较高的CuO较少;250 ℃处的还原峰向高温方向移动,并在270,290℃附近呈现2个肩峰,表明SG-C试样上孤立的CuO的粒径较大;550 ℃处无还原峰,表明SG-C试样上没有Cu+。以上结果与XRD表征结果一致,这进一步证实采用反滴加共沉淀法制备的CP-N(1)试样中的CuO以高分散态存在,而其他方法制备的试样中均存在较大颗粒的CuO。
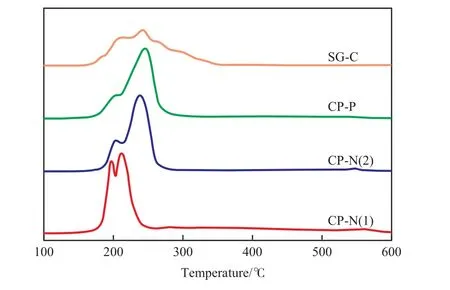
图2 不同方法制备的Cu-Zr-Co-O试样的H2-TPR谱图Fig.2 H2-TPR curves of the Cu-Zr-Co-O samples prepared by different methods.
不同方法制备的Cu-Zr-Co-O试样的物化性质见表1。由表1可见,CP-N(1)试样的比表面积较大,而其他3个试样的比表面积相对较小,其中SG-C试样的比表面积最小。根据文献[27]的报道可知,ZrO2在从无定形结构向四方或单斜晶相结构转变的过程中,比表面积会大幅下降。由XRD表征结果可知,CP-N(2),CP-P,SG-C试样中均存在四方晶相结构的ZrO2,而SG-C中还存在单斜晶相结构的ZrO2,这可能是上述3个试样的比表面积较小的重要原因。
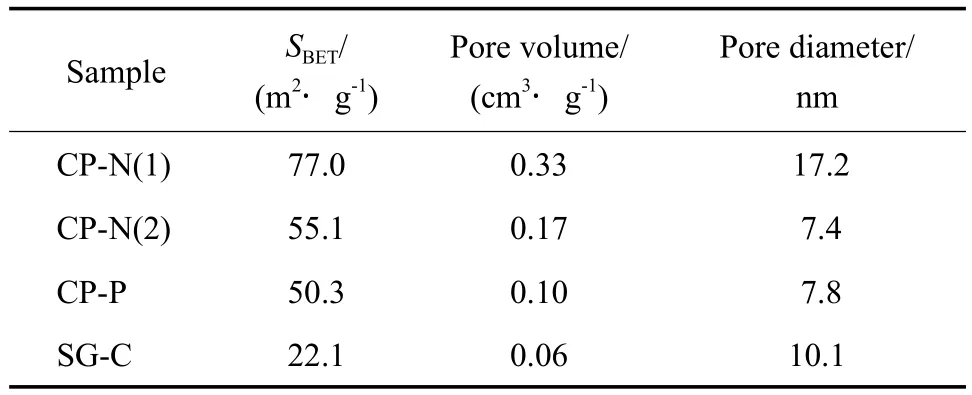
表1 不同方法制备的Cu-Zr-Co-O试样的物化性质Table 1 Physico-chemical properties of the Cu-Zr-Co-O samples prepared by different methods
不同方法制备的Cu-Zr-Co-O试样的NH3-TPD谱图见图3。由图3可见,CP-N(1)试样有一个较宽的脱附峰,脱附峰温度为150~450 ℃,从脱附温度推测该试样可能存在弱酸和中强酸两种酸中心[28]。由分峰面积的大小可知,CP-N(1)试样的酸中心以弱酸为主。CP-N(2)试样和CP-P试样也有一个较宽的脱附峰,但与CP-N(1)试样相比,脱附峰强度明显减弱并向高温方向移动,表明CP-N(2)试样和CP-P试样的表面仅存在少量的酸中心,且其酸中心以中强酸为主。SG-C试样没有出现明显的脱附峰,表明该试样表面几乎没有酸中心。
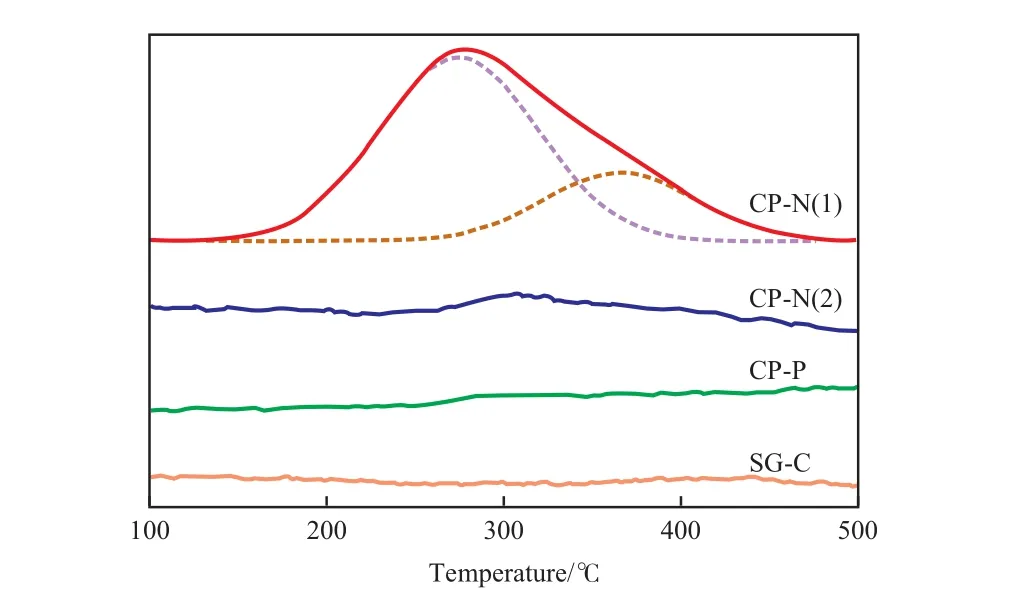
图3 不同方法制备的Cu-Zr-Co-O试样的NH3-TPD谱图Fig.3 NH3-TPD curves of the Cu-Zr-Co-O samples prepared by different methods.
2.2 乙醇脱氢反应结果
用不同方法制备的Cu-Zr-Co-O催化剂催化乙醇进行脱氢反应,实验结果见表2。由表2可见,CP-N(1)催化剂上乙醇的转化率较高,而其他3种催化剂的乙醇转化率均较低。由表2还可见,在CP-N(1)和CP-N(2)催化剂上,乙酸乙酯的选择性较高,而其他2种催化剂上乙酸乙酯的选择性较低。其中,SG-C催化剂上乙酸乙酯的选择性最低,仅为28.0%。由4种催化剂的反应结果可看出,CP-N(1)催化剂对乙醇脱氢合成乙酸乙酯反应有较好的催化性能。研究Cu基催化剂上乙醇脱氢合成乙酸乙酯的机理[10]可知,乙氧基物种是反应的中间物种,Cu0提供反应所需的脱氢活性中心,其他助剂(如ZrO2和Al2O3等)提供合成乙酸乙酯所需的酸中心;Cu0颗粒越小,表面活性中心越多,脱氢反应活性和乙酸乙酯收率越高。CP-N(1)催化剂有较大的比表面积,表面Cu0的粒径较小,且催化剂表面存在较多的酸中心,所以它对该反应的催化性能最好。
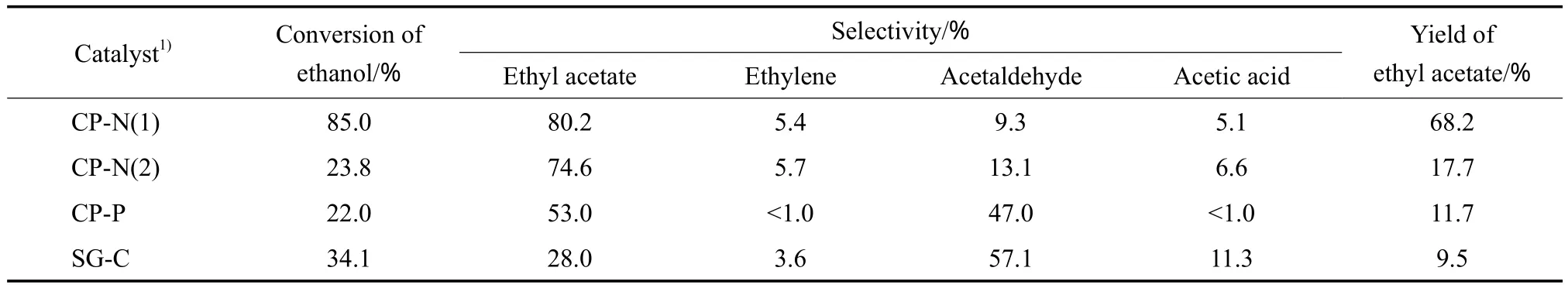
表2 不同方法制备的Cu-Zr-Co-O催化剂的性能Table 2 Catalytic performance of the Cu-Zr-Co-O prepared by different methods
2.3 催化剂预还原温度的影响
用不同温度下预还原的CP-N(1)催化剂催化乙醇进行脱氢反应,实验结果见图4。
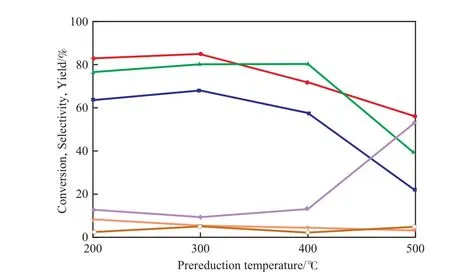
图4 预还原温度对CP-N(1)催化剂性能的影响Fig.4 Effects of prereduction temperature on the catalytic performance of CP-N(1) catalyst.
由图4可见,在300 ℃预还原的CP-N(1)催化剂上,乙醇转化率和乙酸乙酯选择性均较高,但乙醛的选择性却较低。尽管在400 ℃预还原的CP-N(1)催化剂上的乙酸乙酯选择性有所增加,但乙醇转化率却显著下降,导致乙酸乙酯的收率降低。继续升高预还原温度,乙醛选择性明显增加,同时乙醇转化率和乙酸乙酯选择性大幅下降,导致乙酸乙酯的收率显著降低。由此可见,预还原温度显著影响乙醇的转化率和乙酸乙酯的选择性,这是因为预还原温度影响了催化剂表面Cu0的数量及其粒径大小。当预还原温度较低(200 ℃)时,只有部分CuO被还原为Cu0,所以催化剂活性不高。随预还原温度的升高,越来越多的Cu0被还原出来,催化剂活性逐渐增加。但当预还原温度高于300 ℃时,催化剂表面Cu0的粒径逐渐变大[19]。Wang等[18]指出,Cu0不但参与乙醇脱氢生成乙醛的反应,同时也参与由中间产物乙醛生成乙酸乙酯的反应,后一反应过程发生在Cu0与ZrO2的交界面上。由此可见,Cu0粒径的变化不仅影响乙醇的转化率,而且还会对乙酸乙酯的选择性产生较大影响。Cu0粒径变大后,催化剂的脱氢能力降低,因此乙醇的转化率降低;同时随Cu0粒径的变大,Cu0与ZrO2的协同作用变弱,乙醛和乙醇在Cu与ZrO2的交界面上发生偶合反应,导致合成乙酸乙酯的速率下降。
2.4 反应温度的影响
反应温度对CP-N(1)催化剂性能的影响见图5。
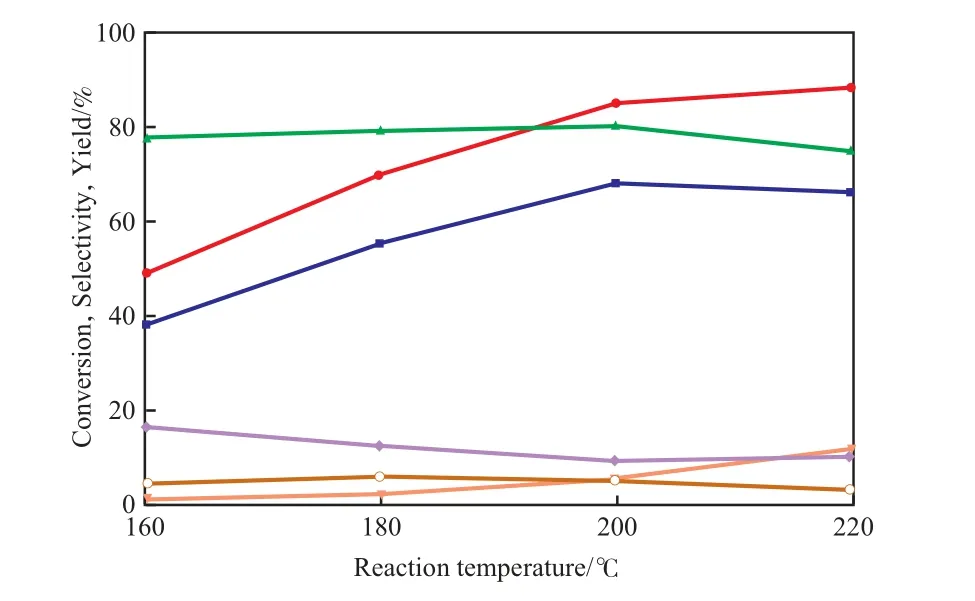
图5 反应温度对CP-N(1)催化剂性能的影响Fig.5 Effects of reaction temperature on the catalytic performance of CP-N(1) catalyst.Catalyst prereduction conditions referred to Table 2.
由图5可见,随反应温度的升高,乙醇的转化率逐渐增大,但乙酸乙酯和乙醛的选择性总体上呈下降趋势,副产物乙烯的选择性逐渐增大。尽管升高反应温度有助于提高乙醇的转化率,但高温会使副反应加剧。综合考虑,选择反应温度为200 ℃较适宜。
2.5 进料空速的影响
GHSV对CP-N(1)催化剂性能的影响见图6。由图6可见,随GHSV的增加,乙醇转化率逐渐减小,乙酸乙酯选择性先略有增大后减小,但乙醛选择性增大。当GHSV较大时,原料气在催化剂表面停留的时间很短,乙醇脱氢生成乙醛后,来不及进一步转化为乙酸乙酯,因此乙酸乙酯的选择性较低,而乙醛的选择性相对较高。综合考虑,选择GHSV=1.2 min-1较适宜。
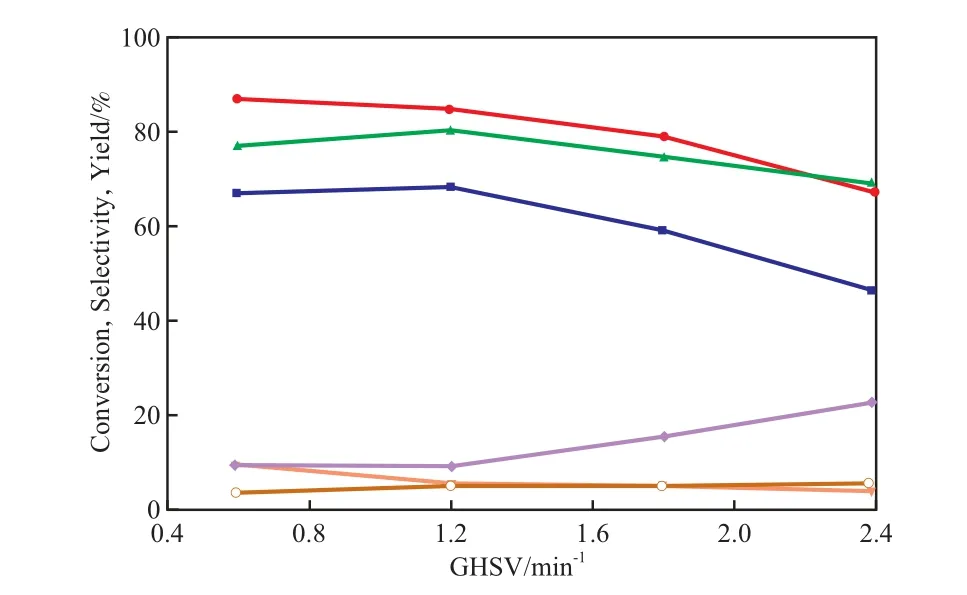
图6 GHSV对CP-N(1)催化剂性能的影响Fig.6 Effects of GHSV on the catalytic performance of CP-N(1) catalyst.Catalyst prereduction conditions referred to Table 2.
2.6 催化剂的稳定性
用经300 ℃预还原的CP-N(1)催化剂催化乙醇进行脱氢反应,以考察CP-N(1)催化剂的稳定性,实验结果见图7。
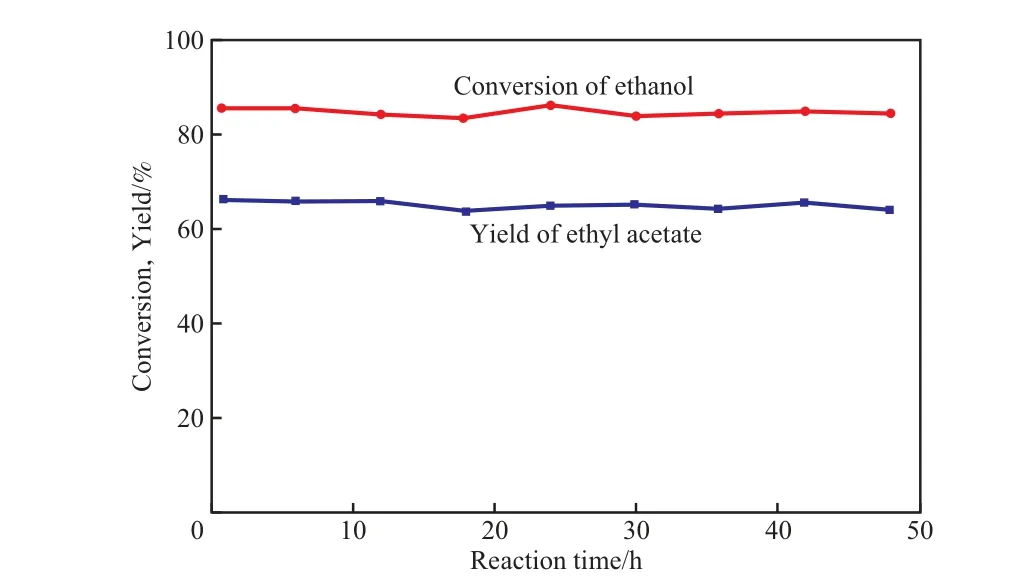
图7 CP-N(1)催化剂的稳定性Fig.7 Stability of CP-N(1) catalyst.Catalyst prereduction conditions and reaction conditions referred to Table 2.
由图7可见,反应48 h后,CP-N(1)催化剂的活性和乙酸乙酯收率基本无明显降低,表明CP-N(1)催化剂对乙醇脱氢合成乙酸乙酯反应具有很好的稳定性。
3 结论
1)与其他方法相比,以碳酸钠为沉淀剂,采用反滴加共沉淀法制备的CP-N(1)催化剂具有较大的比表面积,表面Cu0粒径较小,且存在较多的表面酸中心。该催化剂可有效催化乙醇脱氢,产物以乙酸乙酯为主,且具有较好的稳定性。
2)预还原温度影响催化剂表面Cu0的数量及其粒径大小,进而影响乙醇的转化率和乙酸乙酯的选择性。在300 ℃下预还原的CP-N(1)催化剂对乙醇脱氢合成乙酸乙酯反应具有最佳的催化性能。
3)在GHSV= 1.2 min-1、200 ℃的优化条件下,以300 ℃预还原的CP-N(1)为催化剂催化乙醇脱氢,乙醇的转化率达85.0%,乙酸乙酯的选择性达80.2%。
[1] Sanchez A B,Homs N,Fierro J L G,et al. New Suppoted Pd Catlysts for the Direct Transformation of Ethanol to Ethyl Acetate Under Medium Pressure Conditions[J]. Catal Today,2005,107/108(1):431 - 435.
[2] Sanchez A B,Homs N,Miachon S,et al. Direct Transfornation Ethanol into Ethyl Acetate Through Catalytic Membranes Containing Pd or Pd-Zn:Comparison with Conventional Supported Catalysts[J]. Green Chem,2011,13(9):2569 - 2575.
[3] 潘伟雄. 乙醇脱氢歧化酯化一步合成乙酸乙酯[J]. 石油化工,1991,20(5):330 - 337.
[4] 王大林,姜浩锡,张敏华. 乙醇一步法制备乙酸乙酯反应机理的研究[J]. 2007,36(10):1025 - 1028.
[5] Volanti D P,Sato A G,Orlandi M O,et al. Insight into Copper-Based Catalysts:Microwave-Assisted Morphosynthesis,in Situ Reduction Stduies,and Dehydrogenation of Ethanol[J].ChemCatChem,2011,3(5):839 - 843.
[6] Zonetti P C,Celnik J,Letichevsky S,et al. Chemicals from Ethanol:The Dehydrogenative Route of the Ethyl Acetate One-Pot Synthesis[J]. J Mol Catal A:Chem,2011,334(1/2):29 - 34.
[7] Zhang Minhua,Li Guiming,Jiang Haoxi,et al. Investigation on Process Mechanism on Cu-Cr Catalysts for Ethanol Dehydrogenation to Ethyl Acetate[J]. Catal Lett,2011,141(8):1104 - 1110.
[8] Wang Lixia,Zheng Dafang,Ma Chunxiang,et al. Direct Transformation of Ethanol to Ethyl Acetate over MoS(x)/C Catalyst[J]. Polish J Chem,2009,83(11):1993 - 2000.
[9] Gaspar A B,Barbosa F G,Letichevsky S,et al. The One-Pot Ethyl Acetate Synthesis:The Role of the Support in the Oxi-dation and the Dehydrogenative Routes[J]. Appl Catal,A,2010,380(1/2):113 - 117.
[10] Colley S W,Tabatabaei J,Waugh K C,et al. The Detailed Kinetics and Mechanism of Ethyl Ethanoate Synthesis over a Cu/Cr2O3Catalyst[J]. J Catal,2005,236(1):21 - 33.
[11] Elliott D J,Pennella F. The Formation of Ketones in the Presence of Carbon Monoxide over CuO/ZnO/Al2O3[J]. J Catal,1989,119(2):359 - 367.
[12] Inui K,Kurabayashi T,Sato S. Direct Synthesis of Ethyl Acetate from Ethanol over Cu-Zn-Zr-Al-O Catalyst[J]. Appl Catal,A,2002,237(1/2):53 - 61.
[13] Rioux R M,Vannice M A. Dehydrogenation of Isopropyl Alcohol on Carbon-Supported Pt and Cu-Pt Catalysts[J]. J Catal,2005,233(1):147 - 165.
[14] Inui K,Kurabayashi T,Sato S. Direct Synthesis of Ethyl Acetate from Ethanol Carried out Under Pressure[J]. J Catal,2002,212(2):207 - 215.
[15] Inui K,Kurabayashi T,Sato S,et al. Effective Formation of Ethyl Acetate from Ethanol over Cu-Zn-Zr-Al-O Catalyst[J].J Mol Catal A:Chem,2004,216(1):147 - 156.
[16] Fujita S I,Iwasa N,Tani H,at el. Dehydrogenation of Ethanol over Cu/ZnO Catalysts Prepared from Various Coprecipitated Precursors[J]. React Kinet Catal,2001,73(2):367 - 372.
[17] 赵树峰,丁培培,乔亏,等. 纳米Cu-Zr-O催化剂催化乙醇脱氢合成乙酸乙酯[J]. 工业催化,2009,17(1):43 - 45.
[18] Wang Lixia,Zhu Wanchun,Zheng Dafang,et al. Direct Transformation of Ethanol to Ethyl Acetate on Cu/ZrO2Catalyst[J]. React Kinet Mech Catal,2010,101(2):365 - 375.
[19] 王丽霞. 过渡金属基催化剂在乙醇合成乙酸乙酯反应中的催化性能研究[D]. 吉林:吉林大学,2010.
[20] Lippert S,Baumann W,Thomke K. Secondary Reactions of the Base-Catalyzed Aldol Condensation of Acetone[J]. J Mol Catal A:Chem,1991,69(1):199 - 214.
[21] Sagar G V,Rao P V R,Srikanth C S,et al. Dispersion and Reactivity of Copper Catalysts Supported on Al2O3-ZrO2[J]. J Phy Chem B,2006,110(28):13881 - 13888.
[22] Chary K V R,Sagar G V,Srikanth C S,et al. Characterization and Catalytic Functionalities of Copper Oxide Catalysts Supported on Zirconia[J]. J Phy Chem B,2006,111(3):543 - 550.
[23] Aguila G,Jimenez J,Guerrero S,et al. A Novel Method for Preparing High Surface Area Copper Zirconia Catalysts:Influence of the Preparation Variables[J]. Appl Catal,A,2009,360(1):98 - 105.
[24] 汤清虎. 含钴分子筛催化剂的合成、表征及催化性能[D].厦门:厦门大学,2004.
[25] Tanaka Y,Utaka T,Kikuchi R,et al. Water Gas Shift Reaction for the Reformed Fuels over Cu/MnO Catalysts Prepared via Pinel-Type Oxide[J]. J Catal,2003,215(2):271 - 278.
[26] Turco M,Cammarano C,Bagnasco G,et al. Oxidative Methanol Steam Reforming on a Highly Dispersed CuO/CeO2/Al2O3Catalyst Prepared by a Single-Step Method[J]. Appl Catal,B,2009,91(1/2):101 - 107.
[27] Breen J P,Ross J R H. Methanol Reforming for Fuel-Cell Applications:Development of Zirconia-Containing Cu-Zn-Al Catalysts[J]. Catal Today,1999,51(3/4):521 - 533.
[28] Turco M,Bagnasco G,Cammarano C,et al. Cu/ZnO/Al2O3Catalysts for Oxidative Steam Reforming of Methanol:The Role of Cu and the Dispersing Oxide Matrix[J]. Appl Catal,B,2007,77(1/2):46 - 57.

