水分胁迫对柑橘生理指标及JA 合成相关酶基因表达的影响
赵晓莉,卢晓鹏,聂 琼,黄成能,肖玉明,谢深喜*
(1.湖南农业大学 园艺园林学院,湖南 长沙410128;2.国家柑橘改良长沙分中心,湖南 长沙410128)
中国柑橘主要种植在南方灌溉条件较差的丘陵、山地一带,而这些地区7—10 月的季节性干旱明显,此时严重的干旱将会影响柑橘果实膨大及品质的形成,因此季节性干旱是影响中国柑橘优质高产的主要因素之一[1-2]。有研究表明,植物不完全是干旱的被动受害者,其在漫长的进化过程中,形成了具有主动适应和快速感知的能力,比如重要的次生代谢物质茉莉酸(Jasmonic acid,JA)就起到了信息传递的作用,参与植物的各种抗逆反应,提高了植物的抗逆性。目前已报道有关JA 的研究主要集中在拟南芥、水稻、番茄等模式植物在逆境条件下体内JA 含量的变化及合成途径相关酶基因的表达[3-4]。其中拟南芥AOS 基因在转基因植株中的过量表达没有改变JA 的基础含量,但是转基因植株受到伤诱导后,JA 的含量明显比对照高,表明伤诱导产生的JA 受到AOS 底物供应的控制,而不是受到AOS 蛋白的量的控制[5]。番茄试验中,受到伤诱导的叶片,AOC 转录水平迅速上升[6]。甜橙细胞在盐胁迫条件下优先诱导9 -LOX 基因表达[7]。目前已报道的涉及木本植物这方面的研究较少,而本研究以纽荷尔脐橙和山下红温州蜜柑为材料,来研究水分胁迫处理下柑橘叶片的生理特性、JA 含量及其合成途径相关酶基因表达量的影响,以期揭示JA 在响应水分胁迫途径中的作用和机制。
1 材料和方法
1.1 材料
以两年生枳砧纽荷尔脐橙[Newhall navel orange (Citrus.sinensis(L)Osbeck)]、山下红温州蜜柑[Yamasitaka(Citrus.unshin Marcov)]为试验材料,植株栽于国家柑橘改良中心长沙分中心的普通温室大棚。
1.2 试验设计
试验开始前正常浇水管理30 d,每天以Spectrum Field Scout TDR 300 型(美国,Spectrum)土壤水分仪测定土壤含水量,取平均值(体积比28%)即为正常土壤含水量。试验设4 个处理,分别为CK(正常土壤含水量),轻度胁迫处理(正常土壤含水量的75%),中度胁迫处理(正常土壤含水量的50%),重度胁迫处理(正常土壤含水量的25%),每个处理5 次重复。各水分胁迫处理植株每天测定1 次土壤含水量,并使之维持在设定的土壤含水量。采取水分胁迫处理与正常对照植株的春梢自顶端以下第3 -5 片叶作为试验样品,液氮速冻后保存于-80 ℃冰箱备用。
1.3 方法
1.3.1 生理指标的测定 植物游离脯氨酸的测定采用酸性茚三酮比色法,检测波长520 nm[8];可溶性糖的测定采用蒽酮乙酸乙酯比色法,检测波长为630 nm[9];叶绿素的含量测定采用李合生[10]的测定方法。
1.3.2 JA 含量的测定 JA 含量的测定方法参照Liu 等[11]的方法,略有改动。称取0.5 g柑橘叶片,用少量液氮研磨,用体积分数为80%甲醇在4 ℃下浸提12 h,12 800 g离心10 min,真空冷冻浓缩除去甲醇。残留物用pH=9.8的磷酸钠缓冲液溶解,加少量石油醚混匀,12 800 g离心5 min,上清液用石油醚萃取1 次,收集水相,用water Sep - Pak Vac C18 柱子进行萃取洗涤,然后加入体积分数为80%甲醇洗涤,再次收集水相,真空冷冻浓缩至干。用50 μL 50%甲醇溶解,离心5 min,然后取20 μL进样至液相色谱仪(色谱条件:美国生产的Agilent 1100液相色谱仪,200 nm紫外光检测),收集JA 粗样,浓缩至干。用100 μL 20%乙腈溶解浓缩物,12 800 g离心5 min混匀,然后注入质谱仪(Acquity uplc waters SAD)检测。

(1)式中:C 为测定JA 的浓度(ng·mL-1);V 为稀释体积(μL);D 为 μL 换算成mL 的倍数;W 为样品鲜质量(g)
1.3.3 总RNA 的提取与cDNA 的合成 总RNA 的提取采用TransZol Up 试剂使用说明(Trans Gen Biotech)。提取的总RNA 用10 g/L 琼脂糖凝胶电泳检测质量,紫外分光光度计测定OD260nm/OD280nm的比值。将RNA 用DNaseⅠ(TAKARA)处理后,再按照逆转录试剂盒(iScript cDNA Synthesis Kit)的使用说明合成所需用的cDNA。以合成的cDNA 为模板、Actin 为引物用普通PCR 扩增目的片段以检测cDNA质量。
1.3.4 JA 合成相关酶基因表达量的分析 CitLOX,CitAOS,CitAOC 基因定量PCR 的引物(表1)用Primer Express v 3.0(美国Applied Biosystems)软件设计,Actin 引物作为内参引物[12]。定量PCR 反应体系为10 μL:包含Supermix 5 μL,上、下游引物(10 μmol/L)各0.4 μL,cDNA 0.6 μL,最后加无菌水3.6 μL 至终体积10 μL,荧光定量PCR(Bio-Rad)扩增条件:首先95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火10 s,72 ℃延伸15 s,40 个循环,溶解曲线的条件50 ℃1 min,95 ℃1 min,每个处理设有4 个重复。
1.4 数据统计与分析
数据分析与统计使用SigmaPlot 10. 0 与Excel 2003 软件。
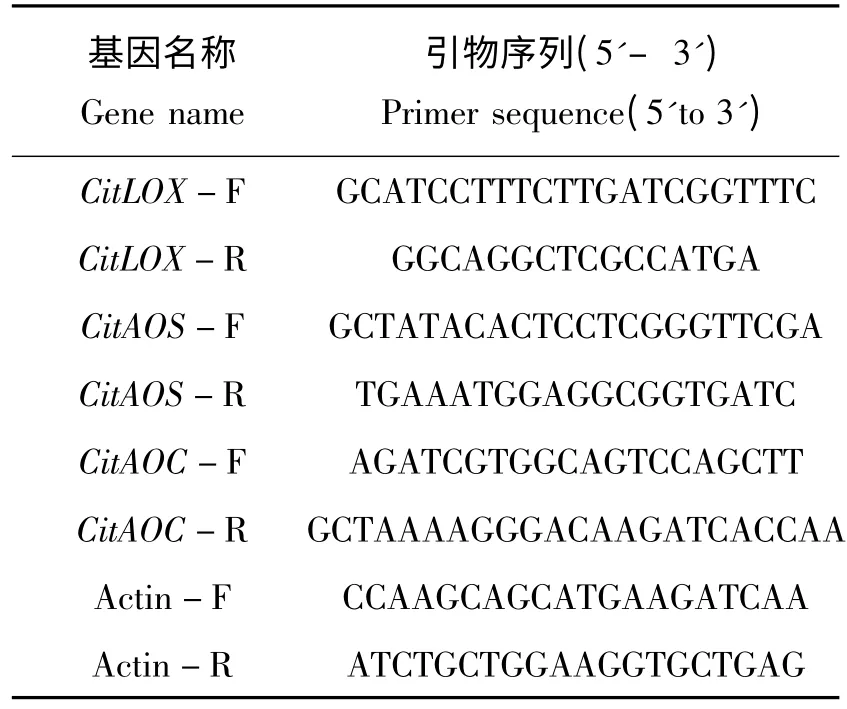
表1 实时荧光定量PCR 引物序列Tab.1 The primers Sequence of qRT-PCR
2 结果
2.1 水分胁迫对柑橘叶片脯氨酸的影响
试验结果表明,柑橘叶片脯氨酸的积累量随着水分胁迫处理程度的增加逐渐升高。
在重度水分胁迫处理时,纽荷尔脐橙与山下红温州蜜柑的脯氨酸含量达到最高,分别为1 004.02 μg/g 与880.55 μg/g,比正常对照分别提高了43.8%和38.6%。分析得出,在不同程度的水分胁迫处理条件下,纽荷尔脐橙的脯氨酸积累速度明显高于山下红温州蜜柑(图1)。
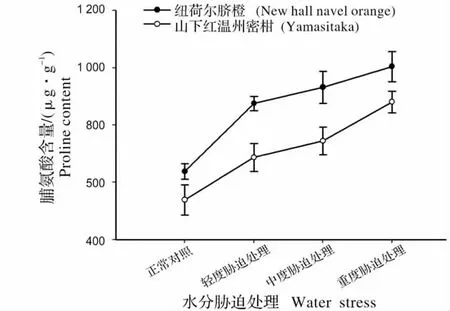
图1 不同水分胁迫处理下柑橘叶片脯氨酸含量Fig.1 Proline content of citrus leaves under water stress
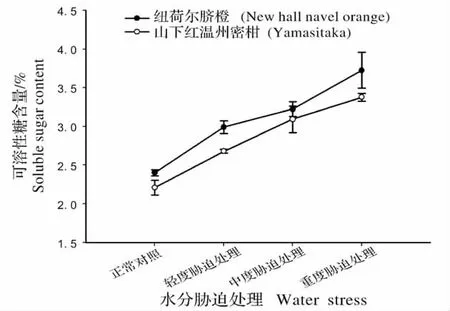
图2 不同水分胁迫处理下柑橘叶片可溶性糖含量Fig.2 Soluble sugar content of citrus leaves under water stress
2.2 水分胁迫对柑橘叶片可溶性糖的影响
由图2 可知,柑橘叶片可溶性糖含量,随着水分胁迫程度的增加,呈现逐渐上升的趋势。在轻度与中度水分胁迫处理条件下,纽荷尔脐橙与山下红温州蜜柑叶片中的可溶性糖增加缓慢,随着水分胁迫程度的增加,纽荷尔脐橙的可溶性糖含量迅速增加,而山下红温州蜜柑增幅较小。重度水分胁迫处理下,纽荷尔脐橙和山下红温州蜜柑的可溶性糖含量分别比正常对照增加了43.5%和36.4%。说明水分胁迫程度对柑橘叶片可溶性糖含量有明显的影响。
2.3 水分胁迫对柑橘叶片叶绿素的影响
随着水分胁迫处理,柑橘叶片的叶绿素含量降低,随着胁迫程度的增加,叶绿素含量降低的越多。
依据试验结果分析可知,重度水分胁迫时,纽荷尔脐橙叶绿素总量、叶绿素a 和叶绿素b 含量分别为2.12 mg/g、1.65 mg/g、0.57 mg/g与正常对照相比分别降低了0.65 mg/g、0.39 mg/g、0.22 mg/g;山下红温州蜜柑叶绿素含量分别为1.93 mg/g、1.63 mg/g、0.46 mg/g比对照组CK 降低了0.77 mg/g、0.35 mg/g、0.27 mg/g(图3)。依图可知,在水分胁迫处理下,纽荷尔脐橙的叶绿素含量总是高于山下红温州蜜柑,并且其叶绿素含量的下降幅度比山下红温州蜜柑慢。
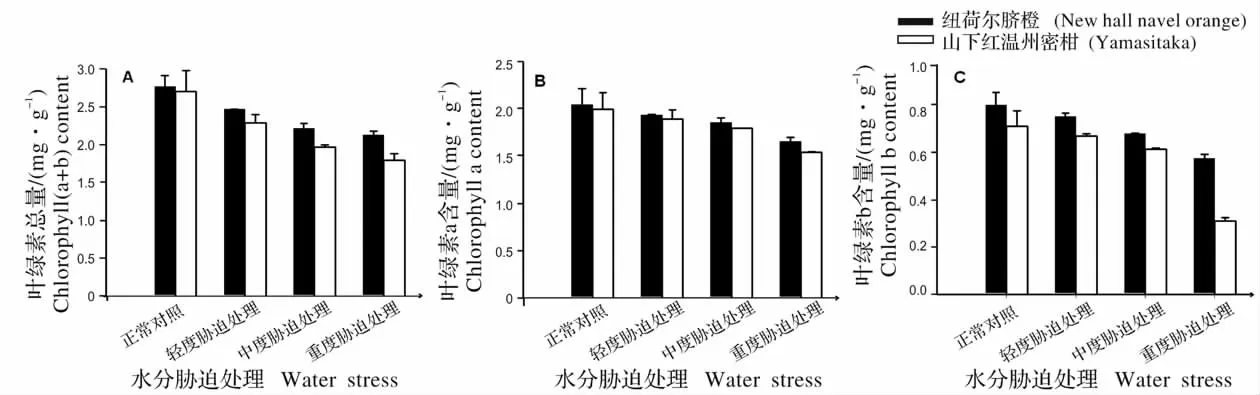
图3 不同水分胁迫处理下柑橘叶片叶绿素总量(A)、叶绿素a(B)、叶绿素b(C)含量Fig.3 Chl(a+b)(A),Chl a(B)and Chl b(C)content of citrus leaves under water stress
2.4 水分胁迫对柑橘叶片内源JA 的影响
柑橘叶片内源JA 的含量随水分胁迫处理程度加剧而明显增加(图4)。
轻度水分胁迫处理时,内源JA 的积累增幅缓慢;中度胁迫时,柑橘叶片JA 的积累增加明显;重度水分胁迫处理下,内源JA 含量的急剧增加,纽荷尔脐橙与山下红温州蜜柑的JA 含量分别为6.72 ng/g、3.58 ng/g 是正常对照的3 倍和2.86 倍。同时在不同程度的水分胁迫条件下,纽荷尔脐橙的JA 含量总是高于山下红温州蜜柑,且随水分胁迫程度的加剧,纽荷尔脐橙中的JA 含量增加速度高于山下红温州蜜柑。
2.5 水分胁迫对柑橘叶片内源JA 生物合成途径中相关酶基因表达量的影响
由图5 可知,JA 生物合成途径中的3 个相关酶基因:CitLOX,CitAOS,CitAOC 表达量在水分胁迫处理下有明显差异。
CitLOX 与CitAOC 基因在纽荷尔脐橙和山下红温州蜜柑中的表达量变化趋势相似,轻度水分胁迫下两个基因表达量最高,纽荷尔脐橙的CitLOX 基因表达量是对照CK 组的5.6 倍,CitAOC 的基因表达量是对照CK 组的1.7 倍;山下红温州蜜柑的CitLOX的表达量是对照组CK 的3.4 倍,CitAOC 的基因表达量是对照组CK 的1.6 倍。然而随着水分胁迫的加剧,CitLOX 与CitAOC 基因的表达量逐渐降低;CitAOS 基因表达量逐渐增加。在重度水分胁迫处理下时,CitAOS 的表达量最高,纽荷尔脐橙的和山下红温州蜜柑的CitAOS 基因表达量分别是正常对照的2.8 倍和3.1 倍。
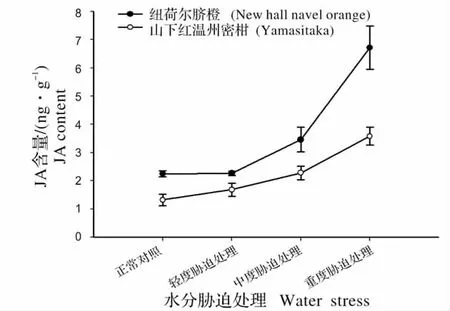
图4 不同水分胁迫处理下柑橘叶片JA 含量Fig.4 JA content of citrus leaves under water stress
2.6 CitAOS 基因表达量与JA 含量的相关性分析
柑橘叶片CitAOS 基因表达量与内源JA 含量进行相关性分析如下(图6)。
纽荷尔脐橙和山下红温州蜜柑的JA 含量变化与CitAOS 的基因表达量变化基本一致,其相关系数分别为0.936 8 和0.923 2,达到显著水平。说明CitAOS 基因在水分胁迫下对内源JA 的合成可能起到更为重要的作用。
3 讨论
水分胁迫条件下,植物体内会积累大量的渗透调节物质,如脯氨酸、可溶性糖等可以调节植物细胞内渗透压与外界平衡,维持渗透平衡和体内水分,保持细胞的完整性,减轻或消除逆境胁迫所造成的伤害[13]。本试验结果表明,随着水分胁迫程度的增加,柑橘叶片脯氨酸和可溶性糖含量逐渐增加,同已报道的水分胁迫对葡萄幼苗叶片生理指标影响的结果一致[14]。并且在相同水分胁迫处理条件下,纽荷尔脐橙的脯氨酸、可溶性糖的增加幅度高于山下红温州蜜柑,表明纽荷尔脐橙比山下红温州蜜柑较快的对缺水环境做出生理适应性反应。
有研究报道,水分胁迫能够使植物叶片的叶绿素含量降低,并且随着水分胁迫程度的加剧逐渐降低[15-16]。本研究结果表明,叶绿素总量、叶绿素a、叶绿素b 随着水分胁迫处理程度的加深而降低,说明水分胁迫严重影响了柑橘叶绿素生物合成途径,使叶绿素合成减少。
植物遇到干旱时,能够快速感知并主动适应干旱环境,其中JA 作为重要的信号物质参与了植物的抗逆反应[17]。有研究表明逆境诱导了JA 的积累,当植物体内不能有效合成JA 时,植物抗性将会大大降低[18]。本研究结果表明,在水分胁迫的条件下,柑橘的内源JA 含量随着水分胁迫处理程度的增加而增加,表明JA 作为信号调节物质参与了柑橘响应水分胁迫的全过程。本试验中内源JA 在纽荷尔脐橙中的积累量总是高于山下红温州蜜柑,表明不同的植物品种之间JA 的积累幅度不同,响应干旱信号的程度也不同。
植物在长期进化过程中,从胁迫信号的感知到基因表达产生适应方面,形成了一系列复杂的机制,以最大限度地减轻干旱胁迫造成的伤害[19]。在遇到虫害等逆境时,植物体内JA 及其衍生物显著增加,合成JA 相关酶的活性也发生变化,因而相关酶基因表达量也发生变化[20]。目前JA 生物合成途径已被阐明,首先以亚麻酸为底物,然后依次由LOX、AOS、AOC 催化,再经过还原反应与3 次β -氧化反应形成JA。合成JA 途径中所涉及的LOX、AOS、AOC 起到至关重要的作用,这些酶可以调控JA 的生物合成和植物的许多生理功能,也是植物诱导防御的重要信号分子[21]。伤害处理后的烟草,内源JA 含量升高后,其合成途径的相关酶基因LOX、AOS、AOC 在一定程度上表达量上调,说明JA 信号参与了基因的表达[22-23]。由本试验结果可知,当轻度水分胁迫时,柑橘快速感知了干旱胁迫,诱导CitLOX 与CitAOC 基因表达量增加,加速JA 合成,增加内源JA 积累;当植物处在中度水分胁迫环境时,外界环境对植株造成了更大的伤害,植物再次响应了水分胁迫信号,感应到外界环境的变化,使得CitAOS 表达量增加,同时内源JA 积累量也明显增加;但CitLOX 与CitAOC 基因的表达量明显降低,说明这两个基因在轻度水分胁迫环境时,对JA 生物合成起到主要作用。重度水分胁迫时,CitLOX 与CitAOC 基因的表达量显著降低;而CitAOS 基因表达量达到最高。通过分析表明,CitAOS 基因表达量与JA 含量呈显著正相关,说明在不同水分胁迫处理下,CitAOS 在调节JA 的生物合成过程中起到重要作用,促使JA 参与了柑橘响应干旱胁迫的全过程,适应干旱环境。所以,CitAOS 基因是调节JA 生物合成的一个更为关键的基因。
[1]Xie S X,Xiong X Y,Zhang Q M,et al.Water stress effects growth,relative water content,gas exchange and nitrogen pools of loquat[J].Acta Horticulturae,2007(750):261 -268.
[2]Xie S X,Zhang Q M.Kinetics of uptake and export of foliar-applied radio-labeled phosphorus by leaf and fruit rind of Satsuma Mandarin during fruit development[J].Journal of Plant Nutrition,2005,27(2):223 -237.
[3]吴劲松,种康.茉莉酸作用的分子生物学研究[J].植物学通报,2002,19(2):164 -170.
[4]李劲,萧浪涛,蔺万煌.植物内源激素茉莉酸类生长物质研究进展[J].湖南农业大学学报:自然科学版,2002,28(1):78 -84.
[5]Laudert D,Schaller F,Weiler E W.Transgenic Nicotiana tabacum and Arabidopsis thaliana plants overexpressing allene axide synthasa[J].Planta,2000,211:163 -165.
[6]Hause B,Stenzel I,Miersch O,et al.Tissue-specific oxylipin signature of tomato flowers:allene oxide cyclase is highly expressed in distinct flower organs and vascular bundles[J].Plant Journal,2000,24(1):113 -126.
[7]Gozal B H,Yardena G D,Orna A K,et al.Preferential induction of a 9 -lipoxygenase by salt in salt-tolerant cells of Citrus sinensis L.Osbeck[J].Planta,2001,212(3):367 -375.
[8]徐同,陈翠莲.植物抗逆测定(脯氨酸快速测定)法[J].华中农学院学报,1983,2(1):94 -95.
[9]郎晓娟.大豆在发芽过程中Vc、氨基酸、可溶性糖含量的变化[J].农业与技术,2011,31(3):22 -26.
[10]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000:7.
[11]Liu X,Yang Y L,Lin W H,et al.Determination of both Jasmonic acid and methyl Jasmonate in plant samples by liquid chromatography tandem mass spectrometry[J].Chinese Science Bulletin,2010,55(21):2231 -2235.
[12]刘庆.“暗柳”甜橙红色突变体性状形成的分子机理研究[D].武汉:华中农业大学,2008.
[13]周利,谢深喜,吴曼颖,等.水分胁迫下柑橘生理生态指标的变化[J].江西农业学报,2009,21(6):48 -51.
[14]赵薇,惠竹梅,林刚,等.硒对水分胁迫下赤霞珠葡萄幼苗叶片生理生化指标的影响[J].果树学报,2011,28(6):984-990.
[15]刘媛媛,周广柱.干旱胁迫条件下三种灌木抗旱特性研究[J].北方园艺,2011,34(8):88 -90.
[16]刘世秋,张振文,惠竹梅,等.干旱胁迫对酿酒葡萄赤霞珠光合特性的影响[J].干旱地区农业研究,2008,26(5):169-171.
[17]刘艳,蔡贵芳,成宇.茉莉酸类物质在植物伤反应中的信号功能[J].内蒙古农业大学学报,2011,32(4):354 -359.
[18]汪新文.茉莉酸参与植物逆境胁迫的研究进展[J].安徽农学通报,2008,14(6):29 -35.
[19]Xie S X,Zhang Q M,Xiong X Y,et al.Effect of water-desicit stress on plant gene expression[J].Journal of Hunan Agricultural University:Natural Sciences,2005,31(5):574 -579.
[20]Xu L,Zhou Q,Chen W. Effects of Jasmonic acid signal transduction induced rice resistance to insect[J]. Chin Sci Bull,2003,48(13):1442 -1446.
[21]刘丽艳,李传友,李柱刚,等.番茄受伤反应防御信号的遗传解析[J].东北农业大学学报,2005,36(1):23 -27.
[22]王文霞,李曙光,赵小明,等.壳寡糖对烟草悬浮细胞茉莉酸合成基因转录的影响[J].植物学通报,2008,25(5):526-532.
[23]Turner J G,Ellis C,Devoto A.The jasmonate signal pathway[J].The Plant Cell,2002,14:153 -164.

