有机/杂多酸-钕配合物的合成、表征及电化学性质研究
王小玉,蔡李鹏,吴 喆,田 瑶,曾 敏,王 娟,
(1.江西省科学院应用化学研究所,江西 南昌 330029;2.湖北科技学院基础医学院,湖北 咸宁 437100;3.湖北大学化学化工学院,湖北 武汉 430062)
江西省自然科学基金资助项目(2010GZH0054),湖北省自然科学基金资助项目(2012FFB00205) 收稿日期:2013-09-30
作者简介:王小玉(1964-),女,江西南昌人,副研究员,研究方向:应用化学;
通讯作者:吴喆,讲师,E-mail:wuzhecell@gmail.com。
doi
:10.3969/j.issn.1672-5425.2013.12.007
有机/杂多酸-钕配合物的合成、表征及电化学性质研究
王小玉1,蔡李鹏2,3,吴 喆2,田 瑶3,曾 敏3,王 娟1,3
(1.江西省科学院应用化学研究所,江西 南昌 330029;2.湖北科技学院基础医学院,湖北 咸宁 437100;3.湖北大学化学化工学院,湖北 武汉 430062)
采用水热法合成了以2,6-吡啶二羧酸及杂多酸磷钼酸为配体的钕的新型配合物Nd(C7H5NO4)(PMo12O40)·6H2O。通过元素分析、红外光谱、紫外光谱和热重分析对其进行了结构表征,结果表明,该配合物的紫外光谱在259 nm处有明显的吸收。采用循环伏安法对配合物进行电化学性质研究表明,在-0.8~-0.1 V的电势范围内,配合物具有电化学活性。
杂多酸;钕;配合物;电化学性质
近年来,金属-有机配合物由于在催化、气体储存、离子交换和吸附分离等方面的潜在应用价值备受亲睐。稀土金属钕具有独特的物理化学性质,它与有机配体合成的配合物在磁性材料、发光材料、电池材料等众多酸领域引起了广泛的关注[1-3]。钕的有机配合物及杂多酸配合物的合成已有文献报道[4,5],但是绝大部分研究都是针对有机配体与稀土金属钕、或者是杂多酸与稀土金属钕的配位合成[6-8]进行。作者在此尝试有机配体2,6-吡啶二羧酸与无机配体磷钼酸同时与稀土金属钕配位合成配合物,对其结构进行了表征,并进一步研究了配合物电化学性质。
1 实验
1.1 试剂与仪器
Nd(NO3)3·6H2O(化学纯)、Na2MoO4·2H2O(分析纯)、H3PO4(分析纯),国药集团化学试剂有限公司;2,6-吡啶二羧酸(分析纯),Johnson Matthey Company。试剂用前未处理。
Vario EL型元素分析仪,德国Elementar公司;Spectrum One NTS系列傅立叶变换红外光谱仪(KBr压片)、Lambda 35型紫外分光光度计、Diamond型TG-DTA仪(温度范围为室温到900 ℃,升温速率为20 ℃·min-1),美国Perkin Elmer公司。
1.2 合成方法
将0.1671 g(1 mmol) 2,6-吡啶二羧酸、0.2410 g(1 mmol)Na2MoO4·2H2O加热溶解于水,加2滴H3PO4,将0.2675 g(0.5 mmol)Nd(NO3)3·6H2O溶解在该溶液中,搅拌混合液至完全溶解,滴加H3PO4至pH值约为2.2。然后将混合液转移到有聚四氟乙烯内衬的不锈钢反应釜(规格25 mL,填充度为80%)中,于175 ℃反应5 d,缓慢冷却到室温。将反应釜中的溶液转移至烧杯,室温下自然挥发,15 d后有黄色粉末生成,将黄色粉末洗涤、干燥,即得配合物。
1.3 分析与表征
(1)对配合物分别进行元素分析、红外光谱分析、紫外光谱分析、热重分析。
(2)采用循环伏安法分析配合物电化学性质。循环伏安测量在电化学分析仪上进行,采用三电极系统:工作电极为铂电极,参比电极为石墨,辅助电极为铂电极;在-0.8~-0.1 V(vs.SCE)的电势范围内,以H2SO4水溶液为底液,扫描速率为500 mV·s-1。
2 结果与讨论
2.1 元素分析
元素分析结果:实验值(理论值),%:C 3.40(3.75);H 0.70(0.76);N 0.50(0.62)。可确定配合物的组成与Nd(C7H5NO4)(PMo12O40)·6H2O相符。
2.2 红外光谱分析(图1)
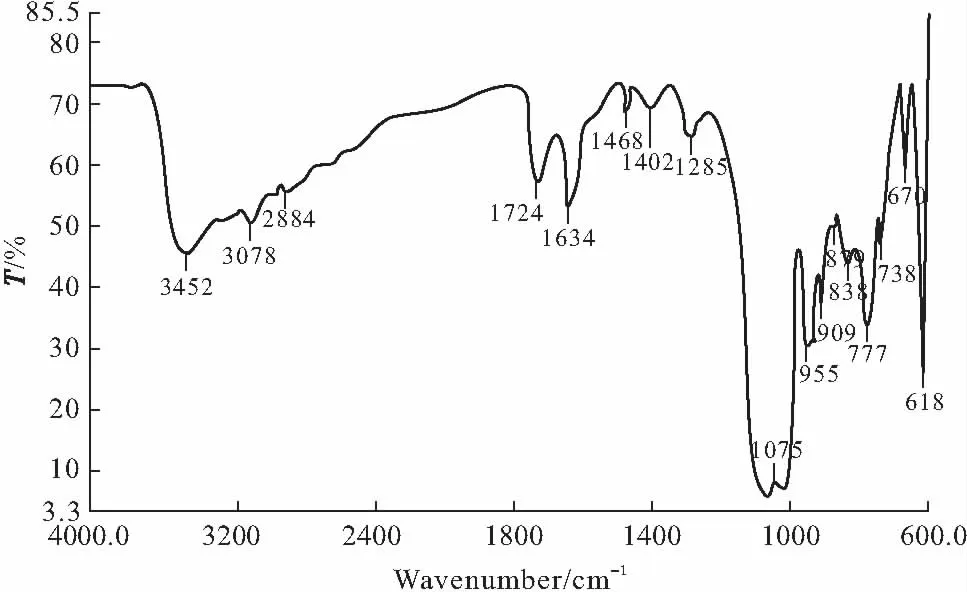
图1 配合物的红外光谱Fig.1 The IR spectrum of the complex
由图1可看出,3452 cm-1处为ν(O-H)的伸缩振动峰,说明配合物中有水分子存在;3078 cm-1处属于杂环中ν(C-H)的伸缩振动峰;1634 cm-1和1724 cm-1处出现配体羧基的νas(-COO)不对称伸缩振动峰;1402 cm-1和1285 cm-1处为配体杂环中νas(-C=N)的不对称伸缩振动峰,说明配体2,6-吡啶二羧酸参与了配位。文献报道[9-11],磷钼酸在700~1100 cm-1之间有4个特征峰,吸收位置分别为:1060 cm-1、960 cm-1、880 cm-1、780 cm-1,配合物的对应吸收峰在1075 cm-1、955 cm-1、879 cm-1、777 cm-1处,分别发生不同程度的蓝移和红移,表明配体磷钼酸和金属钕形成了配合物[12]。
2.3 紫外光谱分析(图2)

图2 配合物的紫外光谱Fig.2 The UV spectrum of the complex
由图2可看出,259 nm处出现了一个吸收峰。文献报道[13],配体2,6-吡啶二羧酸的紫外光谱在280 nm附近有吸收。由此可见,配合物在259 nm处出现的吸收峰是由配体2,6-吡啶二羧酸的π→π*跃迁引起的。
2.4 热重分析(图3)
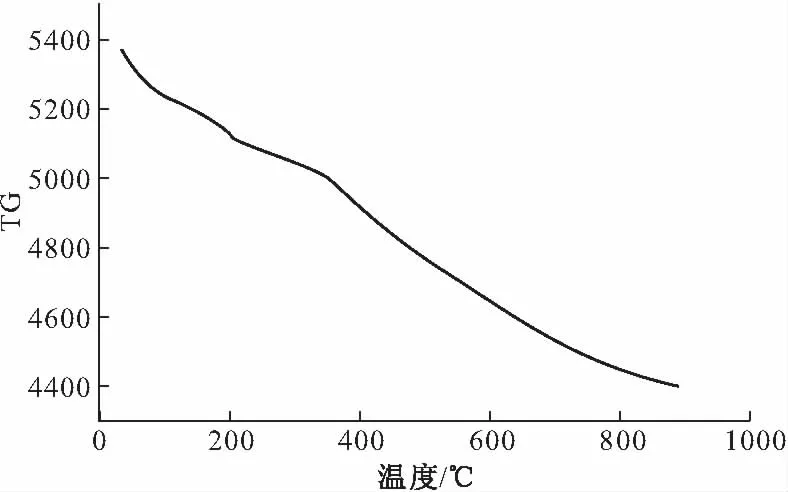
图3 配合物的TG曲线Fig.3 The TG curve of the complex
由图3可看出,配合物Nd(C7H5NO4)(PMo12O40) ·6H2O在室温到900 ℃范围内,共失重15.2%,失重分为两步:第一步,从室温到178 ℃,失重4.9%,失去6个结晶水;第二步,从207 ℃到576 ℃,失重8.1%,失去1个2,6-吡啶二羧酸分子,同时,杂多阴离子也开始分解。
2.5 电化学性质分析
配合物水溶液的循环伏安曲线如图4所示。

图4 配合物水溶液的循环伏安图Fig.4 The cyclic voltammetry diagram of the aqueous solution of the complex
由图4可看出,在-0.8~-0.1 V(vs.SCE)范围内出现了氧化还原峰,其峰电位Epa=-0.381 V、Epc=-0.478 V,电位差ΔEp=97 mV,对应的半波电位[14,15]Ep/2分别为-0.376 V和-0.423 V。ΔEp=97 mV>59 mV,表明反应为不可逆,根据公式|Ep-Ep/2|=47.7/αn,计算出反应可转移的电子数n=2,由此推测反应过程中得失电子的情况如下:

3 结论
以 2,6-吡啶二羧酸和磷钼酸的杂多阴离子为配体,合成了新型的钕配合物 Nd(C7H5NO4)(PMo12O40) ·6H2O,通过元素分析、红外光谱、紫外光谱、热重分析等对其进行了结构表征,在硫酸溶液中,该配合物在-0.8~-0.1 V(vs.SCE)电势范围内具有电化学活性。
[1] 蒋建生,杜红林,张文勇.电负性、原子赝势半径与稀土永磁材料[J].中国稀土学报,2003,21(3):286-289.
[2] 刘行仁,王晓君,何大伟.加入WTO 后我国稀土发光材料面临的机遇和挑战[J].中国稀土学报,2002,20(6):491-494.
[3] Fu X X,Yang Q H,Wang J Z,et al.Photocatalytic degradation of water-soluble dyes by LaCoO3[J].Journal of Rare Earths,2003,21(4):424,426-429.
[4] 伍爱明,张秋慧,肖蓉.芳香羧酸钕配合物的合成及其光谱性质研究[J].化学研究与应用,2011,23(4):418-423.
[5] 李冬成,姚克敏,曹美华,等.稀土元素与 3,4-二羟基苯甲醛缩邻氨基苯甲酸配合物的合成和表征[J].应用化学,1993,10(3):8-11.
[6] 陈敏,郑小明.稀土对 Keggin 结构磷钼酸催化剂结构和性能的影响[J].无机化学学报,2002,18(6):587-590.
[7] 刘宗绪,单永奎,王恩波,等.镝的钼硅杂多配合物的合成、结构和振动光谱[J].高等学校化学学报,1991,12(1):1-5.
[8] 苏进雄,何福兰,祁晓婷,等.钕-邻苯二胺配合物的合成、表征及性能研究[J].化学与生物工程,2011,28(4):36-38.
[9] Nomura M,Akagi K,Murata S,et al.Hydrocracking of polycyclic aromatic compounds using zeolite catalysts:Explanation of product distribution based on a computer aided molecular design study on the interaction of zeolite and substrates[J].Catalysis Today,1996,29(1-4):235-240.
[10] Breit B.Supramolecular approaches to generate libraries of chelating bidentate ligands for homogeneous catalysis[J].Angewandte Chemie International Edition,2005,44(42):6816-6825.
[11] Collman J P,Zhong M,Zhang C,et al.Catalytic activities of Cu (Ⅱ) complexes with nitrogen-chelating bidentate ligands in the coupling of imidazoles with arylboronic acids[J].The Journal of Organic Chemistry,2001,66(23):7892-7897.
[12] 周红波,陈友存.两种过渡金属配合物的合成和光谱表征[J].安庆师范学院学报 (自然科学版),2007,13(4):42-44.
[13] 范瑞清,王平,任锦宇,等.2,6-吡啶二甲酸镝配位聚合物的合成、晶体结构及其发光性能研究[J].光谱学与光谱分析,2011,31(7):1734-1738.
[14] 王卫东,谭祥中,尹华意,等.稀土(铕)-谷氨酸-邻菲罗啉三元配合物的光谱和电化学性质[J].光谱实验室,2008,25(2):143-146.
[15] 李东平,陈志敏,匡云飞,等.配合物[Cu(NPA)2(Im)2(H2O)]· H2O 的合成、晶体结构及电化学性质[J].无机化学学报,2007,23(5):892-896.
StudyonSynthesis,CharacterizationandElectrochemicalBehaviorofOrganic/HeteropolyacidNeodymiumComplex
WANG Xiao-yu1,CAI Li-peng2,3,WU Zhe2,TIAN Yao3,ZENG Min3,WANG Juan1,3
(1.InstituteofAppliedChemistry,JiangxiAcademyofSciences,Nanchang330029,China;2.SchoolofBasicMedicalSciences,HubeiUniversityofScienceandTechnology,Xianning437100,China;.CollegeofChemistryandChemicalEngineering,HubeiUniversity,Wuhan430062,China)
A novel complex Nd(C7H5NO4)(PMo12O40)·6H2O was constructed from polyoxoanion clusters and Nd(Ⅱ)-2,6-pyridinedicarboxylic acid coordination complex fragments under hydrothermal conditions.The complex was characterized by elemental analysis,IR,UV and thermal gravimetric analysis.The results showed that UV spectrum of the complex had a significant absorption at 259 nm.In addition,electrochemical behavior of the complex was studied by cyclic voltammetry and good electrochemical activity was observed in the range of -0.8~-0.1 V.
heteropolyacid;neodymium;complex;electrochemical behavior
O 611.3
A
1672-5425(2013)12-0032-03

