肝硬化结节多步癌演变的Gd+-EOB-DTPA 的磁共振表现
丁莺,饶圣祥,陈财忠,曾蒙苏
MRI检查技术的不断发展,肝小病灶(≤2.0cm)的检出率明显提高,尤其是乙肝、丙肝慢性肝炎以及肝硬化等患者,影像学定期随访特别是MRI可明显提高早期肝细胞癌(early hepatocellular carcinoma,eHCC)或小肝细胞癌(small hepatocellular carcinoma,sHCC)的检出率和诊断符合率,因此,MRI对提高肝细胞癌治疗有效率和生存率等具有十分重要的作用[1-3]。
肝硬化背景下的肝细胞癌(hepatocellular caicinoma,HCC)生成大多(>90%)经历了肝硬化结节的多步癌演变的过程,即再生结节(regenerative nodule,RN)、异型增生结节(dysplastic nodule,DN)、DN 癌变(或eHCC、sHCC)、进展期或晚期肝细胞癌的演变过程。相关研究表明这一系列变化中,约90%的病例伴随着肝细胞膜表面上有机阴离子转运系统[organic anion transporter,OATP(OATP8)]及多耐药蛋 白载体[multi-drug resistance protein,MRP(MRP2)]的数量减少和/或 转运能力下降[4]。
Gd+-EOB-DTPA 作为第一个应用于临床的靶向MRI对比剂,在诊断和鉴别肝硬化结节多步癌演变过程中具有独特的作用和优势[5-6]。
肝硬化结节多步进展的基本病理变化
肝硬化是以肝细胞变性、坏死、结节样增生、纤维组织增生和肝脏结构紊乱为特征的一种病理过程,但在近40 年的研究中,越来越多的临床研究结果表明HCC 实际上是一个连续的、多步骤进展的癌变病理过程。研究之初,学界对该概念较模糊,无法清晰区分或认识处于不同发展阶段的肝硬化结节。直到1995 年,国 际 肝 病 工 作 组(International Working Party,IWP)提出了现被广泛推荐并使用的分类标准,即把在慢性肝病(主要为乙肝或丙肝慢性肝炎)患者中发现的结节样病变定义为再生结节(regenerative nodule,RN)、低级别异型增生结节(low-grade dysplastic nodule,L-DN)、高 级 别 异 型 增 生 结 节(high-grade dysplastic,H-DN)及HCC结节这4个阶段[7-8]。另外,国际肝病工作组同时定义异型增生结节中肝细胞具有早期瘤样改变(早期瘤样改变指在周边肝硬化结节中有铁沉积的情况下异型增生结节中的铁沉积消失)。
RN 是在肝硬化基础上发生的局灶性增生,RN 直径多为0.3~1.0cm。RN 切面上多呈灰白色,镜下结构较致密,内含有正常的肝细胞、Kupffer细胞及胆小管结构,周围被硬化肝脏的粗糙纤维间隔所包围。
L-DN 是一种较RN 大的结节,直径常大于1.0cm,其色泽、质地及结构均不同于周围的肝硬化组织,其周边存在纤维疤痕。根据IWP的标准,DN 与RN 的本质差别不是在于大小而在于细胞异常和增殖模式。DN 为克隆增殖的结节,一个结节来自于一个变异肝细胞的克隆增殖;而RN 属于多细胞增殖结节,一个RN 结节来自于多个肝细胞的增殖。L-DN 没有真正的包膜,且表现为镜下细胞密度轻度增加,但不存在细胞异型性改变。对比周围肝组织,L-DN 梁索状结构十分明显,细胞质着色增加,透明度改变,假腺体形成,肝实质细胞脂肪变。LDN 内有时含有孤行动脉,但不存在“结中结”现象(即某一结节中央出现细胞结构和形态不同的更小结节)。除此之外,L-DN可有弥漫性的铁沉积及铜沉积。
H-DN 没有真正的包膜,但与L-DN 相比,其结节可能更大,但直径常小于1.5cm,结节境界模糊。H-DN 光镜下有明显的细胞异型性改变,细胞密度增加,且孤行动脉数量明显增多。H-DN 中不存在大细胞变,主要为小细胞改变,有时H-DN中可见“结中结”的存在,且其中心更小结节常发生癌变,病理学上常被视作早期肝细胞癌。
病理学上鉴别H-DN 与eHCC(也可被称为小的分化好的肝细胞肝癌)有一定难度。eHCC主要有以下病理特性:①与周围肝组织相比,细胞密度增加2 倍以上,伴有核/浆比的增加;②汇管区结节数量增加;③假腺体形成;④弥漫性脂肪肝;⑤孤行动脉数量明显增加。以上5个特征中,弥漫性脂肪肝出现在约40%的病例中。然而,以上5个特征也可同时在H-DN 中出现,因此,细胞间质的浸润被认为是H-DN 与eHCC 的重要鉴别特征[9-10],另外,eHCC几乎无微血管肿瘤浸润征象。
sHCC常表现为肿瘤直径小于2.0cm、肿瘤结节境界清楚、有或没有包膜、肿瘤内孤行动脉更加明显、结节内无汇管区,部分患者(27%)可见门静脉分支受肿瘤侵犯,部分患者(10%)可见肝内微小转移灶(<0.5cm)。进展期肝细胞癌常表现为门静脉分支受累更明显或肝内肿瘤结节超过3个,且总直径仍小于5.0cm;晚期肝细胞癌比进展期肝细胞癌更严重,常见门静脉2级分支以上受累或癌栓形成,肝静脉受累或癌栓形成,出现肝外脏器转移或淋巴结转移等。
肝硬化结节多步进展中的血供变化
近年来已有研究证实,随着肝硬化结节自RN 逐步向LDN、H-DN 演变,最后进展为eHCC 和sHCC,其中最为重要的改变为结节中血供发生转变,主要体现在门静脉血供的逐步减少或消失,异常动脉血供的增加,其组织学基础为血窦的毛细血管化、肿瘤新生血管生成及孤行动脉的增多,这种改变也是导致Gd+-EOB-DTPA 增强磁共振检查中各阶段结节动态增强表现不一的主要原因[11-12]。
RN 的血供与周围正常的肝组织相似,不存在孤行动脉,主要由门静脉供血。L-DN 中动脉血供逐步增多,门静脉供血逐步减少,但主要仍由门静脉供血,结节中可以含有极少量的孤行动脉。有研究表明,从H-DN 到eHCC,主要由门静脉供血的结节从68%下降到6%,动脉供血的结节由4%上升到94%,与此同时,孤行动脉的数量占总的动脉的比例也逐步增加[13]。
Gd+-EOB-DTPA 的基本原理及机制
Gd+-EOB-DTPA 是一种钆(gadolinium,Gd)与EOB-DTPA(ethoxybenzyl diethylenetriamine pentaacetic acid)螯合物的二钠盐,在钆-喷替酸匍甲胺(Gd+-DTPA)分子结构上添加了脂溶性的乙氧基苯甲基(ethoxybenzyl,EOB)而形成,通用名为钆塞酸二钠,商品名为普美显。该对比剂在国内的包装形式为10mL预灌装,经静脉注射(注射流率1~2mL/s,注射剂量0.025mmol/kg)之后再以相同的流率追加20~30mL 生理盐水,从而保证强化效果[14-15]。
Gd+-EOB-DTPA 独特的化学结构决定了其特有的生物学行为,一方面具有与Gd+-DTPA 类似的生物学特性,即低蛋白结合率和相对低分子量的亲水化合物,静脉注射后经血液到达肝脏,快速渗透过肝内毛细血管网而分布于细胞外间隙内并迅速达到平衡状态,由于分子中Gd+的存在,通过增加T1弛豫率(在1.5T 上其T1弛豫率约6.9)而缩短组织T1弛豫时间,可用作非特异性细胞外间隙对比剂,并通过肾脏排泄,与普通的钆剂具有相同的动态增强效果,从而能有效地观察慢性肝病结节的动态增强方式;另一方面,注射一段时间后,Gd+-EOB-DTPA 可通过肝窦面的肝细胞膜表面的OATP8,也即胆色素转运系统进入肝细胞内,可滞留数小时至24h,从而为磁共振检查提供了一个相当长的扫描时间窗,再通过主要位于胆道面的肝细胞膜上的MRP2 排泄入胆道系统[16-17]。肝细胞对Gd+-EOBDTPA 分子的特异性摄取和排泄入胆汁都与转运蛋白谷胱甘肽-S-转移酶有关,是一种非能量依赖的协助扩散转运途径,该配体特异性较低,Gd+-EOB-DTPA 和胆红素都对其有较高的亲和力[18]。对于具有正常功能的肝细胞而言,能通过肝细胞表面的OATP8吸收Gd+-EOB-DTPA,并通过肝细胞胆道面表面的MRP2排泄入胆道系统,而当肝细胞发生变性、脂肪变时,其表面的OATP8 及MRP2 通道会发生变化,导致肝细胞吸收Gd+-EOB-DTPA 的量发生变化,从而造成肝胆特异期慢性肝病患者不同阶段结节的不同信号改变。
Gd+-EOB-DTPA 的肝胆系统转运速率与给药剂量呈线性相关,但谷胱甘肽-S-转移酶具有较强的转运能力,临床研究表明当给予最大剂量(100μmmol/kg)时,Gd+-EOB-DTPA 的肝胆系统转运速率仍未达到饱和的最大速率,因此对于Gd+-EOB-DTPA 而言缺乏一个真正的平衡期,这也表现为经静脉给药之后磁共振检查的扫描时间窗维持较久[19]。经临床实验证明,Gd+-EOB-DTPA 在不同物种的肝胆系统中排泄率有较大的差异,大鼠为63%~80%,猴为32%~34%,而人的肝细胞吸收率约为50%,胆道排泄率与肾脏排泄率基本相同(为50%),且肝、肾对于Gd+-EOB-DTPA 的代谢存在竞争机制,当其中一种途径排泄受阻时可通过另一种途径得到代偿。在代谢循环过程中,Gd+-EOB-DTPA 的化学结构保持不变,用药后24h内即可完全从血浆中清除[20-21]。
肝硬化结节多步进展中Gd+-EOB-DTPA 磁共振检查的不同表现
在肝硬化背景下,RN 直径多为0.3~1.0cm,T1WI呈等或稍高信号,T2WI多呈低信号,这主要与结节周围含铁血黄素沉着或纤维间隔有关,含铁血黄素沉着使T2信号降低,而纤维间隔则由于炎性反应或扩张的血管导致含水量增加,在T2WI上呈稍高信号,从而导致RN 呈低信号[22]。由于RN 内不伴有孤行动脉,仍以门静脉供血为主,动态增强后RN 没有明显强化,在肝胆特异期由于RN 内含有正常的肝细胞,因此呈相对等信号(图1),该表现与DN 及早期HCC有明显的不同。
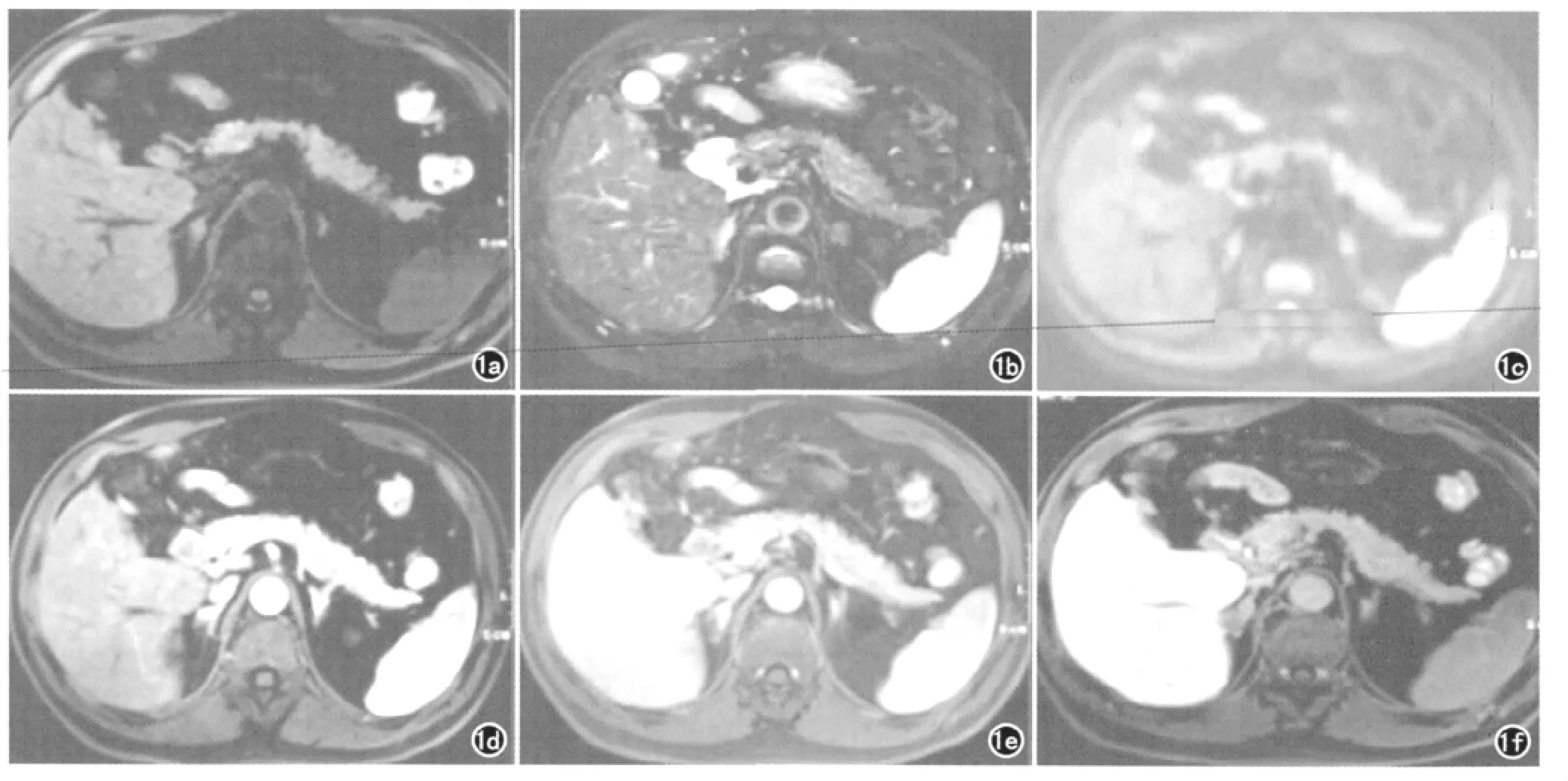
图1 男,48岁。肝右后叶RN。a)T1WI示肝右后叶一结节状异常信号灶,直径约0.9cm,呈高信号,边界尚清;b)T2WI示病灶呈等信号;c)DWI示病灶呈等信号;d)动态增强动脉期病灶无明显强化;e)动脉增强门脉期病灶仍无明显强化;f)肝胆特异期示病灶呈相对等信号。
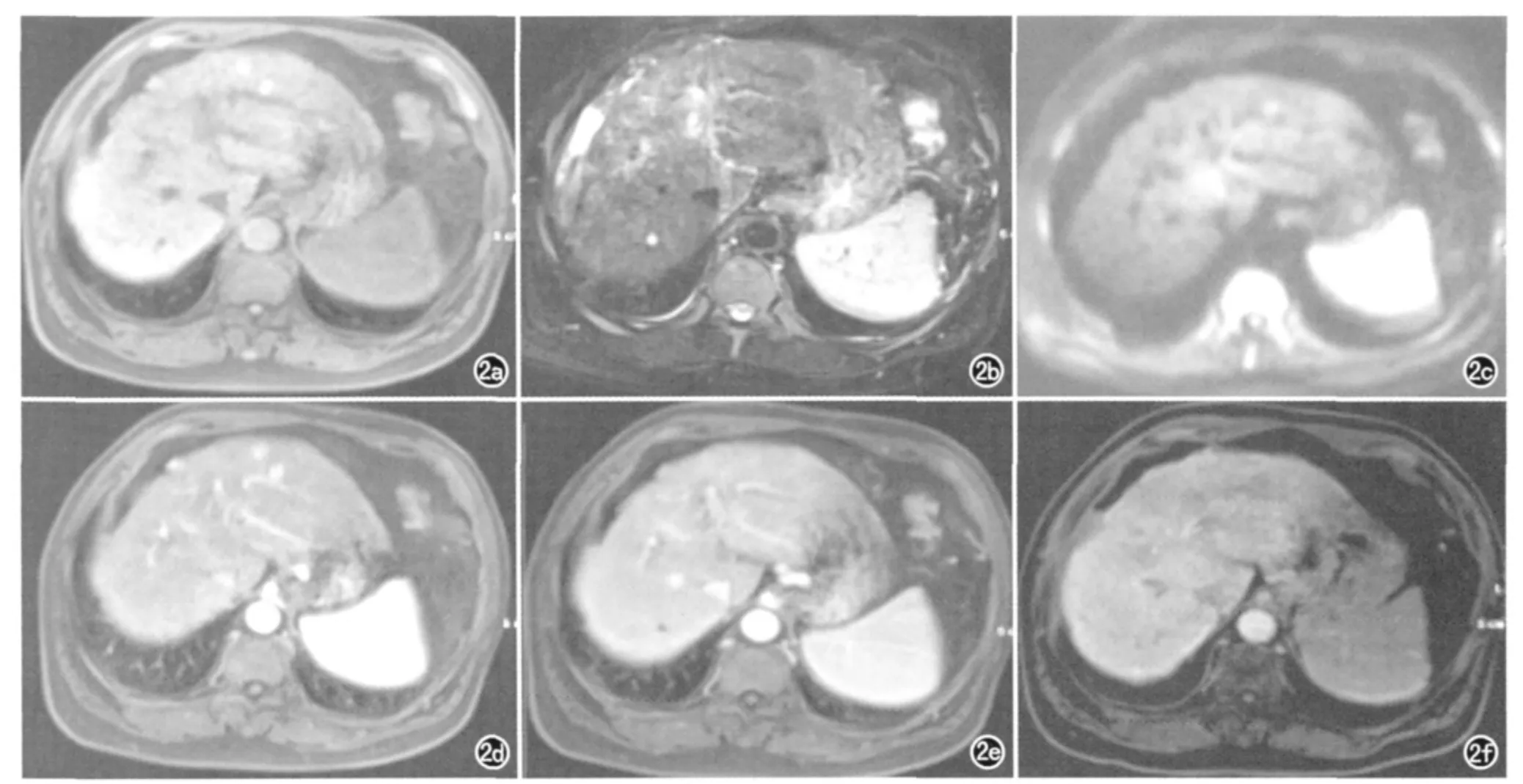
图2 男,61岁,肝左外叶H-DN。a)T1WI示肝左外叶一结节状异常信号灶,直径约1.0cm,呈高信号,边界清;b)T2WI示病灶呈等、稍高信号;c)DWI示病灶呈高信号;d)动态增强动脉期示病灶无明显强化;e)动态增强门脉期示病灶呈相对等信号;f)肝胆特异期示病灶呈相对低信号。
DN 是较RN 大的结节,在肝硬化背景下其直径多>1.0cm。DN 在T1WI上呈高信号,可能与铜沉积、细胞脂肪变性及透明细胞改变有关;DN 在T2WI上呈等、低信号,是由含铁血黄素沉着或周围大量含水的纤维间隔造成的。L-DN 与H-DN 病理上主要的区别在于前者仍以正常肝细胞、门静脉供血为主,而后者细胞异型性明显增多,逐步过渡到以动脉供血为主,除此以外,孤行动脉的数量后者明显高于前者,前者无或含有极少量的孤行动脉,且前者不含有结中结。动态增强后动脉期L-DN 可有轻度强化或无明显强化,门脉期及延迟期呈相对等信号,而肝胆特异期由于L-DN 仍以正常肝细胞为主,因此呈相对等信号。H-DN 较L-DN 有更多的动脉供血及孤行动脉,因此动脉期H-DN 多呈中度异常强化,门脉期及延迟期呈等、低信号,由于H-DN 仍含有部分的正常肝细胞,在肝胆特异期呈等、低信号(图2)。当H-DN 出现以下征象时,则要高度提示癌变:T2WI上由等、低信号逐步向稍高信号转变、出现结中结、动脉血供明显增加、出现间质浸润。
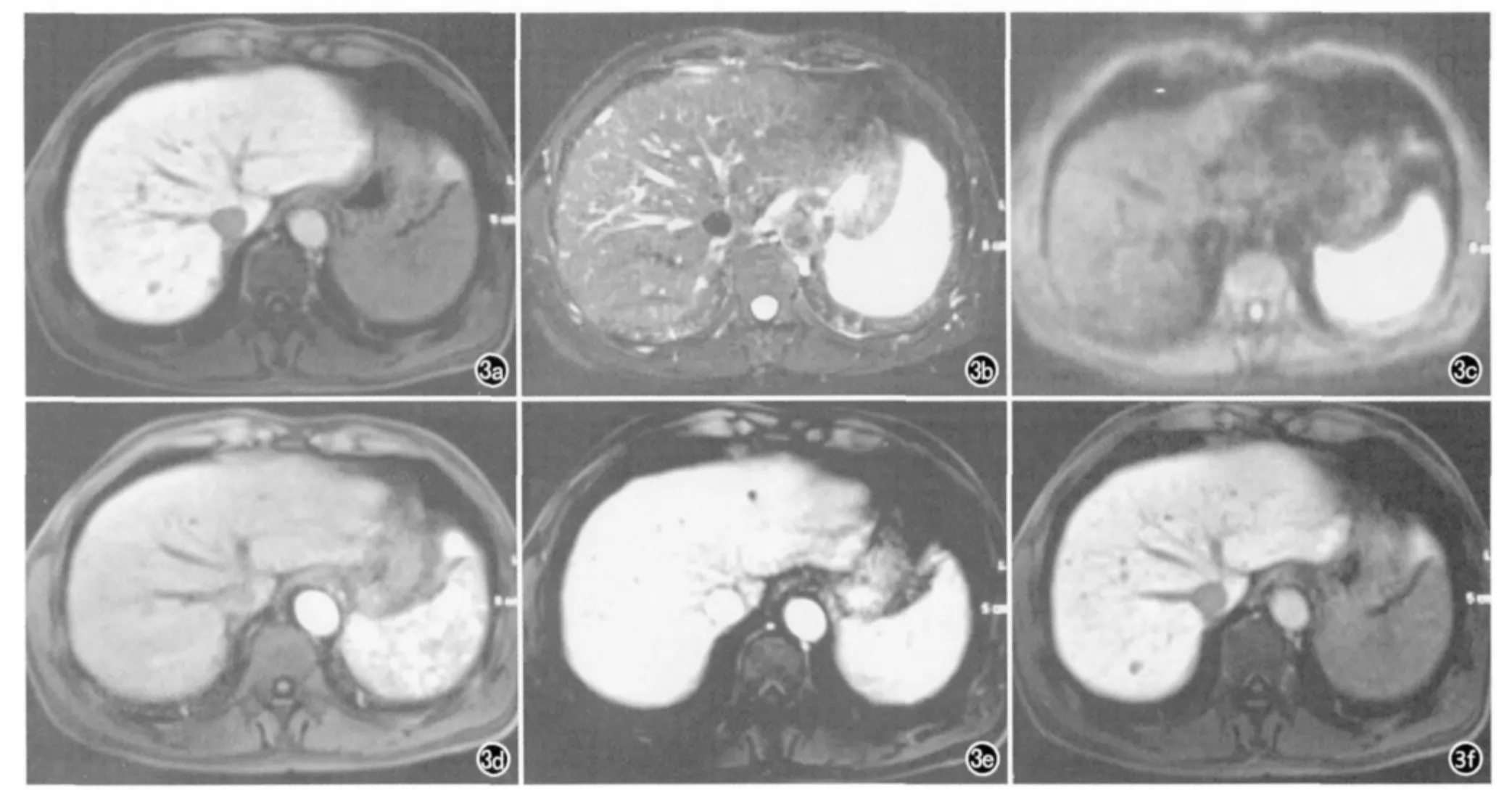
图3 男,53岁。肝右后叶eHCC。a)T1WI示肝右后叶一结节状异常信号灶,直径约0.8cm,呈低信号,边界清;b)T2WI示病灶呈稍高信号;c)DWI示病灶呈等、稍高信号;d)动态增强动脉期示病灶呈中度异常强化;e)门脉期示病灶呈稍低信号;f)肝胆特异期示病灶呈明显低信号,边界清。
eHCC在T1WI上多呈等、低信号,但有时也可呈稍高信号,其主要原因可能是结节内脂肪沉积、结节梗死或含水的纤维增多;eHCC在T2WI上多呈稍高信号,而DN 多呈等、低信号,这是鉴别DN 和eHCC的一个重要特征;eHCC 由于逐步过渡到主要由动脉供血,病灶内孤行动脉的数量明显增加,因此动态增强后具有“快进快出”的表现;而在肝胆特异期eHCC 内不含正常的肝细胞,从而呈明显低信号(图3)。如果病灶出现间质浸润,则可明确eHCC的诊断。
肝硬化结节由RN、L-DN、H-DN 到最后发展成eHCC,是HCC的一个多步进展癌变的过程,目前研究表明,RN 及L-DN仍主要由静脉供血、无或有极少量的孤行动脉、不含有结中结、无间质浸润,暂时不需要进行干预治疗。H-DN 动脉供血增加、可含有孤行动脉、细胞异型性增加,具有明显的恶变潜能,需引起重视,综合患者各方面条件采取一定的干预措施。当发展至eHCC时,则需进行有效的手术治疗。
目前各种常规影像学检查技术对有效区分L-DN、H-DN及eHCC,尤其是区分H-DN 和eHCC 仍存在一定困难。Gd+-EOB-DTPA 是双功能肝细胞特异性对比剂,能被正常肝细胞有效吸收。H-DN 含有正常的肝细胞,而eHCC 不含有正常的肝细胞,因此在肝胆特异期H-DN 可呈等、稍低信号,eHCC 呈明显低信号,除此之外,eHCC 动态增强扫描常呈明显的“快进快出”表现。
总之,Gd+-EOB-DTPA 磁共振检查具有与普通钆剂相类似的平扫、动态增强效果,再加上肝胆特异期检查,能有效观察和区分肝硬化结节的多步演变过程(即RN、L-DN、H-DN、eHCC和sHCC),从而可有效指导临床进行客观、准确、及时的干预治疗。
[1] Hussain SM,Zondervan PE,Uzermans JN,et al.Benign versus malignant hepatic nodules:MR imaging findings with pathologic correlation[J].Radiogaphics,2002,22(5):1023-1036.
[2] International Consensus Group for Hepatocellular Neoplasia.Pathologic diagnosis of early hepatocellular carcinoma:a report of the international consensus group for hepatocellular neoplasia[J].Hepatology,2009,49(2):658-664.
[3] Libbrecht L,Desmet V,Roskams T.Preneoplastic lesions in human hepatocarcinogenesis[J].Liver Int,2005,25(1):16-27.
[4] Choi JY,Kim MJ,Park YN,et al.Gadoxetate disodium-enhanced hepatobiliary pahse MRI of hepatocellular carcinoma:correlation with histological characteristics[J].AJR,2011,197(2):399-404.
[5] Renzulli M,Lucidi V,Mosconi C,et al.Large regenerative nodules in a patient with Budd-Chiari syndrome after TIPS positioning while on the liver transplantation list diagnosed by Gd-EOB-DTPA MRI[J].Hepatobiliary Pancreat Dis Int,2011,10(4):439-442.
[6] Narita M,Hatano E,Arizono S,et al.Expression of OATP1B3determines uptake of Gd-EOB-DTPA in hepatocellular carcinoma[J].J Gastroenterol,2009,44(7):793-798.
[7] Park YN,Yang CP,Fernandez GJ,et al.Neoangiogcoesis and sinusoidal“capillarization”in dysplastic nodules of the liver[J].Am J Surg Path,1998,22(6):656-662.
[8] International Working Party.Terminology of nodular hepatocellular lesions[J].Hepatology,1995,22(3):983-993.
[9] Hytiroglou P,Park YN,Krinsky G,et al.Hepatic precancerous lesions and small hepatocellular carcinoma[J].Gasteroenterol Clin N Am,2007,36(4):867-887.
[10] Kutami R,Nakashima Y,Nakashima O,et al.Pathomorphologic study on the mechanism of fatty change in small hepatocellular carcinoma of humans[J].J Hepatol,2000,33(2):282-289.
[11] Kitao A,Zen Y,Matsui O,et al.Hepatocarcinogenesis:multistep changes of drainage vessels at CT during arterial portography and hepatic arteriography radiologic pathologic correlation[J].Radiology,2009,252(2):605-614.
[12] Shimizu A,Ito K,Koike S,et al.Cirrhosis or chronic hepatitig evaluation of small(≤2cm)early-enhancing hepatic lesions with serial contrast-enhanced dynamic MR imaging[J].Radiology,2003,226(2):550-555.
[13] Matsui O,Kadoya M,Kameyama T,et al.Benign and malignant nodules in cirrhotic livers:distinction based on blood supply[J].Radiology,1991,178(2):493-497.
[14] Schuhm ann-Giampieri G,Schmitt-W illich H,Press WR,et al.Pre-clinical evaluation of Gd-EOB-DTPA as a contrast agent in MR imaging of the hepatobiliary system[J].Radiology,1992,183(1):59-64.
[15] Reimer P,Rummeny E J,Shamsi K,et al.Phase clinical evaluation of Gd-EOB-DTPA:dose,safety aspects and pulse sequence[J].Radiology,1996,199(1):177-183.
[16] Reimer P,Tombach B,Daldrup H,et al.New MR contrast media in liver diagnosis:initial clinical results with hepatocellular Eovist(gadolinium-EOB-DTPA)and RES-specific Resovist (SHU 555A)[J].Radiology,1996,36(2):124-133.
[17] Bluemke DA,Sahani D,Amendola M,et al.Efficacy and safety of MR imaging with liver-specific contrast agent:U.S.multicenter phase III study[J].Radiology,2005,237(1):89-98.
[18] Bollow M,Taupitz M,Hamm B,et al.Gadolinium-ethoxybenzyl-DTPA as a hepatobiliary contrast agent for use in MR cholangiography:results of an in vivo phase clinical evaluation[J].Eur Radiol,1997,7(1):126-132.
[19] Mhler A,Clement O,Saeed M,et al.Gadolinium-ethoxybenzyl-DTPA:a new liver directed magnetic resonance contrast agent absence of acute hepatotoxic,cardiovascular,or immunologic effects[J].Invest Radiol,1993,28(1):26-32.
[20] Ni Y,Marchal G,Lukito G,et al.MR imaging evaluation of liver enhancement by Gd-EOB-DTPA in selective and total bile duct obstruction in rats:correlation with serologic,microcholangiographic,and histologic findings[J].Radiology,1994,190(3):753-758.
[21] Raman SS,Leary Cand Bluemke DA,et al.Improved characterization of focal liver lesions with liver-specific gadoxetic acid disodium-enhanced magnetic resonance imaging:a multicenter phase 3 clinical trial[J].J Comput Assist Tomogr,2010,34(2):163-172.
[22] Hussain HK,Syed l,Nghiem HV,et al.T2-weighted MR imaging in the assessment of cirrhotic liver[J].Radiology,2004,230(3):637-644.

