18-β甘草次酸抑制KCl对大鼠脑中动脉的收缩作用
王蕊,马克涛,司军强,2,3,张传林,李丽
(1石河子大学医学院/新疆地方与民族高发病教育部重点实验室,石河子832002;2武汉大学基础医学院,武汉430071;3华中科技大学基础医学院,武汉430071)
缝隙连接(gap junction,GJ)是细胞间能直接进行物质和信息交换的通道[1]。其具有高通透性和非选择性,允许相对分子量小于1000的物质(包括第二信使Ca2+、IP3)及电流等通过[2]。在调节血管舒缩、血管平滑肌细胞增殖和平滑肌的表型转变中起着重要作用,并与高血压发生密切相关[3-4]。GJ在脑血管上对血管壁细胞间的信息传递起着重要作用,这对于直径小的阻力血管具有更重要的意义[4]。18β甘草次酸(18β-Glycyrrhetintic Acid,18βGA)是中药甘草的主要活性成分,也是一种强效的非选择性的缝隙连接阻断剂,广泛应用于生物学研究。在微动脉血管,18βGA能非选择性地抑制平滑肌细胞间、内皮细胞间以及肌内皮之间的缝隙连接(gap junction,GJ)[5]。
本研究应用压力肌动图技术观察缝隙连接阻断剂18βGA对Wistar大鼠脑中动脉的收缩活动的影响。
1 材料与方法
1.1 实验动物
实验所用Wistar大鼠(购自新疆医科大学实验动物中心,许可证编号SCXK新2003-0001)。体重在200~300g,雌雄不拘,清洁级。
1.2 溶液制备
生理盐溶液(Physiological Saline Solution,PSS)成分 (mmol/L)NaCl 119,KCl 4.69,MgSO4·7H2O 1.17,KH2PO41.18,CaCl22.5,NaHCO225,EDTA 0.026,葡萄糖5.5。将pH调至7.4。
K-PSS液成分(mmol/L)KCl 123.70,MgSO4·7H2O 1.17,KH2PO4 1.18,CaCl22.5,NaHCO225,EDTA 0.026,葡萄糖5.5。
1.3 脑中动脉标本制备
在麻醉后放血处死,迅速取出脑,置于含有95%O2和5%CO2的4℃饱和PSS液中,清除大脑中动脉旁的脂肪和脑膜,剪成2~3mm的血管段备用,在动物被处死到固定到记录系统上在45min内完成。
1.4 脑中动脉固定及活性检测
血管固定在两个玻璃微电极上,外径是125-150μm,用10-0号眼科尼龙线固定血管在(Pressure myograph system,DMT,110P,Denmark)水浴槽上,浴槽中持续通以95%O2、5%CO2的混合气体,管的远端封闭,形成一个无流动实验的状态,任何血管漏气时丢弃。DMT由一个摄像机和控制系统控制,血管直径的变化通过视频显微测量技术和一个校准视频尺寸分析仪来分析测量血管直径,测量单位是μm。血管压力从0mmHg上升到60mmHg,每隔5min上升10mmHg,直到60mmHg[6]。血管的压力维持在60mmHg,在温度37°C,pH 7.4的PSS液中孵育1h,每隔20min换一次PSS液。给予K-PSS液检测血管的活性,观察血管的收缩程度大于直径的1/3,稳定后再用10μmol/L乙酰胆碱(Acetylcholine,ACh)舒张,舒张率大于80%认为内皮完整,可用于实验。
1.5 实验药物
18-β 甘 草 次 酸、乙 酰 胆 碱 (Acetylcholine,ACh)购自Sigma公司,KCl等其余试剂均为国产分析纯试剂。
1.6 血管收缩率的计算和统计方法
血管直径收缩幅度变化公式D(μm)=DPDX,DP为血管在PSS中稳定时的直径,DX为血管加入不同浓度的药物时血管稳定后的直径,Dmax为血管加入药物后的直径收缩幅度最大值;血管收缩率(rate)=(DP-DX)/Dmax。应用SPSS17.0统计学软件进行统计学处理,以均数±标准差(S)表示,组内比较用单向(单因素)方差分析(one-Way ANOVA)。组间比较采用t检验,以P<0.05表示差异具有统计学差异。
2 结果
2.1 KCl浓度依赖性的引起脑中动脉收缩
结果如图1所示。

图1 KCl浓度依赖性的引起脑中动脉收缩(×100Bar∶70μm)Fig.1 KCl vasoconstriction range in concentrationdependent manner in MCA of rat(×100Bar∶70μm)
PSS液孵育后,给予不同浓度的血管收缩剂KCl(10~80mmol/L),可引起浓度依赖性的血管收缩。KCl浓度为30mmol/L时可明显观察到血管收缩,80mmol/L时血管直径收缩接近最大值(图1a、b)。
10~80mmol/L的KCl引起血管收缩幅度分别为1.6±1.2、5.9±2.5、30.7±7.0、49.2±5.8、64.7±4.1、79.4±4.0、83.8±3.6和84.8±3.7 μm(n=7)(图1a、b)。
KCl收缩率曲线呈“S”型(图3c)。当KCl浓度≥30mmol/L时,血管收缩直径变化率与PSS液对照相比有统计学差异(P<0.05,n=7)。
2.2 18β-GA可浓度依赖性的引起脑中动脉收缩
血管孵育完成后,分别向浴槽中加入终浓度为3μmol/L、10μmol/L、30μmol/L 和100μmol/L的18β-GA,血管直径从248.4±7.4μm(n=8)分别收缩到240.2±6.7、227.8±8.0、203.1±8.6和161.3±5.6μm,用PSS液冲洗后,血管直径可恢复至232.4±7.0μm(图2a)。图2b显示,当18β-GA≥10μmol/L时,与PSS液对照相比,血管收缩直径变化率差异有统计学意义(*P<0.05,**P<0.01,n=8)。
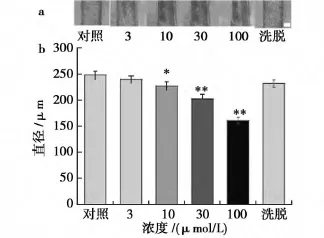
图2 18βGA浓度依赖性的引起脑中动脉收缩(×100Bar∶80μm)Fig.2 18βGA vasoconstriction range in concentrationdependent manner in MCA of rat(×100Bar∶80μm)
2.3 18βGA抑制KCl引起的血管收缩
100μmol/L的18βGA预孵育大脑中动脉20 min后,10~80mmol/L的KCl引起的血管收缩幅度分别为5.0±2.4、7.8±4.0、28.6±6.0、51.6±5.4、54.4±5.8、55.9±5.7、56.8±6.2和59.4±6.7μm(图3a、b)。不同浓度的KCl虽仍能浓度依赖的引起血管收缩,但与未加入18βGA相比,其收缩率曲线在50~80mmol/L之间发生明显下移,差异具有统计学意义(P<0.05,n=5~7)(图3c)。孵育18βGA前后KCl引起血管收缩的EC50分别为38 mmol/L和30.7mmol/L,两者之间的差异无统计学意义(P>0.05,n=5~7)(图3c)。
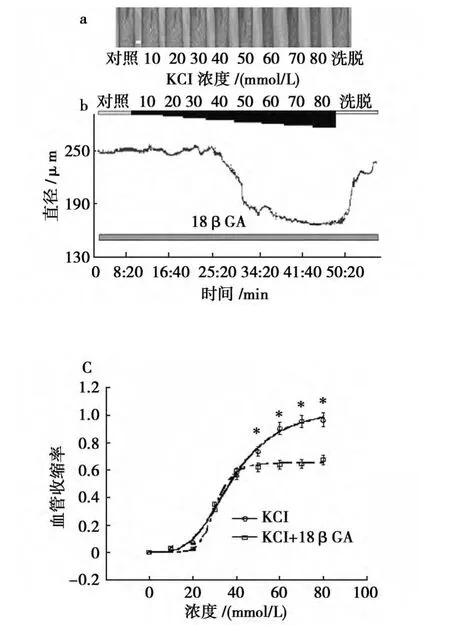
图3 18βGA抑制KCl引起的脑中动脉血管收缩(×100Bar∶70μm)Fig.3 18βGA suppressed vasoconstriction by KCl in MCA of rat(×100Bar∶70μm)
3 讨论
我们的实验发现:KCl和18βGA可分别浓度依赖性的引起脑动脉血管收缩,但用100μmol/L的18βGA孵育血管20min后,KCl引起的血管收缩反应被明显抑制。
众所周知,钾离子通道被激活开放后,钾离子外流,引起平滑肌细胞膜的超极化或舒张。当细胞外的钾离子浓度增加时,钾离子外流减少,引起平滑肌细胞的去极化,导致血管收缩[7]。阻力血管中平滑肌细胞间的缝隙连接通讯参与血管肌张力的调节[8]。组成细胞间缝隙连接蛋白的结构变化或功能受损,使细胞间通讯发生障碍,可影响血管细胞间的同步活动,引起血管紧张度发生改变[4]。已有研究表明5~10μmol/L 18βGA可增加兔小动脉平滑肌细胞膜输入电阻,并使部分平滑肌细胞钙瞬变去同步,这一结果与我们实验室前期在豚鼠肠系膜动脉上的结果一致[9]。Yamamoto等应用全细胞膜片钳技术发现,40μmol/L的18βGA能快速阻断豚鼠肠系膜微动脉内皮细胞和平滑肌细胞之间的电偶联,且在这一浓度时不会明显影响细胞膜上其他离子通道的功能[10]。Paolo Santicioli等应用蔗糖间隙技术发现,在豚鼠的肾盂和输尿管上,3~30μmol/L的18βGA呈浓度和时间依赖性的抑制电刺激诱发的动作电位,并减弱电刺激诱发的血管收缩[11]。而我们的实验在单独给予脑动脉血管3~100μmol/L的18βGA呈现浓度依赖性的血管收缩,这些结果的不同可能是由于实验动物种属和微动脉部位不同造成的。Vladimir V等应用张力肌动技术发现,10~30μmol/L的18βGA呈浓度依赖性的减弱去甲肾上腺素和高钾诱导的大鼠肠系膜微动脉血管的收缩,同时他们应用膜片钳技术还发现,30μmol/L的18βGA明显增强豚鼠肠系膜微动脉单个平滑肌细胞外向电流,也抑制钙离子通道,减少细胞内钙离子浓度,舒张小动脉[9],表明高浓度的18βGA对血管平滑肌细胞可能具有其他非特异性的作用[10]。本实验发现,100μmol/L的18βGA显著抑制高钾引起的血管收缩。另外,我们前期的膜片钳研究也发现,100μmol/L 18βGA不仅能完全阻断血管平滑肌细胞间的缝隙连接,而且还能增加血管平滑肌细胞的、四乙胺敏感的外向电流[12],结果提示100 μmol/L 18βGA可以激活大电导钙激活钾通道(Large-Conductance Calcium-Activated Potassium Channels,BKCa channel,BKCa)介 导 的 外 向 电流[13]。已知BKCa通道是血管平滑肌细胞上具有负反馈调节血管张力的重要的离子通道,BKCa通道激活后,钾离子外流增加,细胞膜超极化,从而引起血管舒张[14],抵消了部分细胞外高KCl引起的收缩作用。
总之,本研究发现不同剂量的18βGA对脑动脉血管平滑肌细胞发挥的作用不同,鉴于18βGA作用的复杂性,因此不能将18βGA作为单一的缝隙连接阻断剂。
[1]Alonso P M.Connexin phosphorylation as a regulatory event linked to channel gating[J].Biochim Biophys Acta,2005,1711(2):164-171.
[2]Brink P R,Ricotta J,Christ G J.Biophysical characteristics of gap junctions in vascular wall cells:implications for vascular biology and disease.Braz[J].Med Biolog Res,2000,33(4):415-422.
[3]Kansui Y,Fujii K,Nakamura K,et al.Angiotensin II receptor blockade corrects altered expression of gap junctions in vascular endothelial cells from hypertensive rats Am[J].Physiol Heart Circ Physiol,2004,287(1):216-224.
[4]王恩帮,钟华,罗小林,等.缝隙连接在同型半胱氨酸介导的高血压大鼠血管平滑肌细胞增殖中的作用[J].石河子大学学报:自然科学版,2011,29(4):475-478.
[5]Figueroa X F,Isakson B E,Duling B R.Connexin:Gaps in our knowledge of vascular function[J].Physiology(Bethesda),2004,19(5):277-284.
[6]马克涛,李新芝,李丽,等.18β-甘草次酸抑制微动脉平滑肌细胞外向电流[J].生理学报,2011,63(6):549-554.
[7]蒋学伟,马克涛,李丽,等.微小动脉血管离体标本的直径测量技术[J].石河子大学学报:自然科学版,2013,31(2):202-205.
[8]Joanne M D,John P B,Philip D L.Potassium does not mimic EDHF in rat mesenteric arteries[J].British Journal of Pharmacology,2000,130:1174-1182.
[9]Vladimir V M,Awahan Rahman,Christian Aalkjær Junctional and nonjunctional effects of heptanol and glycyrrhetinic acid derivates in rat mesenteric small arteries[J].British Journal of Pharmacology,2004,142(6),961-972.
[10]Yoshimichi Yamamoto,Hiroyasu Fukuta,Yoko Nakahira,et al.Blockade by 18β-glycyrrhetinic acid of intercellular electrical coupling in guinea-pig arterioles[J].Journal of Physiology,1998,511(11):501-508.
[11]Paolo Santicioli,Carlo A M.Effect of 18β-glycyrrhetinic acid on electromechanical coupling in the guinea-pig renal pelvis and ureter[J].British Journal of Pharmacology,2000,129:163-169.
[12]Li X Z,Si J Q,Liu Z J,et al.Inhibitory effect of 18βglycyrrhetinic acid on gap junction of vascular smooth muscle cells in guinea pig[J].Jilin University(Medicine Edition),2011,37(3):413-417.
[13]陈新燕,马克涛,李丽,等.18β-甘草次酸对 Wistar大鼠和自发性高血压大鼠脑微动脉平滑肌细胞缝隙连接的影响[J].中国应用生理学杂志,2013,29(2):181-184.
[14]李新芝,司军强,李丽,等.18β-甘草次酸对豚鼠微动脉平滑肌细胞BKCa通道的增强作用[J].石河子大学学报:自然科学版,2011,29(4):479-482.

