硅对叶螨危害后棉花防御酶活性的调控作用及其与抗虫性的关系
狄浩,赵伊英,褚贵新,梁永超,2
(1石河子大学农学院/新疆兵团绿洲生态农业重点实验室,石河子 832003;2中国农业科学院农业资源与农业区划研究所,农业部植物营养与肥料重点试验室,北京 100081)
棉花是新疆农业的支柱性产业,病虫害问题严重制约了新疆棉花产业的发展。土耳其斯坦叶螨(Tetranychus turkestani Vgorag et Nikolski)是新疆螨类的优势种,其危害所造成的损失严重制约了新疆棉花产量和品质[1]。目前棉田螨类的防治主要以化学防治为主,但是大量的农药使用量,不仅造成环境和土壤的污染,而且使螨类的抗药性日益增强,造成再猖獗。叶螨危害致使棉花生理和代谢发生紊乱是造成棉花减产的内在因素。据报道,叶螨的危害对寄主的影响主要表现在对寄主生理的影响[2]。由于昆虫危害的影响,植物往往能产生有利于自身而不利于害虫的变化,从而避免或减轻虫害。大量的证据表明施用硅肥可提高植株的含硅量,从而增强植物对植食性昆虫的抗性[3-4]。硅的抗虫机制是其"机械或物理屏障"作用,但近些年来的研究显示,硅可能参与了植物的生理代谢过程,激活了植物的防卫机制,对硅的物理屏障作用这一假说提出了质疑。昆虫取食诱导植物产生的防卫机制是多方面的,其中包括了对与昆虫有毒的酚类物质代谢有关的多酚氧化酶(PPO)、与植保素形成有关的苯丙烷类代谢途径中的酶苯丙氨酸解氨酶(PAL)以及与之相关的过氧化物酶(POD)的变化。李玉泉等[5]研究发现,豇豆幼苗叶片在受到朱砂叶螨的刺吸后,PPO、POD和PAL三种酶的活性均有不同程度的升高。Gomes等[6]施用硅酸钙到被蚜虫侵害的小麦,明显提高了3个植物防御酶系(PPO、POD和PAL)的活性水平,并抑制了蚜虫种群的扩繁。
虽然硅对植物生长的必需性尚未证实,但硅是植物生长的有益元素,尤其是其抗非生物胁迫和生物胁迫(病虫害)的功效卓著[7-8]。但是,目前国际上硅提高植物抗病虫害的研究主要集中在植物病害领域,而对硅提高植物抵御虫害的研究甚少,特别是硅对棉花抗叶螨为害的研究仍是空白。因此,本试验拟研究施用硅肥对棉花叶螨危害的影响及其生理响应机制,旨在为硅提高作物抗虫害机制提供理论基础,指导农业生产中如何施用硅肥提高植物自身抗虫害能力,减少农药使用,以提高生态环境的安全性。
1 材料与方法
1.1 材料
供试作物:新陆早33号(石河子瑞丰种子公司)。
供试叶螨品种:土耳其斯坦叶螨(Tetranychus turkestani(Ugarov & Nikolski))成螨,采自石河子市市郊,然后接种于温室棉花上任其繁殖,保证螨源。
供试硅源:分析纯的Na2SiO3·9H2O(中国精化科技研究所)。
供试土壤:土壤类型为灌耕灰漠土,质地中等,有机质16.5g/kg,土壤pH 值8.05,全氮1.25g/kg,速效磷17.45mg/kg,速效钾198.5mg/kg,有效硅含量183.64mg/kg。
1.2 方法
1.2.1 试验设计
本试验于2012年在石河子大学农学试验站(45°19′N,86°03′E)网室中进行微区试验。小区设计:宽幅1.45m,地膜种植4行,行距30cm-50cm-30cm,株距10cm,面积2.0m×0.5m=1m2。小区间用塑料农膜包埂,以减少侧渗、串流。灌溉方式为淹灌(在棉花2片子叶展开时灌溉1次,灌溉量为150m3/hm2),试验中栽培管理措施同当地大田生产,并保持各试验处理一致。
试验分为接螨(即受叶螨为害)和不接螨2种条件,采用基施硅和喷施硅肥2种施肥处理方式,以及不施硅处理作为对照:1)接螨,不施硅(CK+P);2)接螨,基施硅(J+P);3)接螨,喷施硅(P+P);4)不接螨,不施硅(CK-P);5)不接螨,基施硅 (J-P);6)不接螨,喷施硅 (P-P)。2种施肥处理方式具体做法:基施硅的处理是在棉苗两叶一心时随水基施(硅酸钠,0.725g/m2);喷施硅的处理是在棉花幼苗分别展开第2、3、4片叶和接螨前时喷施叶面4次(1.7 mmol Si/L),各处理的喷施量均为20mL,pH值为6.0。共计6个处理,每个处理重复3次,每个重复20棵苗。
设计虫口密度为30头/叶,各小区选取长势一致的棉花苗,在第5片叶展开后在第4、5片真叶接种成螨,做网罩罩住,并在叶柄处涂以凡士林,以防止叶螨逃逸,每天检查成螨量,如有死亡或逃逸及时补充。分别于接螨后的第2天和第6天只剪取第5、6片叶片,确保各处理之间使用相同叶龄的叶片用于测定,每处理随机取5株棉花,取样前用细毛笔把叶片上的叶螨除去(去除叶螨时保证叶螨口器或其它器官不残留在叶片上),取样后立即在液氮中速冻10min,然后迅速转移至-80℃超低温冰箱中冷冻储藏,用以分析各项生理生化相关指标备用。
1.2.2 测试项目与方法
1.2.2.1 受害指数调查
参照张建萍等[9]的方法。根据整株棉花的被害状分级:0级,无叶螨无被害状;1级,有叶螨尚无被害状(轻微);2级,叶片有一部分浅黄色斑点(中等);3级,叶片大部分有褐黄色斑点,并有少数红色斑(重);4级,叶片大部分呈红褐色斑,干枯,甚至脱落(极重)。
受害指数(E)=(0×0级样本数+1×1级样本数+ΛΛ+最高级×最高级样本数)/(总样本数×最高级别数)×100。
1.2.2.2 棉花干物质积累量的测定
各处理的每个重复随机选取3株棉花幼苗,植株取样后,将植株用蒸馏水冲洗干净,再用吸水纸擦干,测定鲜重,然后分装入取样袋中,在烘箱105℃杀青30min,75℃烘48h,烘干后称重测定干重。
1.2.2.3 植株硅含量测定
硅含量测定根据王继朋等[10]的方法测定。
将待测样品在75℃烘干至恒重,称取0.3g装入瓷坩埚中,将样品放入马福炉,300℃预灰化3h后升温至550℃连续烘4h,直到样品呈灰白色。将充分灰化的样品用50mL 0.08mmol/L的H2SO4转移至聚乙烯瓶中,加入40%的氢氟酸2mL,连续震荡1h后,在室温下过夜,所得溶液即为原液。吸取2mL原液于100mL的聚乙烯瓶中,加入3.2%的H3BO3溶液50mL,震荡1.5h以除去过量的HF,所得溶液为硅待测液。吸取10mL待测液于25mL容量瓶中,加入5mL显色剂(由0.08mol/L H2SO4和2.0%钼酸铵溶液组成的1∶1混合液)放置5min后,1次加入3.3%酒石酸溶液5mL和0.4%抗坏血酸溶液5mL,用高纯水定容,显色一定时间后在811nm波长下比色。
1.2.2.4 过氧化物酶(POD)活性的测定
参照马丽等[11]的方法酶液提取:称取待测植株样0.5g于预冷的研钵中,取样前用细毛笔把叶片上的叶螨除去(去除叶螨时保证叶螨口器或其它器官不残留在叶片上);加入50mmol/L磷酸缓冲液(pH 7.8)和少量石英砂研磨成匀浆后,转入离心管中,在4℃条件下10000r/min离心15min,上清液即为酶液。
活性测定:反应体系包括0.9ml 0.05mmol/L磷酸缓冲液(pH 7.8)、1.0mL 2%的 H2O2、0.1mL愈创木酚和0.1mL酶液,在470nm波长处测定吸光值,每隔1min记录1次,共记录5次,以每分钟内A470变化0.01为1个酶活性单位(U)。
1.2.2.5 多酚氧化酶(PPO)活性的测定
参照Qin等[12]的方法。取叶片约0.5g放入预冷的研钵中,加入液氮研磨至粉末。加入4mL 0.1mol/L磷酸钠缓冲液(pH 6.4,含1%PVP)再次匀浆并转入10mL离心管中。混合物在4℃下,15000r/min离心30min,取上清液测定酶活性。
反应混合液中含2mL 0.1mol/L的磷酸钠缓冲液(pH 6.4)和1.0mL酶液,加入0.5mL 0.2 mol/L邻苯二酚后,立即在398nm波长下测定吸光度增加的速率,酶活性用 ΔA420·omin-1mg-1protein-1表示。
1.2.2.6 苯丙氨酸解氨酶(PAL)活性的测定
PAL活性的测定采用辛建华等[13]的方法。
称取待测植物样0.5g在预冷的研钵中,加入5 mL 0.1mol/L磷酸缓冲液(pH 7.5)和少量石英砂,研磨成匀浆,用同一缓冲溶液定容,4000r/min离心15min,上清液为PAL的粗提液(临用时稀释10倍)。提取缓冲液:称取77mg DTT、5g PVP,用0.1mol/L磷酸钠缓冲液(pH 7.5)溶解,定容至100mL,即得到提取缓冲液,4℃储藏备用。
配制酶的反应体系包括:3.9mL磷酸缓冲溶液,1mL的儿茶酚和0.1mL的酶液。以煮过失活的酶液为对照作2组重复实验。
反应体系加入酶液后,于37℃保存10min,迅速放入冰浴中,立即加入2mL 20%TCA,5000r/min,离心10min,收集上清液,并适当地稀释,于525nm波长下测定其吸光度,酶活性用U·min-1mg-1protein-1表示。
1.2.3 数据分析方法
采用Excel 2003和SPSS 17.0软件进行数据处理和分析。图表中数据为平均值。采用方差分析并对平均数进行显著性检验(P<0.05)。
2 结果与分析
2.1 施硅对叶螨为害后棉花叶片的症状观察
本试验通过对被叶螨为害后棉花叶片的观察发现,施硅处理和不施硅处理在接种叶螨后的24h内为害症状变化不明显,从接种后第2天开始,不施硅处理植株观察到叶片上出现密布针点状的失绿斑,受叶螨为害程度达到2级危害,而喷施硅和基施硅的处理则变化不明显;到第5~6天观察到不施硅处理的接种叶螨的叶片逐渐变暗红(图1),受叶螨为害程度达到3级危害,而施硅处理的接种叶片才出现针点状的失绿斑。而喷施硅和基施硅2个处理之间的症状差异不明显。

图1 土耳其斯坦叶螨为害对大田棉花叶片的影响Fig.1 The effect of inoculation of T.turkestani on field cotton leaves with or without Si application
2.2 施硅对叶螨为害后棉花叶片的虫害指数调查
调查结果如图2所示。
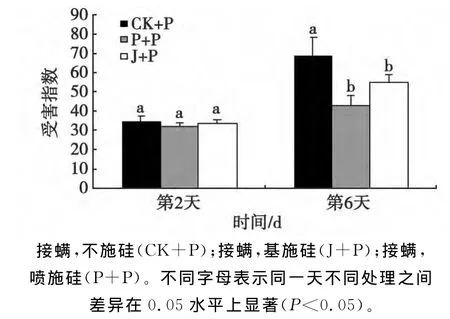
图2 叶螨为害棉花叶片受害指数Fig.2 Damage index of the leaves of T.turkestani-inoculated cotton with or without Si application
由图2可见,各处理随取样天数的增加,受害指数也随之增加。在受叶螨危害第2天的棉花叶片,不施硅处理、喷施硅处理和基施硅处理受害指数分别为34.72、31.94和33.53,3种处理之间差异不显著;但是当叶螨为害时间达到第6天时,不施硅处理、基施硅处理和喷施硅处理棉花叶片的受害指数与第1次取样相比,分别升高了49.78%、33.3%和25.8%,虽然2种施硅方式(基施硅处理和喷施硅处理)的受害指数依然有升高,但是与不施硅处理的受害指数之间的差异显著,说明施硅可以有效抑制叶螨对棉花植株的受害指数。
2.3 施硅及叶螨为害对棉花干物质积累量的影响
由图3可见,随着处理天数的增加,各处理棉花干物质积累量均逐渐升高。在不接螨条件下,第6天取样时,基施硅处理比对照组和喷施硅处理干物质重分别高出45.23%和44.81%,达到显著水平,说明施硅(无论基施或喷施)均可以明显提高棉花干物质积累量。在接螨条件下各处理,第2天取样时各处理之间差异不显著,而在第6天取样时,基施硅处理干物质重比不施硅处理高出35.22%,呈显著性差异,而喷施硅处理与不施硅处理间差异不显著,而同样为基施硅处理在第6天时,不接叶螨的处理比叶螨为害处理干物质量高出23.92%,说明基施硅处理可以有效遏制叶螨对棉株的危害从而减轻棉花干物质积累量的损失。
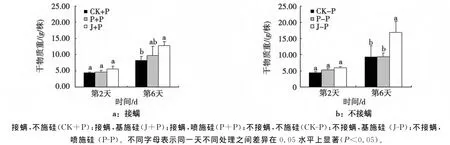
图3 不同处理对棉花干重的影响Fig.3 The dry weight of T.turkestani-inoculated cotton with or without Si application
2.4 施硅及叶螨为害对棉花中硅含量的影响
如图4所示,无论接螨与否,棉花植株中硅含量都随着取样天数的增加而增加。不接螨条件下各处理,在第2天和第6天基施硅处理与喷施处理和不施硅处理成显著差异,说明只有基施硅处理可以增加棉花中的硅含量,而喷施硅处理不能显著增加棉花中的硅含量;接螨条件下各处理,即受叶螨为害的棉花,在叶螨为害第2天既有显著差异,基施硅处理比喷施硅处理和不施硅处理分别高出41.85%和31.63%达显著水平;而在为害第6天时,两种施硅处理(喷施和基施)与不施硅处理均达显著水平,喷施处理和基施处理分别比不施硅处理高出56.81%和22.94%,说明棉株叶片在受到叶螨为害后可能启动防御响应,通过提高吸收硅能力主动应对虫害胁迫。

图4 不同处理对棉花硅含量的影响Fig.4 Si concentration of T.turkestani-inoculated cotton with or without Si application
2.5 施硅及叶螨为害对棉花叶片POD活性的影响
POD是植物体内普遍存在的,是与呼吸作用、光合作用及生长素的氧化有关的一种抗氧化酶。在害虫取食胁迫条件下,棉花会发生一系列应激反应并产生诱导抗性,其中抗氧化酶系统在这一防御机制中起重要作用。在本试验中,如图5所示,在接螨条件下,受叶螨为害第2天,不施硅处理的POD活性显著高于喷施硅处理和基施硅处理,随着处理天数的增加,第6天各处理POD活性均有升高,但不施硅处理还是高出喷施硅处理40.23%和基施硅处理32.18%。而不接螨处理,同一调查时间各处理间差异不明显。

图5 施硅对接种叶螨棉花叶片POD活性的影响Fig.5 The POD activity of T.turkestani-inoculated cotton with or without Si application
2.6 施硅及叶螨为害对棉花叶片PPO活性的影响
PPO是酚类物质氧化的主要酶,能够通过催化氧化形成有毒物质醌,而起到抵御虫害的作用。在本试验中如图6所示,叶螨为害的第2天,各处理之间差异不显著,而在叶螨为害第6天时,各处理多酚氧化酶活性相对于第2天均有所升高,但施硅处理上升幅度较大,喷施硅处理与不施硅处理相比上升了19.25%,基施硅处理与不施硅处理相比上升了21.7%。在不接螨条件下,不同调查时间下各处理差异不显著。
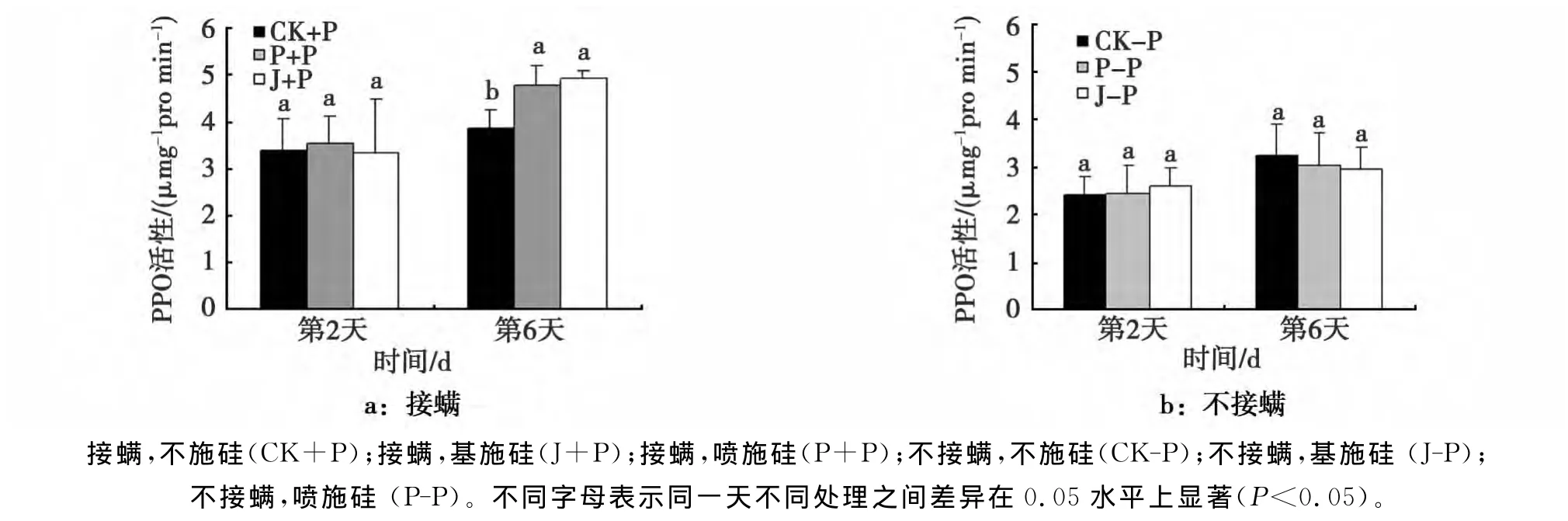
图6 施硅对接种叶螨棉花叶片PPO活性的影响Fig.6 The PPO activity of T.turkestani-inoculated cotton with or without Si application
2.7 施硅及叶螨为害对棉花叶片苯丙氨酸解氨酶活性的影响
苯丙氨酸解氨酶(PAL)是植物次生物质代谢中比较关键的一种酶,它是影响植物体内多种次生物质合成的主要途径之一-莽草酸途径。PAL活性的高低直接决定着以后一系列次生物质合成步骤中酶活性的高低。本试验研究结果表明,在接螨条件下,即受叶螨为害的棉花叶片中苯丙氨酸解氨酶活性如图7所示,在第2天各处理之间差异不显著,而在第6天喷施硅处理棉花叶片PAL活性比不施硅处理高出21.8%呈显著差异,而基施硅处理与其它处理差异不显著;在不接螨条件下,各处理在不同调查时间下均表现差异不显著。
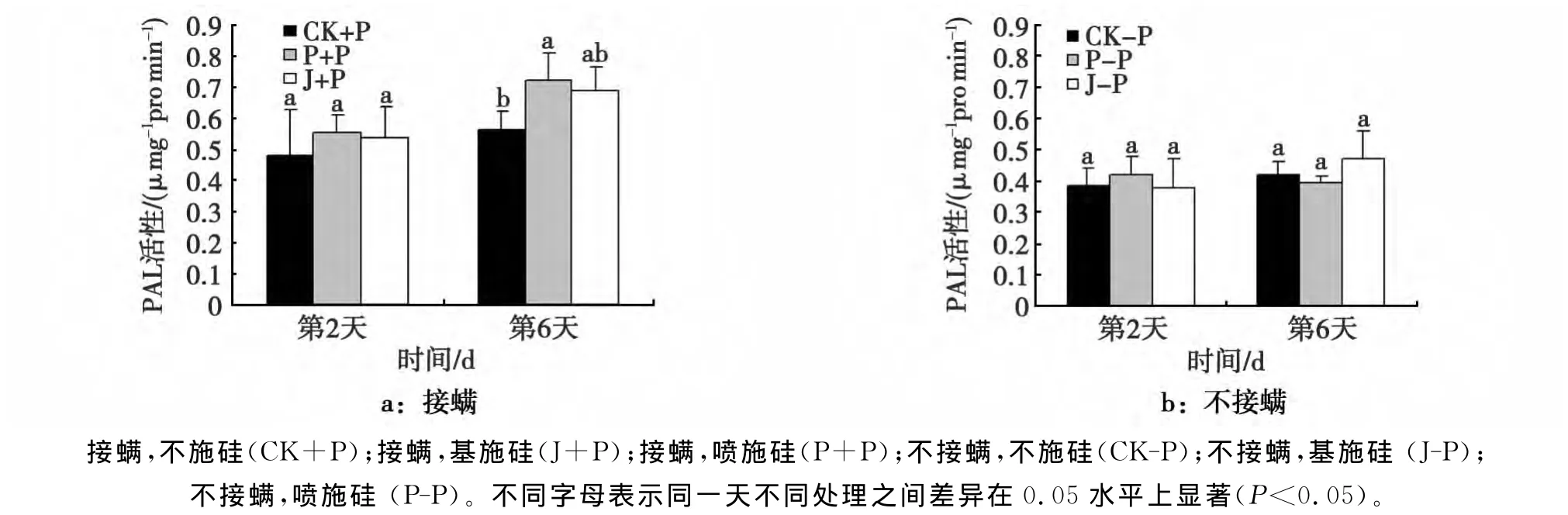
图7 施硅对接种叶螨棉花叶片PAL活性的影响Fig.7 The PAL activity of T.turkestani-inoculated cotton with or without Si application
3 讨论
硅对植物的潜在营养作用,一直受到学者们的关注。有研究[14]显示,硅能够促进植物的健康生长,改善机械性能,提高对不良环境的抵御能力。本研究结果表明,加硅处理尤其是基施硅处理,第6天棉花干物质积累量以及植株体内硅含量都显著高于不施硅处理,而施硅处理的受害指数要显著低于不施硅处理,这说明硅对棉花的生长有促进作用,硅提高了棉花抵御叶螨的能力。一般认为硅提高作物抗虫能力的原因是在作物体内形成硅化细胞,使茎、叶表层细胞壁加厚及角质层增加,从而提高其抗虫的能力。但越来越多的研究表明,硅可能参与寄主防卫反应,产生一系列的生理生化防卫机制以增强植株的抗性[15]。
植物在遭受植食性昆虫的攻击时,会在生理生化以及形态等方面做出一系列的适应性反应,植物对有害生物侵害的生理反应是以酶的催化活性来实现的。POD、PPO和PAL均为酚类代谢过程中的关键性酶,对酚类物质的形成、木质素和植保素的合成具有很重要的作用。这3种酶在植物的抗病虫机制中被广泛研究。
棉叶螨刺吸棉株会引起棉叶组织中O2-和H2O2等超氧物的过量生成,促使抗氧化酶系活性随机升高来清除这些活性氧对棉花的危害,从而强化棉花的自我防御能力。有研究[16]表明,POD在不同的寄主和防卫反应体系中表现是不一致的,甚至相矛盾。在本研究中,不同施硅处理,POD活性与棉花对叶螨的抗性成负相关,可能是POD具有清除体内活性氧的功能,由于施硅处理减轻了棉花叶片受伤害的程度,而被叶螨取食更严重的叶片所积累活性氧的量更高导致POD的活性更高。所以在叶螨为害条件下,施硅处理的叶片POD活性显著低于不施硅处理。
在本研究中,硅能显著提高受叶螨为害后棉花叶片中PPO和PAL的活性,这与硅增强棉花对棉叶螨的抗性是一致的(图1、图2)。PPO是普遍存在于植物体内的末端氧化酶,把酚类物质氧化成毒性更强的醌的一类酶,是一种广泛分布于植物里内,能催化多酚类氧化成醌类的金属酶,能直接将酚氧化成醌,醌对于微生物的毒性往往比原始的酚类物质更强,而起到抵御虫害的作用。本试验结果表明,受叶螨胁迫的棉花叶片,施硅处理棉花叶片PPO活性显著高于不施硅处理。也就是说PPO活性与寄主受为害程度呈正相关,这与兰金娜[17]研究的苜蓿在接虫后PPO活性随着为害时间的延长而升高的结果一致。
PAL是苯丙烷类代谢途径中关键的限速酶。PAL可催化L-苯丙氨酸形成反式肉桂酸,然后产生羟基化肉桂酸衍生物,为植保素和木质素提供苯丙烷碳骨架[18],并且该途径中间产物以及终产物木质素、黄酮等物质与植物对害虫的防御密切相关,所以也常被看做植物对病虫害为害的一种防御酶[19]。芦屹[20]研究表明,棉蚜为害的条件下,PAL活性的变化可以显示棉花抗蚜性的强弱,酶活性较大的品种能够有效的抑制蚜虫的进一步危害。本试验研究表明,受叶螨胁迫后,施硅处理能显著提高棉花叶片PAL活性(图6)。而程璐[21]研究得出,苜蓿在受蚜虫为害后,PAL活性随为害时间的延长而升高,与本研究结果一致。
从本试验结果来看,硅显著提高了受叶螨为害植株中酚类物质代谢途径的关键酶(PPO和PAL)活性,而降低了POD活性,参与了寄主与防卫反应有关的代谢,而不仅仅是简单的物理屏障作用。但硅对棉花抗虫的机制是复杂的,尚需要进一步从生理尤其是分子水平进行研究。
4 结论
1)通过观察叶螨为害棉花叶片得出,不施硅处理的棉花受叶螨为害症状要比喷施和基施处理的棉花叶片症状严重,施硅处理(喷施和基施)缓解了叶螨为害棉花产生的虫害症状。
2)喷施处理和基施处理的棉花叶片在叶螨为害第6天受害指数分别为43.05和55.07,具有同样高的抗性,都显著低于不施硅处理棉花叶片的受害指数68.72。施硅处理降低了叶螨为害棉花的受害指数。
3)硅在正常(非虫胁迫)条件下,对棉花生长具有明显的促进作用,也能缓解棉叶螨胁迫对棉花生长所产生的影响。
4)在虫害胁迫条件下,喷施和基施处理棉花体内硅含量在第6天都显著高于不施硅处理。而正常(非虫胁迫)情况下,基施处理棉花叶片中硅含量高于喷施处理和不施硅处理。
5)在叶螨胁迫条件下,喷施和基施处理棉花叶片中POD活性显著低于不施硅处理,表明POD与棉花对土耳其斯坦叶螨的抗性之间没有关系或呈负相关。而PPO和PAL活性显著高于不施硅处理,这说明,硅能够调控与抗性有关的酚类物质代谢,以增强棉花的抗虫性。
[1]于江南,王登元,曲丽红,等.自然因素对土耳其斯坦叶螨发生的影响和防治对策[J].新疆农业大学学报,2002,25(3):64-67.
[2]金德瑞,卜芸华,刘春原,等.棉叶螨危害对棉花生理和产量的影响[J].植物保护学报,1987,14(3):145-150.
[3]Keeping M G,Meyer J H.Silicon-mediated resistance of sugarcane to Eldana saccharina Walker(Lepidoptera:Pyralidae):effects of silicon source and cultivar[J].Journal of Applied Entomology,2006,130(8):410-420.
[4]Kvedaras M G Keeping.Silicon impedes stalk penetration by the borer Eldana saccharina in sugarcane[J].Entomologia Experimentalis et Applicata,2007,125(1):103-110.
[5]李玉泉,宋占午,王莱,等.叶螨危害对豇豆叶片超氧化物歧化酶及过氧化氢酶活性的影响[J].西北师范大学学报:自然科学版,2001,27(3):62-65.
[6]Flávia Batista Gomes,Jair Campos de Moraes,Custódio Donizete dos Santos.Resistance induction in wheat plants by silicon and aphids[J].Scientia Agricola,2005,62(6):547-551.
[7]Liang Y C,Sun W C,Si J,et al.Effect of foliarand rootapplied silicon on the enhancement of induced resistance in Cucumis sativus to powdery mildew[J].Plant Pathology,2005,54:678-685 .
[8]Liang Y C,Sun W C,Zhu Y G,et al.Mechanisms of silicon-mediated alleviation of abiotic stresses in higher plants:a review[J].Environmental Pollution,2007,147:422-428.
[9]张建萍.新疆农业螨类[M].北京:中国农业出版社,2008.
[10]王继朋,王贺,张福锁,等.温度对钼蓝比色法测定植物样品中硅的影响[J].土壤通报,2004,35(2):169-172.
[11]马丽,侯振安,梁永超,等.NaCl胁迫对棉花幼苗生理特性的影响[J].石河子大学学报:自然科学版,2008,26(2):180-184.
[12]Guo Z Qin,Shi P Tian.Enhancement of biocontrol activity of Cryptococcus laurentii by silicon and the possible mechanisms involved[J].Phytopathology,2005,95(1):69-75.
[13]辛建华,傅振清.苯丙氨酸解氨酶、多酚氧化酶与黄瓜抗枯萎病的关系[J].石河子大学学报:自然科学版,1997,1(1):47-50.
[14]Epstein E.The anomaly of silicon in plant biology[J].Proceedings of the National Academy of Sciences,1994,91:11-17.
[15] Wilfried Rémus-Borel,James G Menzies,Richard R Bélanger.Silicon induces antifungal compounds in powdery mildew-infected wheat[J].Physiological and Molecular Plant Pathology,2005,66(3):108-115.
[16]葛秀春,宋凤鸣.稻瘟菌侵染后水稻幼苗活性氧的产物与抗病性的关系[J].植物生理学报,2000,26(3):227-231.
[17]兰金娜.苜蓿苗期对苜蓿斑蚜刺吸胁迫的生理防御机制研究[D].兰州:甘肃农业大学,2007.
[18]高必达,陈捷.生理植物病理学[M].北京:科学出版社,2006.
[19]张丽,常金华,罗耀武.不同高粱基因型感蚜虫前后POD,PPO,PAL酶活性变化分析[J].中国农学通报,2005,21(7):40-42.
[20]芦屹.新疆不同棉花品种(系)的抗蚜性评价及其抗性机理研究[D].石河子:石河子大学,2008.
[21]程璐.苜蓿生理生化抗蚜机制初步研究[D].兰州:甘肃农业大学,2009.

