Toll样受体2的研究进展
赫天一,王 泽,陆宇燕,刘宏鑫
(沈阳师范大学 化学与生命科学学院,沈阳 110034)
0 引 言
Toll样受体家族(Toll like receptors,TLRs)是先天性免疫系统中一个经典的膜受体家族,在生命系统的进化演绎过程中,其结构、功能及信号转导机制都极其古老和保守。1980年Nüsslein-Volhard等发现目标基因的突变可导致黑腹果蝇胚胎的背腹发育发生变化,该基因还可介导果蝇对真菌和革兰氏阳性细菌的免疫感染反应,并首次有了“Toll”这一概念[1];对于此类不具备获得性免疫的昆虫动物,Toll蛋白充当了先天性免疫应答中抗菌多肽的角色[2]。1994年Oshiumi等人首次证实人类也存在TLRs[3],时至今日我们已经可以确定上至脊椎动物下至低等的多孔动物,甚至植物当中都存在着Toll蛋白的类似蛋白群体,并被统称为“Toll样受体家族”。Akihiro等对包括无颌类七鳃鳗[4],硬骨鱼河豚[5],鸡[6]以及人类和小鼠在内的几种脊椎动物的全基因组分析发现这些动物都存在TLRs系统,但生活环境的差异也导致TLRs出现了种间的差异[7]。各物种的TLRs系统皆通过特异性的识别不同病原体相关分子模式(pathogen associated molecular patterns,PAMPs),激活先天性免疫中保守的防御基因,引导获得性免疫[8];这种识别几乎涵盖了机体所能遇到的所有病原体或其产物,赋予了生命先天全面抵抗感染的能力。其中TLR2为家族中识别最多PAMPs分子的成员,得到广泛的关注,目前已经成为治疗包括败血病、自身免疫疾病、癌症等多种疾病的新靶点[9],具有非常大的研究价值与应用潜质。
1 TLR2的分布
1997年Rock等通过对人类不同组织和癌细胞株TLRs的cDNAs进行放射性标记,得到人TLRs基因在染色体上的定位,TLR1,2,3,6,10位于4号染色体;TLR4位于9号染色体;TLR5位于1号染色体;TLR9位于3号染色体[10]。TLRs分布的细胞多达20余种,以TLR2分布的最为广泛,哺乳动物的TLR2主要在肺脏,心脏,大脑和肌肉组织中表达,TLR1主要表达在卵巢,肝脏和脾脏,TLR3高表达于胰腺和胎盘,TLR4主要表达在胎盘和肺组织,TLR5微量表达于卵巢和外周血中的单核细胞[11]。TLR2在机体免疫系统的第一线防御中广泛分布,除T细胞为TLR2-外,B细胞、单核细胞、巨噬细胞,中性粒细胞等均为TLR2+,TLR2在脾脏和外周血白细胞中更是高水平的表达;近年研究证实TLR2在树突细胞上也有分布及表达[9]。
2 TLR2蛋白的结构特征
随着全基因分析技术的发展,1988年Hashimoto等人研究发现果蝇Toll蛋白是一种结构极其保守的Ⅰ型跨膜蛋白,并阐明了其基本结构[12]。Toll样受体蛋白主要由3个经典部分组成:跨膜区,胞内区及胞外区(见图1)。TLR2及其家族成员的跨膜区结构简单,是一段富含半胱氨酸的结构域,横跨细胞膜连接TLRs的胞内区与胞外区。TLRs的胞内区是一段约200个氨基酸残基构成的结构域[13],因与白介素1受体(IL-1R)的胞内区高度同源而被称为Toll-IL-1受体结构域(Toll-IL-1receptor domain,TIR),在TIR中有23个氨基酸位置是固定的,即-D-K-YDAF-SYS····GYKLCI-RD-PG···FWKK-,TIR结构域因其高度的保守性而成为家族的标志性结构特征。同时TIR也是TLRs与其下游蛋白激酶互作的关键区域,TLRs结合配体后,TIR结构域发生构象改变,通过同型蛋白之间的相互作用进行细胞内信号转导,招募胞浆内含有TIR结构域的接头蛋白分子,激活胞内信号转导途径[14]。胞外区是一个位于蛋白N端的亮氨酸富集区域(Leucine rich repeats,LRRs),通常由17个~31个LRRs组成。主要行使识别受体或与其他辅助受体形成受体复合物的功能,该区域的差异性决定了各个TLR分子配体的特异性和专属性。同时在进化过程中,胞外结构域迫于选择的压力,演化速度快,稳定性也极其不佳。Hibino等根据胞外LRRs结构的不同将TLR家族分为两类,脊椎动物类型(V-type)V 型和原生动物类(P-type)P型[15];P型的TLRs是细胞活素的识别受体,同时参与胚胎早期发育和机体的免疫应答;而脊椎动物的TLRs都为V型,作为PAMPs的识别受体而存在[16]。头索动物文昌鱼具有一个扩展的TLR家族,包括至少36个V型TLRs,12个P型TLRs和40个TIR包含受体,而棘皮动物海胆有211个V型TLRs和12个TIR受体[17]。TLR2主要利用LRRs参与形成PAMPs受体复合物,形成蛋白质 蛋白质——相互作用基元[17]。2002年,张林利用HL-60细胞株发现人TLR2胞外结构域由19个LRR重复序列组成,构成多种细胞表面分子的天线,空间排布方式与核糖核酸酶抑制因子RI的结构类似;表现为由氮、α碳及羰基原子构成的彩条样结构,其中负静电势明显集中的“粘性”区域可能参与TLR2信号转导途径中胞外结构域与辅助受体之间的特异性结合[18]。
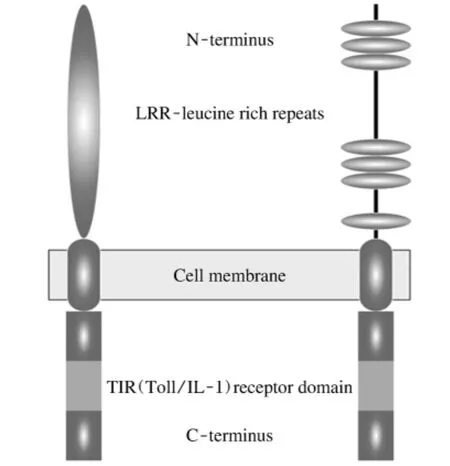
图1 人类TLRs和TLR2结构模式图
3 TLR2识别的配体
TLR家族主要识别病原微生物固有的保守成分——PAMPs,一类是以糖类和脂类为主的细菌胞壁成分,其中最为常见并具有代表性的是革兰氏阴性菌细胞壁成分脂多糖(1iposachride),革兰氏阳性菌胞壁成分肽聚糖(proteoglycan),分枝杆菌糖脂(glicolipid)和酵母菌胞壁成分甘露糖(mannose);另一类是病毒产物及细菌胞核成分,如非甲基化寡核苷酸CpGDNA、单链RNA、双链RNA[19]。TLR2具有广泛的从病毒到寄生生物的识别谱,可识别革兰氏阳性菌的肽聚糖和脂磷壁酸,革兰氏阴性菌细胞壁的脂蛋白和脂肽聚糖,革兰氏阴性菌、螺旋菌和支原体细胞膜的脂蛋白和脂肽,霉菌的细胞壁成分,真菌的酵母聚糖,某些寄生生物,原生动物细胞膜的糖脂及病毒等。大部分配体能直接与TLR2结合诱导免疫应答[20]。但TLR2对细菌细胞壁肽聚糖的识别则需要TLR1和TLR6的参与,协助识别酰化的脂肽[21]。最新的研究显示,TLR2还可以识别非病原微生物配体,如产生于组织损伤的内源性损伤相关分子模式(danger associated molecular patterns,DAMPs)[22]和其他发炎组织的产物如 HMGB1,热休克蛋白等[23]。
4 TLR2介导的信号转导
TLRs是先天性免疫应答的传感器,它可以通过识别PAMPs或DAMPs,致下游目的基因的活化,诱导免疫应答的发生。此过程中涉及的信号转导通路大致有两种类型,一类是髓样分化因子(myeloid differentiation factor 88,MyD88)非依赖型[24],以TLR3为代表。另一类是 MYD88依赖型,包括TLR2在内的其他TLR家族成员皆为此类型。MYD88是TLRs信号转导系统中的关键性分子,是从海绵动物到脊椎动物保留的唯一一个TIR适配器[16],当MYD88与激活的TIR胞质区形成蛋白质复合体以后,触发下游激酶的级联反应[24]。TLR2与配体结合后可以通过两种不同的信号途径传递胞外讯息:NF-ΚB转录依赖途径和NF-ΚB转录非依赖途径。哺乳动物的TLRs和果蝇的Toll蛋白共用Rel/NF-ΚB转录依赖途径中的信号分子[25],此过程可表述为:MYD88和 MAL结合诱导IΚBαkinase激酶的活化,TAK1进一步激活NIK,NIK再激活IKKα/β,有活性的IKKα/β与IΚB结合,使IΚB磷酸化,释放IΚB所携带的NF-ΚB两个亚基p50和p65,指导目的基因转录和炎性介质的释放。而在NFΚB转录非依赖途径中具有活性的TAK1激活MKK3/6,进而激活p38MAPK,再激活NF-ΚB,使其释放p50和p65进入细胞核,指导目的基因转录和使细胞释放炎性因子[23]。事实上,含TIR结构域的接头蛋白分子的不同决定了TLR家族介导的免疫应答的不同。Takeda等最近发现TLR2具有一个独立且特殊的信号系统,即另一个适配器分子TIRAP/MAL,通过MYD88和Mal的协同作用够促成下游信号通路的活化[26-27]。TIR接头蛋白在某种程度上决定了TLR家族成员选择信号活化、确认细胞应答和目标基因的活性的依据,也为预防和治疗TLRs介导的疾病提供了全新的审视视角。
5 TLR2的生物学功能
TLR2最突出的生物学功能就是直接或间接的促进炎症因子的合成与释放,具有显著的抗菌抗病毒作用。TLR2参与的抗病毒应答主要表现为宿主在受到鼠巨细胞病毒刺激后诱发单核细胞产生IFN-β等细胞因子[28],TLR2敲除小鼠NK细胞的活性受损,易感染鼠巨细胞病毒[29];重组腺病毒AdTLR2和AdTLR4能有效抑制LPS导致的炎性细胞的活化,从而减少细胞因子如TNF-α、IL-1β、IL-6、IL-10和IL-13的释放[30]。通过建立猪肺炎支原体感染模型证明肺炎支原体可能通过TLR2信号传导通道启动先天性免疫系统并诱发炎症反应[31]。Ju等利用弓形虫速殖子侵染人胚胎期肠上皮细胞株,发现TLR2虽然可以识别并诱导IL-8和其他化学增活素的产生,但缺少TLR2并不能增加寄生物对宿主造成的影响或降低TH1的应答,暗示了TLR2在寄生虫早期感染中的多余角色[32]。另外革兰氏阳性菌细胞壁成分是目前畜牧业粉尘中大量存在的浓聚物,是诱导气道炎发病的主要因素,Poole等发现TLR2激动剂预先刺激的WT小鼠可对猪舍有机粉尘提取物引起的应答反应产生抑制作用,对大型养殖动物的气道炎预防与治疗具有重要实践意义[33]。
此外,TLRs在不同的肿瘤,肿瘤的不同发展阶段显示出了差异性的生物学作用,张建军等发现TLR2信号通路可能促进了胰腺癌的恶性发展[34-35];罗冰等研究认为小鼠肿瘤细胞表达的TLR2介导了PGN对肿瘤生长的抑制作用[36-37],说明TLR2的表达是肿瘤生长的必须条件;王凡等进一步验证了上述观点,并证实小鼠胶质瘤细胞中高表达的TLR2能有效促进癌细胞的迁移[38];Kim等也证实对肿瘤细胞和巨噬细胞中的多功能蛋白聚糖–TLR2–TNF信号通路进行调控或许能够有效的预防和减少肿瘤的转移[39]。郭云蔚等研究显示TLR2和TLR4信号途径的激活有助于抗肿瘤免疫的启动,因此通过降低TLR2信号途径的抑制,有望获得对肝癌免疫逃逸的有效监视[40-41];由此可见TLR2不仅参与了不同癌症的发生、发展过程,更为癌症的免疫治疗提供了重要的切入点。
6 展 望
对于缺乏获得性免疫的果蝇来说,Toll基因参与的先天性免疫无疑为其提供了生命的保障,在漫长的进化过程中TLR家族逐渐成为激活先天性免疫,连接先天性免疫与获得性免疫的重要桥梁。随着对TLR2的配体识别,信号转导及其生物学功能等方面更多的认识TLR2介导的免疫应答网络化及其在临床疾病等应用领域的开发成为该研究领域的核心,也必将在日后的研究当中得到全面的解答。
[1]NÜSSLEIN-VOLHARD C,WIESCHAUS E.Mutations affecting segment number and polarity in Drosophila[J].Nature,1980,287(5785):795-801.
[2]MATSUGUCHI T,MUSIKACHAROEN T,OGAWA T,et al.Gene expressions of Toll-like receptor 2,but not Toll-like receptor 4,is induced by LPS and inflammatory cytokines in mouse macrophages[J].J Immunol,2000,165(10):5767-5772.
[3]NOMURA N,MIYAJIMA N,SAZUKA T,et al.Prediction of the coding sequences of unidentified human genes.I.The coding sequences of 40new genes(KIAA0001-KIAA0040)deduced by Analysis of randomly sampled cDNA clones from human immature myeloid cell line KG-1[J].DNA Res,1994,1(1):27-35.
[4]ISHII A,MATSUO A,SAWA H,et al.Lamprey TLRs with properties distinct from those of the variable lymphocyte receptors[J].J Immunol,2007,178(1):397-406.
[5]OSHIUMI H,TSUJITA T,SHIDA K,et al.Prediction of the prototype of the human Toll-like receptor gene family from the pufferfish,Fugu rubripes,genome[J].Immunogenetics,2003,54(11):791-800.
[6]YILMAZ A,SHEN S,ADELSON D L,et al.Identification and sequence analysis of chicken Toll-like receptors[J].Immunogenetics,2005,56(10):743-753.
[7]ISHII A,KAWASAKI M,MATSUMOTO M,et al.Phylogenetic and expression analysis of amphibian Xenopus Toll-like receptors[J].Immunogenetics,2007,59(4):281-293.
[8]WACK A,GALLORINI S.Bacterial polysaccharides with zwitterionic charge motifs:Toll-like receptor 2agonists,T cell antigens,or both[J].Immunopharmacol Immunotoxicol,2008,30(4):761-770.
[9]杨芳芳,陈成水.Toll样受体2的研究进展[J].医学综述,2008,14(11):1636-1639.
[10]ROCK F L,HARDIMAN G,TIMANS J C,et al.A family of human receptors structurally related to Drosophila Toll[J].Proc Natl Acad Sci U S A,1998,95(2):588-593.
[11]FUKUI A,INOUE N,MATSUMOTO M,et al.Molecular cloning and functional characterization of chicken toll-like receptors.A single chicken toll covers multiple molecular patterns[J].J Biol Chem,2001,276(50):47143-47149.
[12]HASHIMOTO C,HUDSON K L,ANDERSON K V.The Toll gene of Drosophila,required for dorsal-ventral embryonic polarity,appears to encode a transmembrane protein[J].Cell,1988,52(2):269-279.
[13]张炜,袁金铎,安利国.由不同接头分子介导的Toll样受体信号通路[J].细胞与分子免疫学杂志,2006,22(4):544-546.
[14]ROACH J C,GLUSMAN G,ROWEN L,et al.The evolution of vertebrate Toll-like receptors[J].Proc Natl Acad Sci U S A,2005,102(27):9577-9582.
[15]HIBINO T,LOZA-COLL M,MESSIER C,et al.The immune gene repertoire encoded in the purple sea urchin genome[J].Dev Biol,2006,300(1):349-365.
[16]PARKER J S,MIZUGUCHI K,GAY N J.A family of proteins related to Spätzle,the toll receptor ligand,are encoded in the Drosophila genome[J].Proteins,2001,45(1):71-80.
[17]YUAN S,HUANG S,ZHANG W,et al.An amphioxus TLR with dynamic embryonic expression pattern responses to pathogens and activates NF-kappaB pathway via MyD88[J].Mol Immunol,2009,46(11/12):2348-2356.
[18]张林,于文彬,马越云,等.Toll样受体2胞外域及其氨基端和羧基端片段的克隆与序列分析[J].第四军医大学学报,2002,23(12):1085-1089.
[19]PASQUIER L D,SCHWAGER J,FLAJNIK M F,et al.The immune system of Xenopus[J].Annu Rev Immunol,1989(7):251-275.
[20]孙守勋.Toll样受体2的研究进展[J].重庆医学,2008,37(5):533-535.
[21]OZINSKY A,UNDERHILL D M,FONTENOT J D,et al.The repertoire for pattern recognition of pathogens by the innate immune system is defined by cooperation between toll-like receptors[J].Proc Natl Acad Sci U S A,2000,97(25):13766-13771.
[22]PÅLSSON-MCDERMOTT E M,O'NEILL L A.The potential of targeting Toll-like receptor 2in autoimmune and inflammatory diseases[J].Ir J Med Sci,2007,176(4):253-260.
[23]LORNE E,DUPONT H,ABRAHAM E.Toll-like receptors 2and 4:initiators of non-septic inflammation in critical care medicine[J].Intensive Care Med,2010,36(11):1826-1835.
[24]QIU Yafeng,SHEN Yang,LI Xiangdong,et al.Molecular cloning and functional characterization of a novel isoform of chicken myeloid differentiation factor 88(MyD88)[J].Dev Comp Immunol,2008,32(12):1522-1530.
[25]BRIGHTBILL H D,MODLIN R L.Toll-like receptors:molecular mechanisms of the mammalian immune response[J].Immunology,2000,101(1):1-10.
[26]常晓彤,辇晓峰,王振辉.Toll样受体信号转导途径研究进展[J].生理科学进展,2011,42(5):340-346.
[27]TAKEDA K,AKIRA S.Toll receptors and pathogen resistance[J].Cell Microbiol,2003,5(3):143-153.
[28]BARBALAT R,LAU L,LOCKSLEY R M,et al.Toll-like receptor 2on inflammatory monocytes induces type I interferon in response to viral but not bacterial ligands[J].Nat Immunol,2009,10(11):1200-1207.
[29]SZOMOLANYI-TSUDA E,LIANG X,WELSH R M,et al.Role for TLR2in NK cell-mediated control of murine cytomegalovirus in vivo[J].J Virol,2006,80(9):4286-4291.
[30]孙守勋,李强,刘静,等.人Toll样受体2胞外区基因重组腺病毒的制备及鉴定[J].解放军医学杂志,2009,34(4):470-473.
[31]刘筱,方晓敏,邹晓龙,等.猪感染肺炎支原体后肺组织TLR2、TLR4及促炎症因子TNF-α、IL-1β基因表达的变化[J].江苏农业学报,2011,27(6):1305-1309.
[32]JU C H,CHOCKALINGAM A,LEIFER C A.Early response of mucosal epithelial cells during Toxoplasma gondii infection[J].J Immunol,2009,183(11):7420-7427.
[33]POOLE J A,WYATT T A,KIELIAN T,et al.Toll-like receptor 2regulates organic dust-induced airway inflammation[J].Am J Respir Cell Mol Biol,2011,45(4):711-719.
[34]张建军,吴河水,王 琳.TLR2和TLR4在胰腺癌中的表达及其意义[J].中国普通外科杂志,2010,19(3):239-244.
[35]PARK H D,LEE Y,OH Y K,et al.Pancreatic adenocarcinoma upregulated factor promotes metastasis by regulating TLR/CXCR4activation[J].Oncogene,2011,30(2):201-211.
[36]罗冰,刘艳君,杨翠兰,等.TLR2在小鼠肿瘤细胞表面的表达[J].中国实验诊断学,2006,10(11):1245-1247.
[37]OLIVEIRA-NASCIMENTO L,MASSARI P,WETZLER L M.The role of TLR2in infection and immunity[J].Front Immunol,2012,3(79):1-17.
[38]王凡,叶显宗,杨浪,等.TLR2在胶质瘤细胞GL261的高表达及其激活后增强迁移的作用[J].成都医学院学报,2012,7(1):28-36.
[39]KIM S,TAKAHASHI H,LIN W W,et al.Carcinoma-produced factors activate myeloid cells through TLR2to stimulate metastasis[J].Nature,2009,457(7225):102-106.
[40]郭云蔚,李永伟,尉秀清,等.TLR2和 TLR4在原发性肝癌中的表达[J].中国病理生理杂志,2008,24(10):1912-1915.
[41]FRENCH S W,OLIVA J,FRENCH B A,et al.Alcohol,nutrition and liver cancer:role of Toll-like receptor signaling[J].World J Gastroenterol,2010,16(11):1344-1348.

