大黄素-镁(Ⅱ)配合物的合成、表征及抗氧化活性研究
潘晓丽,向 晖,谢运飞,章从恩,董小萍
(成都中医药大学药学院,中药材标准化教育部重点实验室,四川成都 611137)
自Rosenberg[1]发现顺铂的抗癌活性以来,无机成分中金属元素的药理活性日益受到人们的关注,基于金属配合物的药物研究得到了迅速发展[2]。许多事实证明,中药中无机元素具有重要的药理作用及活性,对于发挥中药的疗效有着十分重要的作用,中药有效成分往往不单纯是有机成分,而多是由有机成分和金属元素组成的配合物[3]。金属离子与中药化学成分形成配合物后往往改变或增强其活性,例如抗菌、抗肿瘤、抗氧化等[4]。将中药有效成分与金属离子进行配合发挥两者的协同作用,是提高中药化学成分活性的有效途径[5-6]。
大黄素(1,3,8-三羟基-6-甲基蒽醌)由于其结构中有相邻的羰基和羟基,能与金属离子形成配合物。唐睿等[7]采用ICP-AES法测定了大黄中5种微量元素(镁、铁、锰、锌、铜)的量,结果表明大黄生药中镁的量最高。本实验通过合成大黄素-镁(Ⅱ)金属配合物,研究其可能的配位结构及抗氧化活性,可以从一个崭新的角度探索中药新药的开发方法,具有很大的研究意义。
1 试剂与仪器
核磁共振氢谱采用BRUKER AM—400型超导核磁共振仪(DMSO-d6作溶剂测定);红外光谱采用BRUKER Tensor-27型傅立叶变换中红外光谱仪测定;UV—1700型紫外分光光度计;PH计采用PHB—8型PH计。
大黄素(成都康邦生物生物科技有限公司,纯度大于98.5%);二苯代苦味肼基自由基(DPPH·,美国Sigma公司),羟甲基氨基甲烷(tris,美国Sigma公司)、N-甲基吩嗪甲基硫酸盐(PMS,美国Sigma公司),还原性辅酶I二钠盐(NADHNa2,美国Sigma公司),氯化硝基四氮唑蓝(NBT,美国Sigma公司),C4H6O4Mg·4H2O,无水乙醇,无水甲醇等试剂为国产分析纯,实验用水为离子交换蒸馏水。
2 配合物的合成[8]
称取1 mmoL大黄素(270 mg)溶于60 mL无水乙醇,40℃电磁搅拌,待大部分配体溶解后得黄色澄清溶液,加入0.5 mmoL(107.23 mg)C4H6O4Mg·4H2O(醋酸镁)的15 mL无水乙醇溶液,逐滴加入氨水的乙醇溶液(1∶1,V∶V),调节反应溶液的pH值至9.5,溶液很快有橙红色沉淀生成,继续以反应温度为40℃搅拌反应12 h,将溶液静置过夜真空抽滤,依次用无水乙醇及乙醚分别将沉淀洗涤数次后,真空干燥72 h,得粉末状固体产物。
3 配合物的EDTA滴定
称取大黄素-镁配合物约60 mg(记为m),在900℃马弗炉中灼烧8 h至恒重得氧化镁粉末,以稀硫酸溶解,加入pH=10的氨-氯化铵缓冲液5 mL,铬黑T指示剂0.02 g,加入1∶1氨水数滴至产生白色氢氧化镁沉淀,加水50 mL。以标定后的EDTA(Cedta)滴定,记下消耗的EDTA体积数(Vedta)。同时做空白实验,其中金属镁含量计算公式为:
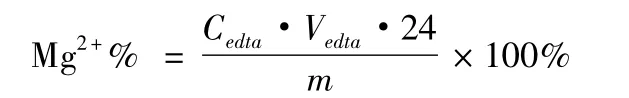
4 抗氧化活性实验
4.1 配合物对DPPH·自由基的清除作用 取1 mL试样与3 mL的8 mg/L DPPH无水甲醇溶液混均匀,暗室条件下反应30 min,于517 nm[9]处测定吸光度(A样)。以1 mL甲醇代替试样按照上述步骤进行反应,测定空白吸光度(A0)。
4.2 配合物对O2-·自由基的清除作用 由NADH/PMS体系产生[10],本实验对其略作修改。反应体系为Tris-HCl溶液(0.05 mol/L,pH=8),其中含有 10μmol/L PMS,50μmol/L NADHNa2,25μmol/L NBT,以及不同质量浓度的1 mL试样(分别取0.4 mg/L,0.2 mg/L,0.1 mg/L,0.05 mg/L,0.025 mg/L)。室温反应5 min后,在386 nm波长处测定吸光值(A样),1 mL蒸馏水代替试样按照上述步骤进行反应,测定空白吸光度(A0)。
4.3 配合物对·OH自由基的清除作用 采用Fe2+-H2O2-亚甲蓝体系[11],在5 mL量瓶中依次加入1 mLTris-HCl缓冲溶液(0.05 mol/L,pH=8),1.5 mL亚甲蓝(0.02 g/L),0.5 mL FeSO4溶液(2 mmol/L),0.5 mL的0.5%H2O2溶液,以及不同质量浓度的1 mL试样(分别取0.4 mg/L,0.2 mg/L,0.1 mg/L,0.05 mg/L,0.025 mg/L),蒸馏水稀释至刻度,40℃水浴中加热反应60 min,1 mL蒸馏水代替试样按照上述步骤进行反应,测定空白吸光度(A0)。
以上自由基清除率计算公式为:清除率=[(A0-A样)/A0]×100%
5 结果与讨论
5.1 配合物的紫外光谱 将大黄素和大黄素-镁(Ⅱ)配合物配成质量浓度为2.0×10-5mol/L的无水甲醇溶液,在200~500 nm范围内进行UV-vis扫描分别得吸收光谱(见表1)。比较大黄素和大黄素-镁(Ⅱ)配合物紫外吸收光谱可知,大黄素在219、253、289 nm处出现三个比较强吸收带,是苯环共轭体系、醌样结构谱带,大黄素-镁在223、264、293 nm处出现吸收带,吸收峰位置发生一定程度移位,吸收强度减弱;大黄素在438 nm出现醌羰基吸收带,而大黄素-镁(Ⅱ)配合物在461 nm处出现吸收峰,比大黄素吸收带红移。峰位移动的原因可能是:大黄素与金属离子形成配合物后,整个分子中电子的离域程度增大,致使电子跃迁时需要的能量降低,使吸收峰发生红移。

表1 大黄素及大黄素-镁(Ⅱ)的UV(nm)主要数据
5.2 配合物的红外光谱 大黄素与大黄素-镁(Ⅱ)配合物的红外光谱主要特征峰(见表2)。配合物中原配体的特征峰1871 cm-1消失,同时配体在1624 cm-1(ν==C O)处的强吸收移至配合物的1601 cm(ν==C O),说明羰基氧与镁配位;配体中酚羟基的伸缩振动的吸收峰3475 cm-1在配合物中显著减弱,说明酚羟基与镁配位。同时在592 nm-1出现了系Mg—O伸缩振动的吸收峰[12],进一步说明配合物的形成。
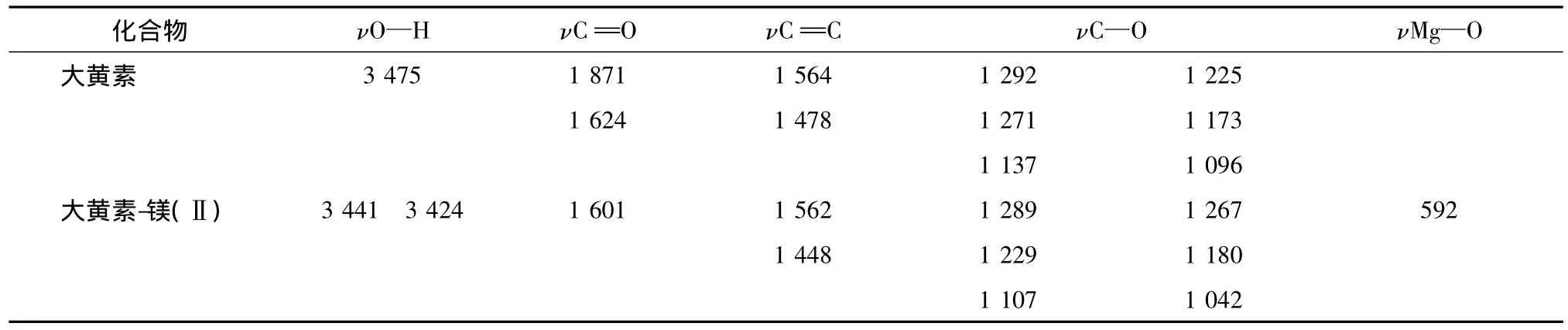
表2 大黄素及大黄素-镁(Ⅱ)的IR(cm-1)主要数据
5.3 配合物的核磁共振氢谱 大黄素-镁配合物的1H NMR(见表3)。δ 12.0~14(m,2H)出现一极弱多重峰,δ5.76~7.72(m,8H)出现一多重宽峰。考虑到大黄素的1,8位酚羟基性质相似,均可与9位羰基氧形成分子内氢键,由于3位羟基的给电子共轭效应及6位甲基的给电子诱导效应影响差异,可推测8位羟基易于解离。因此推测,配体分子中的8位酚羟基失去质子并通过9位氧原子与金属离子形成配合物。
5.4 配合物的EDTA滴定结果 配合物中镁离子测定结果为4.26%,理论值为4.27%。制得的大黄素-镁配合物为两分子大黄素与一分子镁离子结合形成,实测值与理论值基本符合。结合上述分析结果,认为大黄素-镁(Ⅱ)配合物的可能结构见结构图1。

表3 大黄素及大黄素-镁(Ⅱ)的1H NMR的数据(DMSO)
5.5 配合物的抗氧化活性
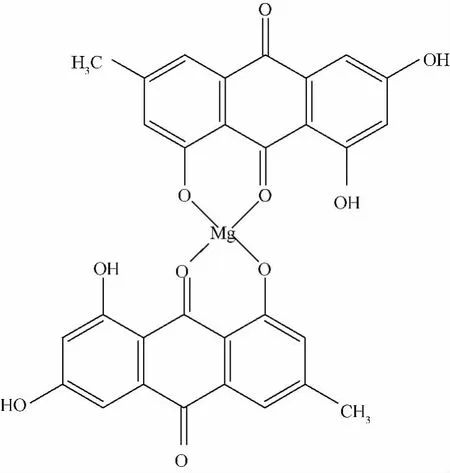
图1 大黄素-镁Ⅱ配合物结构图
5.5.1 配合物对DPPH·自由基的清除作用 配合物和配体清除DPPH·自由基的结果见图2,由图可知,大黄素和大黄素-镁均具有一定抗DPPH·自由基活性,且配合物的活性明显比相同量的配体大黄素高,但抑制率不高,分析原因有可能是实验在甲醇中进行,大黄素-镁配合物在甲醇中比较稳定,不易形成稳定的自由基中间体。
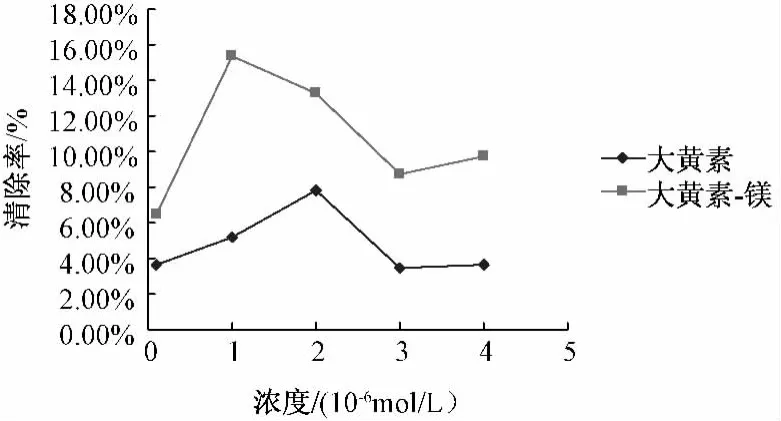
图2 大黄素-Mg配合物及配体清除DPPH自由基活性
5.5.3 配合物对·OH自由基的清除作用 配合物和配体清除·OH自由基的结果见图4,由图可知,镁配合物和配体大黄素均具有抗·OH自由基活性,相同浓度的镁配合物抗·OH自由基活性较高,明显高于配体大黄素,表明配体大黄素和镁离子产生了协同作用,提高了其抗·OH的生物活性。
6 结论
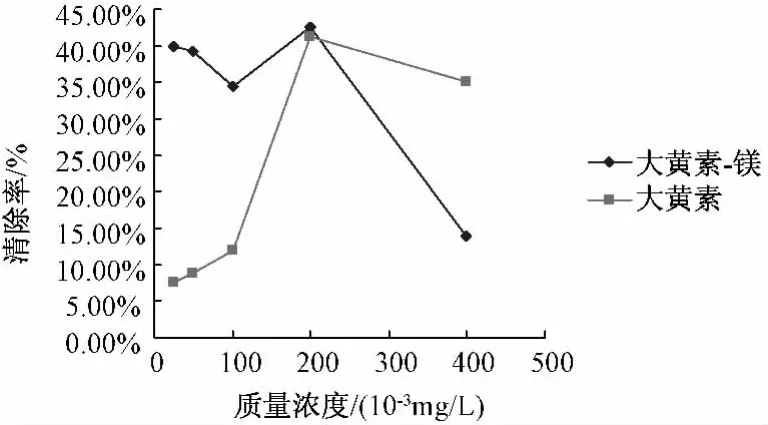
图3 大黄素-Mg配合物及配体清除·自由基活性
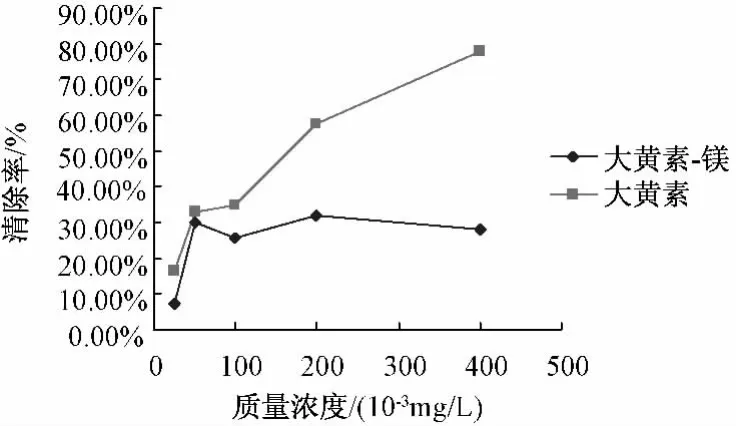
图4 大黄素-Mg配合物及配体清除·OH自由基活性
本实验以大黄素为配体合成了大黄素-Mg配合物,利用核磁共振氢谱,紫外光谱,红外光谱,配位滴定等方法对其结构进行了表征,确定了配合物的可能组成。本实验对比了大黄素与大黄素-Mg配合物对超氧阴离子自由基、羟基自由基、DPPH自由基等三种自由基的清除率,结果证明,大黄素-Mg配合物的抗氧化活性相对于配体大黄素有显著提高,表明有可能是配体与金属离子之间存在协同抗氧化作用。但由于配合物一分子含有两分子大黄素配体,增加了酚羟基的数目,有实验证明酚类物质的抗氧化性很多时候与酚羟基的数目及位置有关[13-15],故具体的构效关系还有待于进一步研究。
[1]Rosenberg B,Vancamp L,Trosko J E,et al.Platinum componds:a new class of potent antitumour agengts[J].Nature,1969,222(5191):385-386
[2]Orvig C,Abrams M J.Medicinal inorgantic chemistry:Introduction[J].Chem Rev,1999,99(9):2201-2204.
[3]朱旭祥,茅涵斌.中药研究前沿一中药配位化学[J].中草药,1997,28(6):373-375.
[4]陈振锋,彭 艳,谭明雄,等.基于中药活性成分的金属基抗肿瘤药物前期研究[J].化学进展,2009,21(5):929-933
[5]谭明雄,陈振锋,罗旭健,等.天然药物有效成分的金属配合物研究进展[J].林产化学与工业,2008,28(6):93-99
[6]钟地长,张淑凤,陈振锋,等.天然产物黄酮类化合物的提取纯化及其金属配合物的研究进展[J].化学世界,2006(9):561-573
[7]唐 睿,温金莲,严志红.ICP-AES法测定中药大黄中五种微量元素[J].广东微量元素科学.2005,12(12):38-40.
[8]赵 芳,梁 慧,程 慧,等.大黄酸金属配合物的合成、表征及抗氧化活性研究[J].化学学报,2011,69(8):925-930.
[9]付万平,张豫东,马旭元,等.芦荟大黄素锌配合物的抗氧化活性[J].光谱实验室,2012,29(2):1155-1157.
[10]Sun C,Wang J W,Lei F,et al.Free radical scavenging and antioxidant activities of EPS2,an exopolysaccha-ride produced by amarine filam en tous fungusK eissleriella sp.YS 4108[J].Life Sci,2004,75(9):1063-1073.
[11]李 芳,郑怀礼.黄酮配合物抗自由基活性的亚甲基蓝光测定体系的研究[J].光谱学与光谱分析学,2006,26(12):2294.
[12]中本一雄.无机和配位化合物的红外和拉曼光谱[M].黄德如,译.北京:科学出版社,2001.138.
[13]Rice-Evans C A,Miller N J,Bolwell G P,et al.The relative antioxidant activities of plant-derived polyphenolic flavonoids[J].Free Radic Res,1995,22(4):375-383.
[14]Husain S R,Cillard J,Cillard P.Hydroxyl Radical Scavenging Activity of Fla-vonoids[J].Phytochemistry,1987,26(9):2487-2491.
[15]Pokorny ,J Major factors affecting the antioxidant of lipids.in atuoxidation of unstaturated lipids(Chan H W S,ed)[M].London:Academic Press,1987:141-206.

